肝硬化合并肝肺综合征患者的影响因素及右心声学造影的诊断价值
2022-10-19唐理斌顾小丽何维曜臻夏加伟李海雯
唐理斌, 顾小丽, 何维曜臻, 祁 飞, 夏加伟, 李海雯
(1.云南省昆明市第三人民医院/云南省传染性疾病临床医学中心, 云南 昆明, 650041;2.云南省昆明市儿童医院, 云南 昆明, 650228)
肝肺综合征(HPS)是指在有肝脏疾病的背景下,出现肺内血管扩张(IPVD)所致的氧合功能异常的气体交换异常性疾病,以动脉氧合异常、IPVD和肝脏疾病三联征为主要特征。HPS主要发生于肝硬化和门静脉高压[1-2]患者中,但在急性肝衰竭、缺血性肝炎、慢性病毒性肝炎等肝病患者中也有报道,有5%~32%的终末期肝病患者可发展为HPS, 且死亡率显著增加[3]。中国乙型肝炎病毒携带者超过1亿[4], 而目前HPS的发病机制仍不明确,除肝移植外,临床尚无特效的防治手段,故早期筛查及诊断就尤为重要。2016年国际肝移植学会发布的《HPS与门脉性肺动脉高压的诊断与管理实践指南》[5]指出,增强经胸超声心动图造影(CE-TTE)也称右心声学造影,是诊断HPS的金标准。本研究采用右心声学造影诊断HPS, 研究其危险因素,现将结果报告如下。
1 资料与方法
1.1 临床资料
纳入标准: ① 符合肝硬化诊断标准者[6-8], 病因不限; ② 年龄18~75岁者; ③ 可以配合检查者; ④ 对本研究知情同意并签署知情同意书者。排除标准: ① 临床资料不完整者; ② 不能配合完成检查者; ③ 伴有其他心肺疾病或血液学疾病者; ④ 合并肝癌或其他恶性肿瘤病史者; ⑤ 妊娠或哺乳期女性; ⑥ 合并严重感染者; ⑦ 合并胸水者。
选择2019年7月—2021年2月昆明市第三人民医院诊断为肝硬化的患者共1 361例,根据入组标准,共筛查出满足条件的患者286例,其中男204例(71.33%), 女82例(28.67%); 年龄 21~74岁,平均(53.09±9.38)岁; 肝硬化病因包括乙型病毒性肝炎136例(47.55%), 酒精性肝硬化55例(19.23%), 自身免疫性肝炎29例(10.14%), 不明原因肝硬化24例(8.39%), 丙型病毒性肝炎21例(7.34%), 原发性胆汁性肝硬化11例(3.85%), 乙型病毒性肝炎合并酒精性肝病8例(2.80%), 肝豆状核变性2例(0.70%)。本研究通过医院伦理委员会审查(编号: 2019031964)。
1.2 方法
1.2.1 实验室检查: 患者行右心声学造影检查前3 d, 空腹采取肘静脉血,采用贝壳库曼尔特dxh600血常规检测仪及配套试剂盒,检测白细胞(WBC)、血红蛋白(Hb)、血小板(PLT); 采用迈瑞全自动生化分析仪BS-240检测白蛋白(ALB)、谷氨酸-丙酮酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、血肌酐(Scr)、血尿素氮(BUN)、凝血酶原时间(PT)和D-二聚体(D-D)等指标; 采用酶联免疫吸附试验检测内皮素-1(ET-1)、肿瘤坏死因子-α(TNF-α)水平。
1.2.2 右心声学造影检查: 采用美国GE公司LOGQ7型彩色多普勒超声诊断仪,探头频率为2.5 MHz。患者取半坐卧位,先行常规胸超声心动图检查,检查心脏大小、结构和功能。经肘正中静脉注射维生素B6注射液1 mL与5%碳酸氢钠注射液 5 mL的混合液,抽好备用,禁止震动,在注射造影剂的同时,嘱患者做Valsava动作并持续5 s以上,使胸腔压力增大到40 mmHg, 记录造影剂从注入至右心开始显影的时间,即为右心显影时间。每次造影存取动态图,造影结束后逐帧回放,每段资料均由2名有经验的超声医生共同分析,应用DICOM读图软件,分析时减慢播放速度,逐帧分析图像。观察右心显影后有无造影剂进入左心系统,挑选出左心房微泡最为密集的图像进行分析,对微泡量进行半定量分析,其中>100个微泡为大量, 50~100个微泡为中量, <50个微泡为少量。对应相关标准可将肺内分流分为大量分流(>100个微泡)、中量分流(50~100个微泡)、少量分流(<50个微泡)。
1.3 HPS诊断标准
HPS诊断依据2016年国际肝移植学会[5]发布的相关标准: ① 患者在静息状态下、呼吸室内空气时的氧分压[pa(O2)]<80 mmHg, 或呼吸室内空气时的肺泡-动脉氧梯度[p(A-a)(O2)]≥15 mmHg; 对于64岁以上的患者,p(A-a)(O2)>20 mmHg可直接诊断。② 右心声学造影或放射性肺灌注扫描提示肺血管扩张(脑分流率>6%)。③ 有门静脉高压(伴或不伴肝硬化)。符合上述①、②、③条件且排除其他心肺疾病所致的肺血管扩张者,即可诊断。本研究中所有患者通过静息状态下呼吸室内空气时氧分压、右心声学造影,并结合临床体征和实验室检查进行诊断。右心声学造影阳性诊断标准: 正常肺部毛细血管的平均直径为8~15 μm, 正常情况下微泡无法通过肺部毛细血管床, HPS时部分毛细血管扩张至15~500 μm。注射造影剂4~6个心动周期后有左心微泡显影,即判断为阳性。
1.4 HPS分级标准[9]
HPS的严重程度取决于pa(O2)水平。① 轻度: 呼吸室内空气时pa(O2)≥80 mmHg,p(A-a)(O2)≥15 mmHg; ② 中度: 呼吸室内空气时pa(O2)为60~<80 mmHg,p(A-a)(O2)≥15 mmHg; ③ 重度: 呼吸室内空气时pa(O2)为50~<60 mmHg,p(A-a)(O2)≥15 mmHg; ④ 极重度: 呼吸室内空气时pa(O2)<50 mmHg,p(A-a)(O2)≥15 mmHg, 或呼吸100%氧气时pa(O2)<300 mmHg。
1.5 观察指标
观察右心声学造影对HPS的诊断敏感度和不良反应,分析本组患者HPS的发生率以及HPS发生的危险因素。对HPS患者右心声学造影的微泡量进行半定量测定,分析微泡量半定量与HPS严重程度、肝功能、ET-1及TNF-α的相关性。
1.6 统计学分析

2 结 果
2.1 肝硬化伴与不伴HPS患者的临床资料比较
本组患者中,共36例右心声学造影结果呈阳性,临床诊断为HPS者32例。肝硬化伴HPS组、肝硬化不伴HPS组患者的Child-Pugh分级、Hb、D-D、ET-1、TNF-α比较,差异有统计学意义(P<0.05)。见表1。
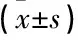
表1 肝硬化伴HPS组与肝硬化不伴HPS组患者临床资料比较
2.2 肝硬化伴HPS的危险因素的二元Logistics回归分析
将具有统计学意义及接近临界P值的指标纳入二元Logistics回归分析发现, Child-Pugh分级中C级、D-D、ET-1和TNF-α是发生HPS的危险因素(P<0.05或P<0.01), 即Child-Pugh分级为C级以及D-D、ET-1和TNF-α水平越高,发生HPS的可能性越大。见表2。纳入上述危险因素以构建模型行受试者工作特征(ROC)曲线分析,判断其预测发生HPS的价值,该模型ROC曲线的曲线下面积为0.995, 预测HPS的发生具有统计学意义(P<0.01)。见图1。

表2 肝硬化患者伴HPS的危险因素的二元Logistics回归分析

图1 根据二元Logistics回归分析结果构建分析模型的ROC曲线
2.3 右心声学造影微泡分级与临床资料的相关性
32例肝硬化伴HPS患者中,微泡量14~149个,中位微泡量58.06个,其中17例为少量微泡, 10例为中量微泡, 5例为大量微泡。经统计学分析发现,微泡量与HPS分级、血清ET-1具有显著相关性(P<0.01), 即微泡量越多,则HPS分级越重、血清ET-1水平越高。见表3。

表3 肝硬化伴HPS患者右心声学造影不同微泡分级与临床资料的关系
3 讨 论
HPS的发生机制尚不明确,其预防和治疗仍未取得实质性进展,目前其主要的防治手段仍为肝移植。研究[5, 10-11]显示,普通肝硬化患者肝移植术后中位生存期为87个月, 5年生存率为63%, 而肝移植后HPS可引起肝脏功能严重下降及肺部感染等并发症,导致患者中位生存时间降至24个月, 5年生存率仅为23%。既往对HPS危险因素的研究极少,考虑与确诊方法的缺乏有关。在相关仪器检查中,需要进行右心声学造影或放射性肺灌注检查。单光子发射计算机断层扫描肺灌注成像可以反映肺组织局部血流灌注情况,但属于有创检查且价格昂贵,具有一定的辐射,限制了临床的使用。
右心声学造影具有无创、价格低、安全性较好等优势,适应证更广。右心声学造影在注射含有气体的造影剂后,正常情况下,微泡从肘静脉注入并经上腔静脉进入右心,在右心腔内产生云雾状回声影,而后进入肺循环。CO2气泡的平均直径>50 μm, 此类微泡因直径较大难以通过肺毛细血管床(直径8~15 μm), 极易通过肺泡而呼出体外,故通常仅使右心系统显影,而不会使左心房及左心室显影,当肺血管扩张或有肺内动静脉分流时, CO2气泡通过扩张的肺毛细血管或直接经肺部的动静脉瘘进入左房,左心腔内可见造影剂的云雾状回声。当右心腔出现云雾状回声影后4~6个心动周期,左心腔也出现云雾状回声影,判定为阳性,提示肺内血管扩张或肺内动静脉分流,对诊断HPS具有重要的意义[12]。本研究286例患者行右心声学造影, 36例患者右心声学造影结果呈阳性,结合临床其他检查确诊HPS者32例。32例HPS患者中,右心声学造影显示中位微泡量58.06个,其中53.13%为少量微泡, 31.25%为中量微泡, 15.63%为大量微泡。本研究发现,右心声学造影微泡量与HPS分级和血清ET-1具有正相关性(P<0.01), 即微泡量越多, HPS分级越重,血清ET-1水平越高。HPS患者行右心声学造影时,由于肺血管扩张, CO2气泡通过扩张的肺毛细血管进入左房,而当HPS较严重时,肺内血管扩张加重,导致CO2气泡通过率增加,故微泡量增加。血清中升高的ET-1可以通过血管壁上的G蛋白偶联受体上调肺内的内皮型一氧化氮合酶(eNOS)和NO水平,从而扩张血管,降低肺泡动脉氧分压[13], 导致发生HPS, 故ET-1越高,血管扩张越明显,同样可以使CO2气泡通过率增加,微泡量增加。
与不伴有HPS的患者比较发现, HPS患者的Child-Pugh分级中C级较多, Hb较低,D-D、ET-1和TNF-α均较高,差异有统计学意义(P<0.05或P<0.01)。经二元Logistics回归分析发现, Child-Pugh分级为C级以及高D-D、ET-1和TNF-α水平是发生HPS的危险因素(P<0.05或P<0.01), 且其构建的模型ROC曲线的曲线下面积为0.995, 提示当肝硬化患者具有上述危险因素时,应高度警惕HPS的发生。既往关于D-D与HPS的相关研究较少, HPS在临床中主要表现为低氧血症,而低氧血症的病理基础是肺血管扩张。研究[14]显示,当肝硬化患者发生肝功能减退和肠黏膜屏障受损时,常合并肠源性内毒素血症,从而诱导产生多种包括ET-1和TNF-α在内的血管活性物质[15], 参与肺微血管内皮细胞的增殖和扩张[16], 因Child-Pugh C级为肝功能重度减退,故患者的内毒素分泌增多,增加HPS的发生。D-D是纤维蛋白单体经纤溶酶水解后的产物,对反映机体高凝状态具有特异性[17]。本研究提示, HPS患者血管异常增生时机体处于异常高凝状态,故D-D水平升高。ET-1由血管内皮分泌,在肺内含量高,黎尚荣等[18]研究表明ET-1参与HPS的形成,也间接证实ET-1的升高是HPS的危险因素。研究[19-20]发现, TNF-α可诱导扩血管物质一氧化氮(NO)的产生,引起低氧血症及HPS的发生,间接证实了本研究结果。
综上所述, Child-Pugh C级以及高D-D、ET-1和TNF-α水平是肝硬化患者发生HPS的危险因素,右心声学造影诊断HPS具有较高敏感性。右心声学造影半定量测定可以对HPS的严重程度进行预测,具有较高的诊断价值。
