套扎法内镜下黏膜切除术在直肠神经内分泌肿瘤中的应用
2022-10-19柴海娜吴莹莹陈超伍
陈 功, 孙 超 , 柴海娜, 吴莹莹, 王 璐, 陈超伍, 汤 东, 刘 军
(江苏省苏北人民医院, 1.消化内镜中心, 2.胃肠外科, 江苏 扬州, 225000)
直肠神经内分泌肿瘤(NENs)非常少见,在结肠镜检查中的发现率仅为0.17%[1], 但在所有胃肠道NENs中占比为20%左右[2], 仅次于小肠NENs。流行病学研究[3]表明,直肠NENs的发病率显著升高,可能与内镜检查技术的提升和内镜筛查的普及有关。直肠NENs存在各种临床表现,包括良性、无症状、播散和转移等。一般情况下,直肠NENs稍隆起于黏膜表面,表面光滑,类似于增生性息肉,常见于直肠中段的前壁或侧壁,距肛门4~8 cm[4], 可在结肠镜检查时偶然发现。根据目前欧洲神经内分泌肿瘤学会(ENETS)指南,小于10 mm且分化良好的肿瘤浸润淋巴血管和肌层的风险较低,恶性可能极低,适合内镜下的微创治疗[5]。对于肿瘤直径>10 mm患者,外科手术切除效果可能更好; 对于直径>20 mm或有证据表明肿瘤超过黏膜下层的患者,首选外科手术治疗[6]。
针对直肠NENs的内镜下治疗的报道较少,传统的内镜下黏膜切除术(EMR)一直是较小直径直肠NENs的治疗首选。然而,使用EMR实现组织学的完整切除并不容易,因为大多数直肠NENs并不局限于黏膜层,而是达到了黏膜下层[7-8]。研究[9-10]认为,内镜下黏膜剥离术(ESD)对浅表胃肠道肿瘤的治疗更有价值,因为其比传统EMR的整体切除率更高,能够提供完整且准确的病理诊断,并且较外科手术创伤更小。近年来, ESD被广泛应用于直肠NENs的治疗,且效果良好。对于较大的病变, ESD可以对黏膜下病变进行剥离,在病变完整切除率方面仍有优势。国外研究[11]指出,对于直径<10 mm的直肠NENs, 套扎法EMR(EMR-b)的完整切除率与ESD相当。与传统EMR相比, EMR-b可以切除更深层的黏膜下层。本研究回顾性分析采用ESD和EMR-b治疗的直肠NENs患者资料,对比组织学完整切除率、并发症和操作时间,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年9月—2022年5月在苏北人民医院接受ESD或EMR-b治疗的56例直肠NENs患者的资料。根据接受治疗的不同,将患者分为EMR-b组26例和ESD组30例。EMR-b组男12例,女14例,平均年龄(49.04±11.71)岁,肿瘤平均直径(7.12±2.76)mm; ESD组男18例,女12例,平均年龄(52.80±10.85)岁,肿瘤平均直径(7.12±2.76)mm。2 组患者一般资料比较,差异无统计学意义(P>0.05), 具有可比性。本研究已通过江苏省苏北人民医院伦理委员会批准。纳入经普通肠镜及内镜超声检查(EUS)诊断为NENs者,确定病变层次、大小,同时年龄18~70岁者。排除标准: ① 症状严重,不能耐受手术者; ② 影像学检查提示有局部转移者; ③ 病变直径超过10 mm者; ④ 合并其他严重并发症者; ⑤ 合并严重基础病或系统性疾病者; ⑥ 正在使用阿司匹林等抗凝药者; ⑦ 精神病患者及妊娠期、哺乳期妇女; ⑧ 淋巴结转移或远处转移者。内镜手术均由具有10年以上内窥镜操作经验的医师负责。
1.2 器械
本研究主要使用Olympus GIF-H260、Olympus GIF-H290、GIF-H290主机, Olympus EndoEcho EUM 2000小探头超声机, INO2-22423230内镜注射针, MTN-PFS-E-24/23圈套器, ERBE VIO300D高频电切发生器, HXROCC-D-26-195-C金属钛夹。
1.3 操作方法
EMR-b操作方法: 内镜插入直肠后仔细观察肿瘤,通过注射针将溶液(0.9%生理盐水混合靛胭脂)注射于黏膜下层,抬举病变部位。插入带有套扎装置的内镜,将病变部位吸入结扎器,随后展开橡皮筋,结扎病变底部,使用ERBE VIO300D高频电切发生器通电进行切除(见图1)。
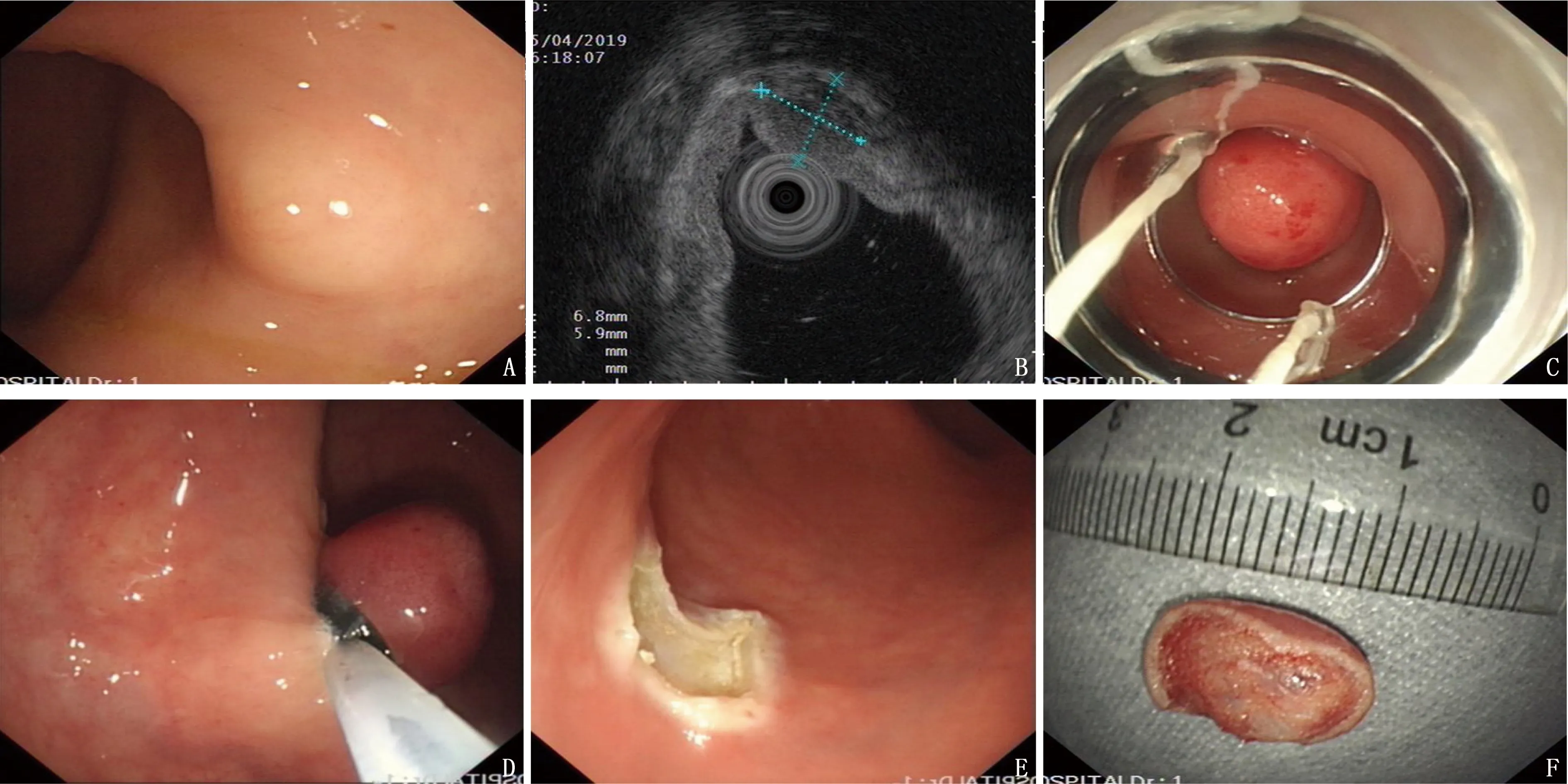
A: 直肠NENs内镜下表现; B: 超声内镜提示病变起源于黏膜下层; C: 黏膜下注射后用橡皮筋结扎病变;D: 在橡皮筋下方切圈套下切除; E: 术后创面; F: 切除后标本。
ESD操作方法: 内镜前端加装透明帽,插入直肠后,寻找并仔细观察病变部位,如上所述黏膜下注射后标记病变范围,用Dual-knife切割病变部位,距离病灶2~3 mm避免累及切缘。所有操作均使用ERBE VIO300D高频电切发生器通电切除。之后处理创面以预防术后出血(见图2)。
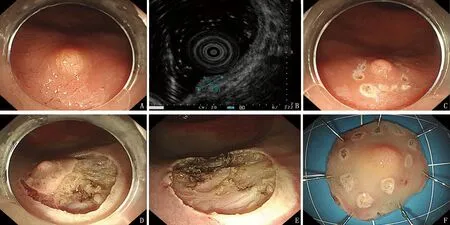
A: 直肠NENs内镜下表现; B: 超声内镜提示病变起源于黏膜下层; C: 标记病变范围;D: 内镜下剥离病变; E: 剥离后的创面; F: 剥离后标本固定。
1.4 标本观察
由经验丰富的病理医生以2 mm为间隔的切片方式对标本进行仔细的组织病理学检查。对标本进行苏木精-伊红(HE)染色及免疫组织化学检查,判断其病理组织学类型、累及深度、水平及垂直切缘和淋巴血管是否受累。整块切除定义为切除的病变为完整的一块。完整切除的定义: ① 整块切除; ② 根据世界卫生组织分型,肿瘤为分化良好的内分泌肿瘤[12]; ③ 无水平、垂直切缘和淋巴血管累及[13]。迟发性出血定义为在患者接受ESD或EMR-b治疗后1个月内出现便血症状,需要内镜下止血或输血。穿孔定义为直肠壁破损,可在内镜手术过程中观察到或在术后通过影像学检查(如腹部CT)发现。为评估切除部位的局部复发情况,对所有患者进行定期内镜复查。第1次复查时间为术后6个月内。此后,每年复查1次肠镜。
1.5 统计学分析

2 结 果
患者平均年龄(51.05±11.31)岁。所有患者均无症状,无类癌综合征的临床表现,所有肿瘤均整块切除。根据组织病理学结果,所有肿瘤均诊断为NENs(G1), 均局限于黏膜层或黏膜下层,无淋巴血管侵犯。未完全切除的患者拒绝接受进一步手术的建议,但接受定期随访复查。复查时未观察到局部复发或远处转移。本研究未出现穿孔手术相关并发症。然而ESD组中出现1例迟发性出血,应用钛夹止血成功,未进行输血或外科手术干预。2组住院时间和手术费用比较,差异均有统计学意义(P<0.05), 见表1。EMR-b与ESD的完整切除率分别为92.31%、93.33%, 差异无统计学意义(P=1.000), EMR-b组手术时间短于ESD组,差异有统计学意义(P<0.05)。见表2。

表1 2组患者基本情况及肿瘤基本特征

表2 2组内镜治疗效果比较
3 讨 论
随着消化内镜筛查项目逐渐开展,大多数胃肠道NENs在早期即被发现。直肠NENs大多直径较小, 66%的直肠NENs直径在10 mm以下[14]。直肠NENs转移的危险因素主要包括直径超过10 mm, 有固有肌层侵犯,病理提示低分化以及淋巴血管累及。虽然直径较小的NENs的转移风险低,但仍有一些患者出现转移,即使肿瘤直径小于10 mm[15]。不过,内镜下直径<10 mm的直肠NENs,如果没有异常的特征,且局限于黏膜下层,无淋巴血管累及的话,是很少发生转移的,非常适合于内镜下局部切除[4]。因为完整切除的标本包含大量的黏膜下层组织,可准确显示有无淋巴血管累及,从而判断是否需要追加外科手术。对于非完整切除的肿瘤而言,再次内镜下切除残余肿瘤组织比较困难,因为创面纤维化容易导致黏膜下注射后抬举不佳。因此,完整切除在直肠NENs的治疗中非常重要。
传统EMR治疗NENs的步骤比较简单,然而其组织学完整切除率较低(14%~62%)[16], 有时还需要追加外科手术。为了克服传统EMR的不足, EMR-b被认为是一种治疗直肠NENs的有效方法[17]。内镜前端加帽后,肿瘤内镜下视野清晰,内镜吸引使肿瘤组织充分抬举。这种办法可以得到完全无损伤的类圆形组织标本。相比于传统EMR, EMR-b的切缘更深。
本研究中, EMR-b与ESD在组织完整切除率方面相差不大, EMR-b和ESD治疗较小的NENs效果相当。ESD切缘阳性可能与内镜剥离后期使用圈套切除而非全程剥离有关。所有非完整切除的患者都是内镜下整块切除,但水平或垂直切缘累及与否难以确定,可能与术中划开黏膜层或剥离黏膜下层时的电切电凝有关。因为对切缘进行了电凝,干扰了切缘病理的检验。本研究中所有肿瘤均无异常的临床病理特征,所有非完整切除的患者均进行了仔细的随访,最近1次门诊随访未发现复发或转移。
近年来, ESD技术逐渐成为首选的治疗方法。虽然在整块切除和组织完整切除率方面ESD优于传统EMR,但其在治疗直肠NENs时未被广泛采用。ESD技术仍有相当高的穿孔风险。尽管大部分复杂病例均可以通过内镜操作完成,但报道的结直肠穿孔率远高于胃部患者。因此, ESD治疗结直肠肿瘤的安全性仍未被广泛认可。特别是当内镜医师处于结直肠ESD的学习阶段时,并发症的发生率相当高[9-10]。本研究中未见穿孔病例,但1例出现术后迟发性出血,通过内镜下钛夹夹闭成功止血。相比于传统EMR, ESD的手术时间普遍更长,因此需要更长时间的学习与训练。
因套扎装置本身的限制,直肠NENs内镜套扎治疗一般适用于直径小于10 mm的肿瘤, EMR-b对于直径小于10 mm的肿瘤也是有效的。本研究证实, EMR-b组与ESD组的组织完整切除率差异无统计学意义(P>0.05)。ESD需要高水平的专业知识和经验,并且操作时间和住院时间更长,费用更高,而EMR-b技术简单,花费少,创伤小,时间短,安全性高。尽管ESD技术发展迅速,并被广泛接受,已经成为非常普遍的治疗手段,但相关人员在ESD相关专业知识和经验方面存在差异,因此大多数采用EMR-b对直肠NENs患者进行治疗。在选择治疗方法时,也应该考虑手术费用、操作时间、专业知识以及操作经验等因素对患者的影响。
本研究有以下3个方面的局限性。首先,本研究非随机前瞻性对照研究,手术方式选择受内镜医师偏好的影响;其次,手术由多名内镜医师操作,其专业知识虽存在差异,但其经验丰富,均有1 500例以上结直肠EMR手术操作经验,因此,手术医师的内镜技能差异可以忽略不计;最后,本研究为单中心研究,选择的患者例数较少。直肠NENs, 特别是具有息肉样形态、局限于黏膜下层的肿瘤采用内镜下切除即可, EMR-b对于直径<10 mm、EUS或CT显示无淋巴结转移且病理结果显示不超过黏膜下层的肿瘤可能是更好的选择。
