飞行时间质谱技术在中国人常见耳聋基因检测中的应用
2022-10-19金孝华黄莎莎庞珊珊戴朴高华方马旭
金孝华,黄莎莎,庞珊珊,戴朴,高华方,马旭*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100005;3.中国人民解放军总医院耳鼻咽喉头颈外科医学部,北京 100853)
耳聋是最常见的出生缺陷性疾病之一,同时也是人类最常见的感觉功能障碍之一。研究发现,新生儿双侧听力障碍(≥40 dB)发病率超过0.1%,随着迟发性听力障碍增加,到青春期发病率则高达0.35%[1]。《中国出生缺陷防治报告(2012)》明确指出,2008至2010年我国先天听力障碍发生率分别为19.9/万、21.5/万和21.9/万,呈逐年上升趋势[2]。目前研究表明,约60%的耳聋与遗传因素有关,遗传性耳聋约70%为非综合征型,其余为综合征型,遗传性耳聋具有高度的遗传异质性和广泛的种族差异[3]。根据中国聋病分子流行病学数据,我国耳聋人群的主要致病基因是GJB2[4]、SLC26A4[5-6]和线粒体基因12SrRNA[7]。目前,新生儿听力与耳聋易感基因联合筛查作为有效的遗传性耳聋三级预防手段,已在全国多个省市开展并且取得成效,其中4个耳聋基因9个位点及4个耳聋基因20个位点的筛查方案应用较广[8-9]。为了进一步提高聋病易感基因突变筛查的效率及基因诊断确诊率,本研究利用飞行时间质谱技术(MALDI-TOF MS)建立了单一反应检测3个常见耳聋基因(GJB2、SLC26A4和线粒体12SrRNA)30个热点突变位点的方法,并使用临床样本对该方法的准确性和有效性进行了验证。
资料与方法
一、研究对象
选取2016年8月至2017年2月于中国人民解放军总医院就诊的700例(327例已知突变位点,373例未进行基因检测)非综合征耳聋患者为研究对象。
327例已知突变位点的非综合征型耳聋患者DNA样本的纳入标准:样本已经过常见耳聋基因GJB2、SLC26A4和12SrRNA检测,至少携带一个本研究待检测的突变位点。排除标准:样本DNA浓度低于10 ng/μl,或者260/280<1.7或260/280>1.9,即样本DNA质量不能满足飞行时间质谱检测试剂要求。
373例未进行基因检测的非综合征型耳聋患者全血样本的纳入标准:经体格检查、专科检查及听力学检查临床诊断为非综合征型耳聋的患者。排除标准:急性或慢性中耳炎、外中耳畸形、听神经瘤、晚期梅尼埃病、耳毒性药物、脑膜脑炎、新生儿高胆红素血症、母亲孕期宫内感染、外伤等有明确致聋原因的患者。
所有研究对象均签署知情同意书,研究经解放军总医院医院伦理委员会批准。
二、研究方法
1.DNA提取:采用血液/细胞/组织基因组DNA提取试剂盒(天根生物)提取非综合征型耳聋患者全血基因组DNA,提取方法严格按照试剂盒说明书进行。利用核酸定量仪(Nano Drop 2000,Thermo Fisher,美国)进行基因组DNA定量和纯度测定。
2.飞行时间质谱(MALDI-TOF MS)检测耳聋致病基因突变方法的建立:根据我国聋病分子流行病学数据,选择中国人群常见耳聋基因GJB2、SLC26A4、线粒体12SrRNA共30个热点突变位点(表1),建立单一反应MALDI-TOF MS检测耳聋致病基因热点突变的方法。具体步骤如下:(1)多重PCR扩增:利用Assay Design 4.0软件(Agena Bioscience,美国)进行多重PCR引物和单碱基延伸引物设计,多重PCR反应体系为5 μl,包括10×PCR Buffer 0.5 μl、25 mmol/L MgCl20.4 μl、25 mmol/L dNTP Mix 0.1 μl、0.5 μmol/L引物1 μl、5 U/μl PCR酶0.2 μl、ddH2O 1.8 μl。PCR扩增程序为:95℃预热2 min;95℃ 30 s、56℃ 30 s、72℃ 1 min,45个循环;72℃ 7 min;4℃保持。(2)虾碱性磷酸酶(SAP)处理:向5 μl PCR扩增产物中加入2 μl SAP混合液,包括1.7 U/μl SAP 0.3 μl、SAP buffer 0.17 μl、ddH2O 1.53 μl。反应条件为:37℃ 40 min;85℃ 5 min;4℃保持。去除未结合的dNTP。(3)单碱基延伸反应:向SAP处理后的PCR产物中加入配制好的单碱基延伸反应混合液2 μl,包括Buffer 0.2 μl、ddNTP Mix 0.2 μl、单碱基延伸引物0.94 μl、iPLEX单碱基延伸酶0.041 μl、ddH2O 0.619 μl。延伸条件为:94℃ 30 s;94℃ 5 s,(52℃ 5 s、80℃ 5 s,5个循环),40个循环;72℃ 3 min;4℃保持。(4)MALDI-TOF MS检测:将单碱基延伸产物进行脱盐、树脂纯化后,利用MassARRAY RS1000/Fusio 点样仪(Agena Bioscience,美国)转移到芯片上,采用MassARRAY质谱阵列基因分析系统(Agena Bioscience,美国)进行检测,使用Typer 4.0软件(Agena Bioscience,美国)进行数据分析。每个突变位点由于单碱基延伸产物分子量不同,形成不同的检测峰而被区分(图1)。

表1 耳聋基因GJB2、SLC26A4和线粒体12S rRNA的30个热点突变位点
3.Sanger测序验证:在耳聋致病基因突变位点周围设计上下游扩增引物,PCR反应后获得目标区域产物,采用BigDye 3.1(ABI,美国)测序试剂盒进行测序反应,产物经乙醇沉淀法纯化后在ABI 3730×l测序仪(ABI,美国)上进行序列分析。
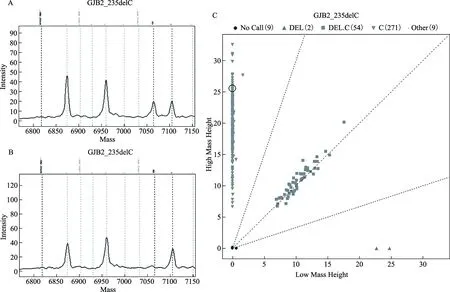
A:GJB2基因c.235delC杂合突变型峰图;B:GJB2基因c.235delC野生型峰图;C:质谱聚类图图1 MALDI-TOF MS检测耳聋基因GJB2的检测结果示例图
结 果
一、建立检测常耳聋致病基因热点突变的单一反应MALDI-TOF MS方法
采用单一反应MALDI-TOF MS对327例已知突变的非综合征型耳聋样本(所携带的突变涵盖了本研究要检测的GJB2、SLC26A4、线粒体12SrRNA基因30个位点,每个位点至少有8个以上阳性突变)进行检测发现,GJB2、SLC26A4、线粒体12SrRNA基因共30个突变位点在327例已知突变样本中均检出,其检测结果与临床基因诊断结果一致,符合率为100%,说明单一反应MALDI-TOF MS检测常见耳聋治病基因(GJB2、SLC26A4和线粒体12SrRNA)的方法已成功建立。
二、利用新建立的单一反应MALDI-TOF MS检测未知突变非综合征型耳聋患者样本的质谱结果
利用新建立的单一反应MALDI-TOF MS检测373例未知突变位点的非综合征型耳聋患者样本发现,56.30%(210/373)患者至少携带1个突变,其中基因诊断确诊携带复合或纯合突变的患者为155例,占受检人群的41.55%(155/373),只检测到1个突变的患者55例,占受检人群的14.75%(55/373),未检测到突变的患者163例,占受检人群的43.70%(163/373)。210例阳性突变携带者共涉及55种基因型,其中有5例存在多个基因突变,GJB2基因突变阳性患者93例,占受检人群的24.93%(93/373),SLC26A4基因突变阳性患者118例,占受检人群的31.64%(118/373),12SrRNA基因m.1555A>G突变占受检人群的1.07%(4/373)(表2)。
三、Sanger测序验证
根据373例未知突变位点的非综合征型耳聋患者样本的MALDI-TOF MS结果,针对每个检出的突变位点分别选择部分阳性结果样本总计56例进行Sanger一代测序验证,Sanger一代测序结果与新建立的MALDI-TOF MS检测结果一致,符合率为100%。

表2 MALDI-TOF MS检测应用于373例非综合征型耳聋患者耳聋基因突变检测结果
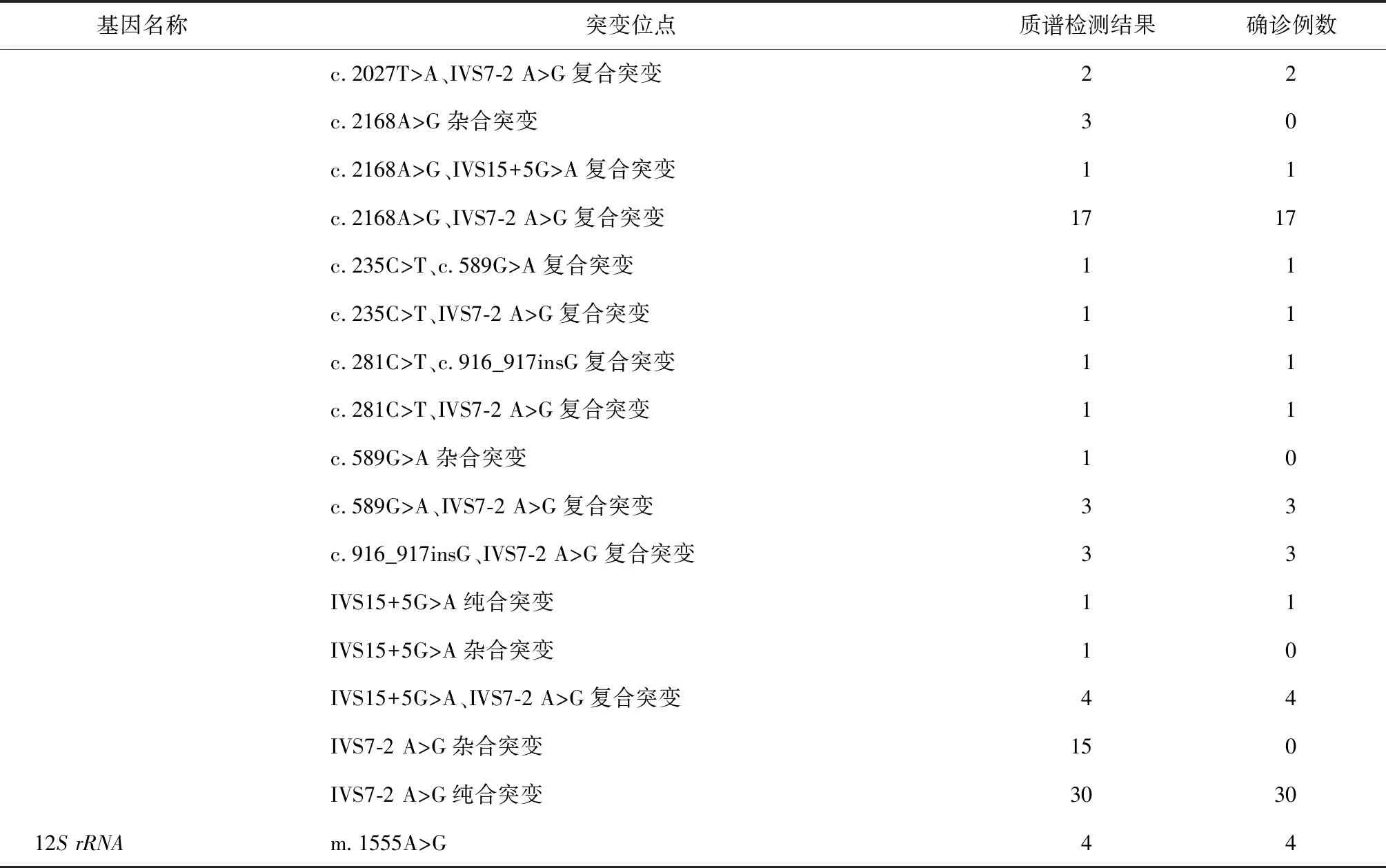
续表
讨 论
耳聋是临床上导致言语交流障碍的常见致残性疾病。中国人群GJB2基因突变的携带率为3.16%,SLC26A4基因突变的携带率为2.75%,线粒体12rRNA突变的携带率为2.87‰,GJB2、SLC26A4和线粒体12SrRNA是导致我国耳聋高发的遗传学基础。现有的耳聋基础研究和临床实践证明,耳聋基因检测对于耳聋的预防、治疗具有重要作用[10]。
目前,耳聋基因检测已经广泛应用于临床耳聋基因诊断和新生儿耳聋基因筛查,所采用的检测技术包括基因芯片[11]、多色探针熔解曲线分析技术[12]、SNPscan技术[13]、MALDI-TOF MS[14-15]、新一代测序[16]等。其中MALDI-TOF MS为非杂交依赖性,不需要各种标记物,直接以分子量为标记,实现基因分型检测和DNA突变检测[17]。MALDI-TOF MS与其他针对已知突变的基因检测技术相比具有以下技术优势[18]:(1)通量高。MALDI-TOF MS检测1张384个样品的芯片需要时间约1 h,一台仪器每天可以检测2 000个以上样品,更适合大规模人群耳聋基因筛查工作开展;(2)准确率高。MALDI-TOF MS技术原理上相当于微测序反应,而且不需要任何标记物,直接通过分子量大小进行基因分型,结果准确;(3)成本低。不需要荧光标记,相对于SNPscan、芯片法等检测方法其检测成本低;(4)突变检测位点多,覆盖率高。本研究建立的方法可以单一反应检测3个耳聋基因30个突变位点,与其它突变检测技术如多色探针熔解曲线分析技术、Sanger测序等一个反应只能检测一个或几个突变位点相比,极大地提高了耳聋基因突变检出率。目前MALDI-TOF MS除了应用于耳聋基因检测外,也有研究者将其用于囊性纤维化[19]、苯丙酮尿症[20]等遗传病热点突变检测。在国内已有研究者利用MALDI-TOF MS开展中国人耳聋基因热点突变检测,如Yao 等[14]采用MALDI-TOF MS单一反应检测GJB2和SLC26A4基因14个突变位点。曾云 等[15]同样利用该技术单一反应检测4个耳聋基因20个位点。本研究所建立的MALDI-TOF MS方法将检测的耳聋基因突变位点增加到30个,对373例未基因诊断的非综合征型耳聋患者进行检测,在受检者中发现了56.30%(210/373)的阳性携带者,其中携带复合杂合或纯合突变可以明确基因诊断的患者占受检人群的41.55%(155/373)。与Yao等[14]和曾云 等[15]的方法相比,本研究的方法有效提高了耳聋基因突变检出率和临床确诊率,特别是改善了前庭导水管扩大(EVAS)主要致病基因SLC26A4的临床确诊率。SLC26A4 基因较大,共有21个外显子,编码区有20个外显子,如果在只检出一个突变情况下,对其确诊最多需要做18个直接测序反应,成本和工作量都很大。有研究认为,如果将SLC26A4基因检测突变位点增加到15个,EVAS患者的SLC26A4 基因突变的阳性检出率能够达到89.8%,临床确诊率可以达到60.41%,基本可满足临床需求[21]。本研究建立的MALDI-TOF MS方法包含了SLC26A4基因19个热点突变,能很好满足临床需求。
本研究建立了基于MALDI-TOF MS的高通量耳聋基因检测方法,可以单一反应检测耳聋基因GJB2、SLC26A4和线粒体12rRNA的30个热点突变,通过大量临床样本证明了该方法的准确性和有效性,该方法改善了聋病易感基因突变筛查的效率及基因诊断确诊率,可广泛应用于临床耳聋基因诊断和新生儿耳聋基因筛查,为耳聋预防工作提供重要的技术支持。
