自动化DNA 组装仪器研制
2022-10-19王升启
陈 红,荣 振,王升启
(军事科学院军事医学研究院微生物流行病研究所,北京 100850)
DNA 组装方法是整个合成生物学的基础,合成生物学依赖于将组装的特定DNA 片段导入细胞内发挥功能来实现目的,DNA 组装技术是实现合成生物学各种目的的关键技术,但设计并合成基因组的能力还远远落后于已掌握的合理设计生物元件的能力。随着合成生物学的发展,研究者开发了依赖于DNA 聚合酶或DNA 连接酶的不同DNA 组装技术;为了降低组装成本和便于实现DNA 组装的自动化,也发展了一些非酶依赖的DNA 组装技术;而几百KB 到MB 的大片段DNA 的组装则多数依赖于微生物体内重组[1]。
2002 年,合成的脊髓灰质炎病毒cDNA 被RNA聚合酶转录成病毒RNA,在无细胞提取物中翻译和复制,从而产生传染性脊髓灰质炎病毒的从头合成[2],表明仅通过序列,就可以通过体外化学合成感染因子。2008 年Venter 研究组利用TAR(Transformation Associated Recombination)方法在酿酒酵母体内完成了生殖道支原体基因组的最后一步组装[3]。2009 年,Gibson 开发了DNA 多片段体外一步拼接的方法,将核酸外切酶、聚合酶和连接酶加入反应体系,50 ℃孵育60 min即可完成组装[4]。2010 年,Venter 团队和Smith 团队合成了长达1.08 MB 的蕈状支原体基因组,成功转入到山羊支原体宿主细胞内,是人工合成基因创造新细胞的历史性一步[5]。2017 年,纽约大学Boeke 教授团队在“人工合成酵母基因组计划(Sc2.0)”中,用同源重组的方法,成功组装了大片段的DNA 且同时置换了野生型染色体[6]。同年,我国天津大学[7-8]、清华大学[9]、深圳华大基因研究院[10]完成了4 条酿酒酵母染色体的全合成,且合成的染色体经过人工设计,删除了无用序列,比天然染色体的基因序列更短。
国内也发展了多种DNA 组装新技术。赵国屏院士团队开发出位点特异性重组串联SSRTA、核酸内切酶连接、MASTER 连接及iBrick 等组装方法[11-12];覃重军研究员团队发展出CasHRA 技术[13],实现胞内多个100 KB 以上DNA 片段组装;戴俊彪研究员团队建立了可用于代谢工程优化和蛋白表达的YeastFab 和EcoExpress DNA 组装技术[14-15];赵惠民教授团队提出一种高效准确的多片段DNA 组装方法双引物组装(Twinprimer non-enzymatic DNA assembly,TPA)[16],这是一种在不使用酶的情况下将PCR 反应扩增的片段组装成质粒的方法。TPA 克隆无疤痕且与序列无关,即使不使用酶,TPA 的性能也与目前可用的一些最好的体外组装方法相当。
虽然DNA 组装的方法技术已经很成熟,但完成DNA 组装相关的实验成本太高、耗费的时间太长、占用的人力太多。本文研制了一种DNA 组装仪器,可以自动化、快速地满足DNA 组装实验中的移液要求及温度控制条件。
1 DNA 组装仪设计
针对现有的DNA 组装中常见的通量低、速度慢及自动化程度低等问题,本文从工程学角度出发,合理设计DNA 组装仪的结构,搭建原理样机并完成相应控制系统的开发。
自动化DNA 组装仪是一个综合自动移液、运动控制与循环控制温度于一体的多模块、集成化仪器,对运动的准确定位、精确移液及温度控制要求较高。如图1所示,自动化DNA 组装仪主要由大底板、移液运动模块及温度控制模块3 大结构部分组成。大底板是整个DNA 组装仪的基础,分为底板结构设计和反应试剂装载区设计,大底板是整个仪器的支撑,移液运动、温度控制等工作均在底板上进行,底板上放置有枪头盒、试剂盒、废液池和温度控制模块。移液运动模块包含二维运动平台和移液器组件2 部分。温控模块由温度循环模块及热盖结构组成。
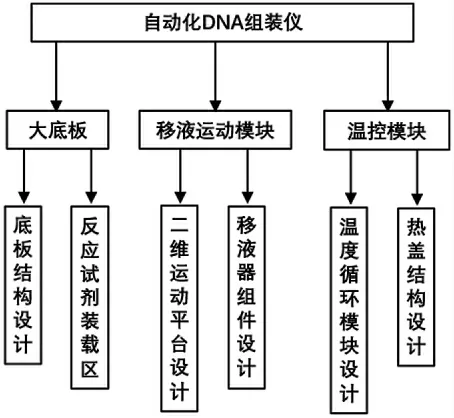
图1 整机设计架构图
2 结果与分析
2.1 机械结构
DNA 组装仪的机械结构组成如图2 所示。其中,龙门架、大底板、试剂装载区构成仪器的主题框架;移液器组件、步进电机和直线导轨组成仪器的主要移液运动模块;热盖、温度循环模块构成仪器的核心反应温控模块。
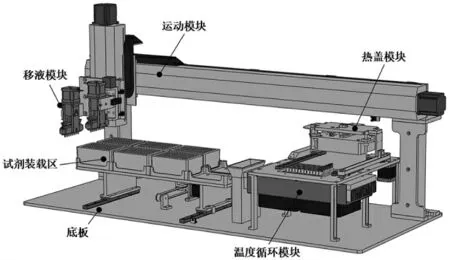
图2 DNA 组装仪硬件系统设计图
仪器整体的运动主要体现在移液器模块带动反应体系在水平和垂直方向上频繁往复移动,所以分别选用X、Z 方向上的步进电机,并根据受力和行程合理设计导轨的载荷和长度,X 轴的行程是107 cm,速度是72.5 mm/s,Z 轴的行程是27 cm,速度是72.5 mm/s。为了提高仪器移液的精度及移液的效率,本文设计了一种八连排移液器组件,通过安装块搭载在Z 轴机械臂上,在Z 轴和X 轴的步进电机带动下,准确到达指定的位置。如图3 所示,移液器组件主要由微量泵、42 直线电机、机械臂安装板、导向装置、8 个单独的移液器通道及限位开关组成。为了保证吸排液体时的密封性,将移液器与枪头适配处设计成楔形的结构,与枪头可以紧密贴合在一起。
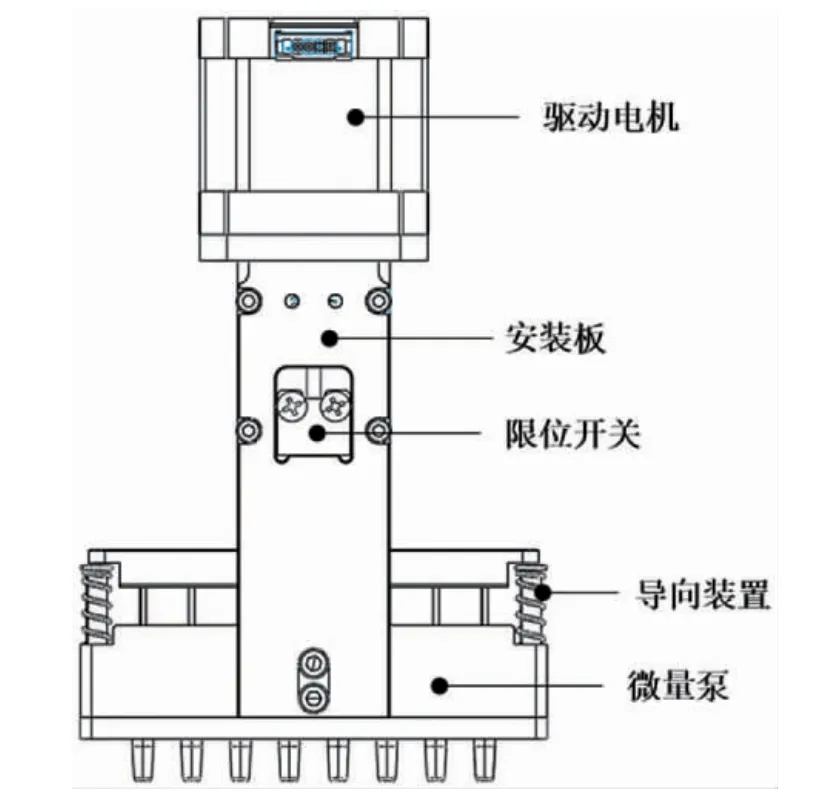
图3 八连排移液器组件结构图
温控模块的设计尺寸为足够放入一块96 孔的反应小管,并设计热盖进行自动化的开闭。热盖结构如图4 所示,热盖内单独设计加热片,防止反应体系蒸发后在管壁或顶部凝结,且需要与温度循环模块保持紧密接触。热盖设计有可防蒸发的高温模块和可以自动进行热盖开关的机械运动模块。
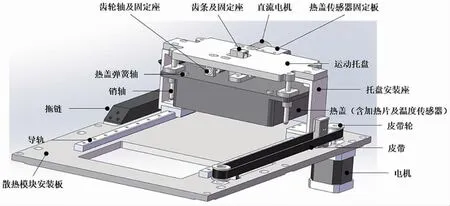
图4 热盖结构设计图
温度循环模块为PCR 扩增提供准确的温度,结构如图5 所示,由半导体加热制冷片、温度传感器、试管槽、散热片、散热挡片及风扇等组成。电压是15 V,功率为900 W。

图5 温度循环模块结构设计图
2.2 控制系统
DNA 组装仪控制系统由运动控制系统和温度控制系统构成,其系统框图如图6 所示。控制电路主要由主控芯片STM32F103 和温控芯片STC15W4KS4 构成双中央处理结构,其中主控芯片主要负责电机脉冲信号输出、AD 信号转换、触摸屏交互、上位机通讯、RCC时钟控制等,温控芯片主要作用是接收主控信号、控制加热片、接收温度采集信号等。电源转换芯片则将直流电压进行转换,分别输出3.3 V 和24 V 到控制芯片和步进电机驱动器。

图6 控制系统框图
在对2 个电机的控制过程中,需要保持反应体系稳定性的情况下,尽可能提升电机位移速度,减少计时器的中间等待时长,快速将反应体系加入反应孔中。温度控制除了要在温度循环器和热盖上设置多个热敏电阻检测温度,还需要优化闭环控温方案、采用PID 算法对控温参数进行整定,实现对反应孔和热盖温度的快速、精准、稳定控制。
2.3 性能验证
对自动化DNA 组装仪进行一次完整的PCR 扩增验证仪器的温控性能。PCR 扩增的实验流程如下:95 ℃3 min,95 ℃10 s,65 ℃5 s,72 ℃1.5 min,变性、退火及延伸这3 个温度循环25 次,最后72 ℃延伸5 min,总计用时65 min,商业化的PCR 仪器(伯乐的T100 Thermal Cycler)做相同的实验循环用时85 min,明显优于商业化的热循环仪。温度结果如图7 所示,温控性能好,能快速达到PCR 扩增需要的温度。
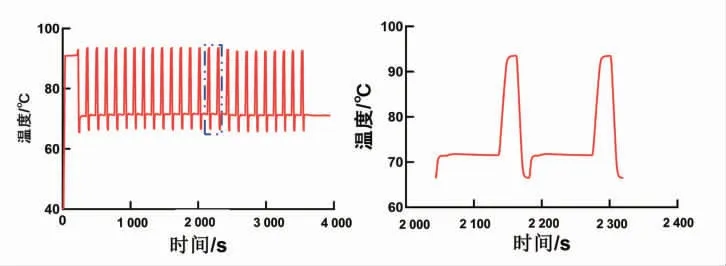
图7 DNA 组装仪温度测量图
对DNA 组装仪的八连排移液器组件进行测试,每次吸取相同体积的去离子水,独立重复3 次,记录每次移取液体的体积,结果见表1,8 个移液通道对应的变异系数范围是1.23%~7.55%,移液性能好。

表1 移液性能测试
3 讨论
本文对自动化DNA 组装仪器的设计进行了研究,从仪器的机械结构、各个模块的布局、硬件电路的设计到温度的控制算法及上位机控制程序的编写都进行了详细介绍。机械部件的选型上,选用57HB115L4 两相步进电机作为X 轴和Z 轴机械臂的驱动单元,采用MF65 薄膜型热敏电阻作为温度传感器,温度循环模块采用半导体加热制冷片,导热材料采用铝合金6063,风扇和散热片作为散热模块。在电路模块上,选用TMCM-6110 6 轴步进电机驱动器对运动模块的电机进行控制,设计了主控制器、温度的采集和控制电路、通讯模块电路。温度控制采用简单易实现的PID 算法,用C 语言编写了单片机程序,用Python 语言编写了上位机控制程序。进行了组装实验中一次完整的PCR 扩增,记录了PCR 扩增的温度变化并绘制成温度曲线,验证了温控系统的性能。对移液器组件的移液性能进行了验证,变异系数均小于10%,表明移液器组件的移液性能良好。以上结果表明,本文所建立的自动化DNA组装仪器可以满足DNA 组装实验需要的移液条件及温度循环条件的要求,但是温度的检测量和实际值之间存在小误差,后续需要进一步优化硬件电路设计。
