孤立性小脑后下动脉夹层1例报告并文献回顾
2022-10-19李文玲
马 红, 张 燕, 李文玲, 成 江, 马 薇, 冯 豆
小脑后下动脉(posterior inferior cerebellar artery,PICA)是椎动脉的重要分支,其近端发出供应延髓的穿支血管,远端发出供应小脑半球的分支血管,PICA闭塞可以造成延髓及小脑半球的缺血或梗死,甚至导致患者死亡[1]。PICA区梗死的病因机制主要包括椎动脉粥样硬化性闭塞病变、心源性栓塞和PICA原位分支动脉病变[2,3]。孤立性小脑后下动脉夹层(isolated Posterior inferior cerebellar artery dissection,iPICA-D)也有报道[4]。此前iPICA-D在很多研究中被认为是一种罕见的现象,然而,近年来有研究表明,6.0%的PICA区梗死[5]和5.4%的后循环缺血性卒中可归因于iPICA-D[6],提示iPICA-D是PICA区梗死更常见的原因。PICA管腔较细小且走行迂曲,其本身发生病变时,DSA及CTA对管腔内血流及管径变化较敏感,而无法直接显示动脉壁的结构,对血管壁本身病变的性质问题敏感性较差。常规磁共振成像(Magnetic resonance imaging,MRI),由于其空间分辨率及成像技术限制,很难发现细微的血管壁异常[7]。近年来,越来越多的研究发现高分辨磁共振血管壁成像(high-resolution magnetic resonance vessel wall imaging,HRMR-VWI)能够检测壁内血肿(intramural hematomas IMH),提高了iPICA-D无创诊断的准确性[8]。本文报告1例最终以HRMR-VWI诊断的iPICA-D,并回顾相关文献。
1 病例报告
1.1 临床资料 患者,男,40岁。右利手,主因“头晕伴左侧肢体无力8 d” 于2021年2月10日收住我科。患者工作中突发头晕、恶心呕吐伴左侧肢体无力于发病2 h左右就诊当地医院,完善颅脑CT平扫未见异常;7 h左右完善脑MRI+DWI未见异常;给予阿司匹林肠溶片100 mg,每日一次、阿托伐他汀钙片20 mg每晚一次口服治疗。于发病3 d出现右侧肢体麻木,8 d出现左眼睑下垂,遂转诊至我科。否认既往特殊病史及脑卒中家族史。入院查体:血压125/76 mmHg,心率66次/min,神清,问答切题,言语清晰,左额部无汗,左眼裂变小,左眼睑下垂,左侧瞳孔直径约2 mm,右侧瞳孔直径约3 mm,光反射灵敏,眼震(-),眼球各方向活动到位,四肢肌力Ⅴ级,肌张力正常,左侧面部及右侧肢体针刺觉减退,四肢深感觉正常,左侧指鼻试验、轮替试验及跟膝胫试验欠稳准,双侧Babinski征及Chaddock征(-);心、肺、腹查体未见异常。
NIHSS(National Institution of Health stmke Scale)评分:3分;MRS评分(Modified RaIlkin Scale):2分。
1.2 实验室及影像学检查 (1)实验室检查:甘油三酯2.83 mmol/L,低密度脂蛋白567.00 mg/dl;血常规、凝血全套、肝肾功能、尿酸、胆固醇、同型半胱氨酸、糖化血红蛋白、乙肝五项、丙型肝炎抗体、梅毒抗体、HIV抗体等指标均在正常范围;血沉、抗链球菌溶菌素、类风湿因子、免疫球蛋白、抗心磷脂抗体、抗中性粒胞浆抗体谱等各项风湿免疫指标未见异常。尿常规及粪便常规正常。
(2)影像学检查:脑MRI+DWI(2021年2月3日,当地医院)未见异常;脑MRI+DWI(2021年2月18日)提示:延髓左侧背外部急性梗塞病灶;脑血管超声(2021年2月17日)提示:左侧小脑后下动脉轻度狭窄;颅内动脉三维重建(2021年2月10日)提示:左侧椎动脉优势型供血,左侧椎动脉颅内段迂曲延长;HRMR-VWI(2021年2月18日)提示:左侧小脑后下动脉起始部管腔粗细不均匀,呈串珠样改变,局部管壁内T1WI轴位及T1WI曲面重建序列均可见新月形高信号影像,最终诊断为左侧小脑后下动脉起始部夹层并壁间血肿形成(见图1);全脑血管造影术(2021年2月22日)提示:左侧小脑后下动脉起始部管腔变细,走行僵硬,局限性造影剂充盈缺损,呈串珠样改变(见图2)。
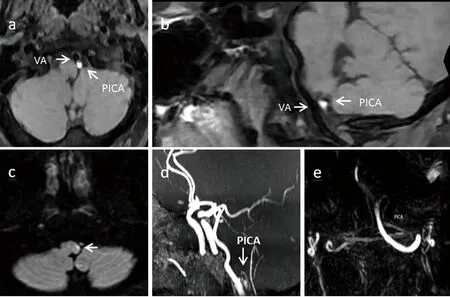
a~b图:T1WI 轴位、T1WI曲面重建提示左侧PICA管壁新月形高信号,提示壁间血肿形成。c图:DWI提示延髓左侧背外部急性梗死病灶。d~e图:TOF MRA、Tricks MR提示左侧PICA粗细不均匀,呈串珠样改变
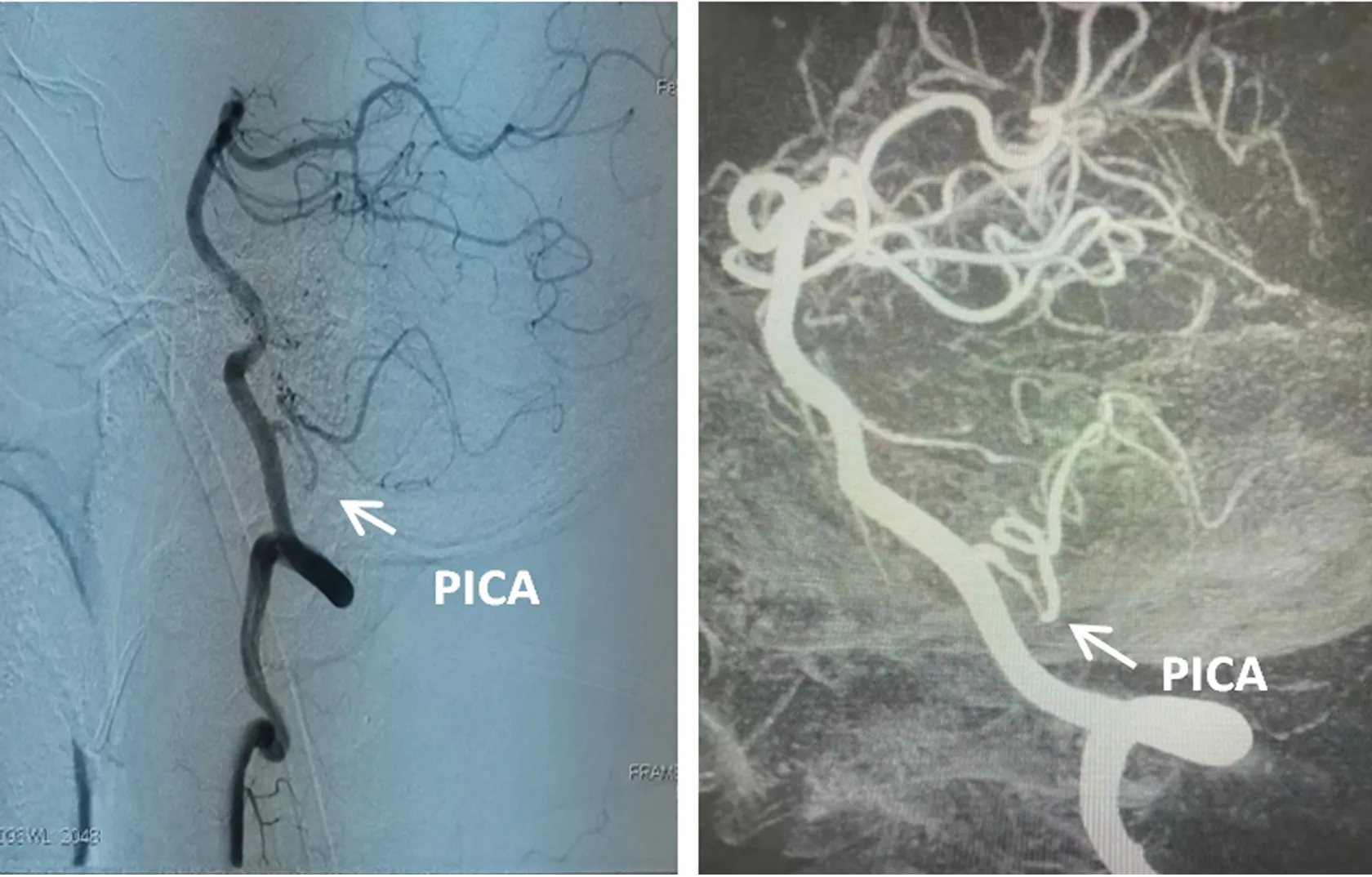
图2 DSA提示:左侧小脑后下动脉起始部管腔变细,走形僵硬,局限性造影剂充盈缺损,呈串珠样改变
1.3 诊疗经过及转归 入院当天予以阿司匹林肠溶片100 mg、硫酸氢氯吡格雷片225 mg、阿托伐他汀钙片20 mg口服。后给予阿司匹林肠溶片100 mg每日一次、硫酸氢氯吡格雷片75 mg每日一次、瑞舒伐他汀钙片10 mg每晚一次口服及丁苯酞氯化钠注射液100 ml每日两次静脉输注治疗,患者头晕及左侧肢体无力症状好转。出院时NIHSS评分:1分;MRS评分:0分。1 m随访:患者症状无复发,复查高分辨磁共振血管壁成像未见明确异常信号,提示左侧小脑后下动脉起始部壁间血肿吸收,管壁结构恢复良好(见图3)。
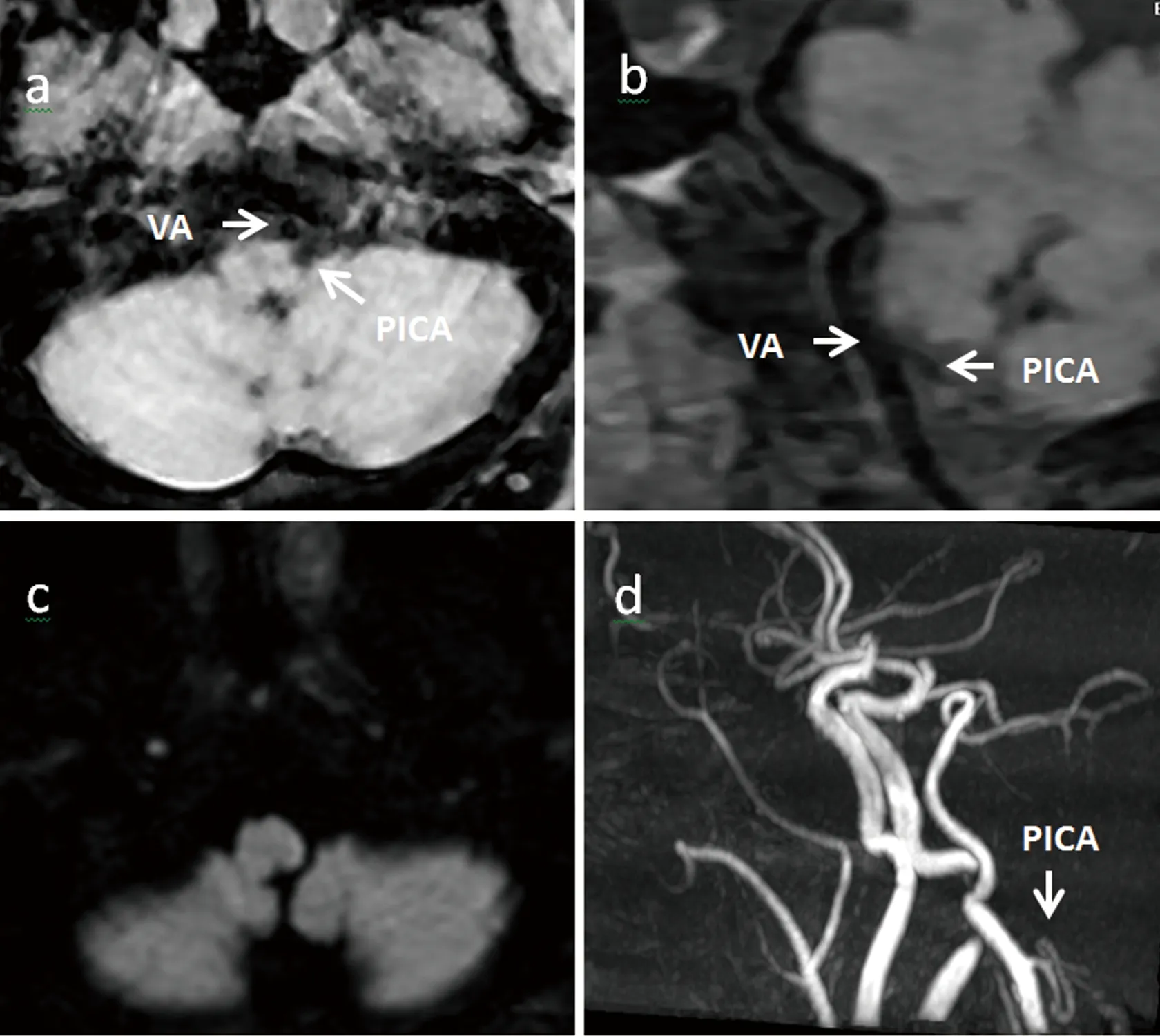
a~b图:T1WI轴位、T1WI曲面重建提示左侧PICA管壁壁内血肿吸收。c图:DWI提示延髓未见高信号。d图:TOF MRA提示左侧PICA起始处管腔轻度狭窄,管壁未见异常信号
2 讨 论
颅内动脉夹层(intracranial arterial dissection,IAD)是指各种原因使血液成分通过破损的颅内动脉内膜进入血管壁,导致血管壁间剥离分层形成血肿,或颅内动脉壁内自发性血肿,造成血管狭窄、闭塞或破裂的一种疾病[9]。包括iPICA-D在内的IAD,通常比颅外动脉夹层发病率低[10],属于少见病,在我国发病率不详[11]。iPICA-D的具体病因目前不详,有研究发现[12],日本或来自东亚的存在颅内血管病变(包括颅内动脉粥样硬化、腔隙性中风、脑出血、烟雾病和遗传性疾病,如大脑常染色体显性、隐性动脉病变)伴皮层下梗死和脑白质病变患者对iPICA-D表现出高易感性。Junpei 等在2015年的一项研究[10]中发现,iPICA-D通常发生在无脑血管病危险因素的青中年人群,发生部位主要在PICA的近端,均为左侧,可能与椎动脉通常为左侧优势有关。在不同的研究中iPICA-D的发病年龄22~68岁,平均年龄43.5岁[13]。在本研究中,患者为40岁无脑血管危险因素患者,iPICA-D发生在左侧PICA起始部,与文献报道相符。
同时,Junpei等通过对167例iPICA-D病例的回顾,发现iPICA-D引起了6%的PICA区梗死,等同于椎动脉夹层(Vertebral artery dissection,VAD),提示PICA-D的临床重要性被低估[10]。PICA的小脑分支和脉络膜分支与小脑上动脉(superior cerebellar artery,SCA)和小脑下前动脉(anterior inferior cerebellar artery,AICA)有丰富的吻合,而髓质分支缺乏吻合,故iPICA-D最常涉及的缺血区域是髓质分支供应的延髓背外部,导致延背外侧综合征(lateral medullary syndrome,LMS)[14]。尽管动脉粥样硬化仍然是导致LMS的血管事件最常见的原因,仍有少数iPICA-D病例出现LMS[15]。本病例未发现明确颅内动脉粥样硬化及心源性栓塞证据,提示iPICA-D是导致 LMS的直接原因。
目前公认的是[16],iPICA-D更可能是一种血管壁疾病,而不是一种血管管腔疾病,故[17]选择直接显示血管壁结构的成像技术可以更好地显示该病变的特征。血管造影(DSA)曾被认为是诊断iPICA-D的金标准,但其主要反映串珠样管腔改变,不能直接显示血管壁状态[18],故当PICA的管径正常时可能漏诊,管腔狭窄或闭塞时不易与动脉粥样硬化、动脉炎等疾病相鉴别,当iPICA-D伴有壁内血肿形成时,不能显示病变的全貌[19]。本病例患者血管造影仅显示局限性管腔狭窄,走形僵硬,并未有典型的“双腔征”、“壁内血肿”、“假腔内对比剂滞留”等常见动脉夹层的影像,单凭DSA影像,是无法对患者的动脉夹层做出诊断的。
多项研究[20~24]显示,IMH是iPICA-D诊断的一个典型征象,而HRMR-VWI可以直接显示受累血管壁的结构,其TI序列黑血技术能很好的检测出iPICA-D的微小IMH,提高iPICA-D病变的检出率,正确诊断由iPICA-D引起的PICA区髓质梗死。对于本病例,HRMR-VWI的T1WI 轴位、T1WI曲面重建序列可见左侧PICA管壁新月形高信号,提示壁间血肿形成。
在本研究中,HRMR-VWI能清晰地检测出与iPICA-D相关的异常影像学表现(包括T1加权序列的“壁间血肿”和3D TOF MRA序列的 “串珠征”)。根据目前被多数研究公认的,2008年由日本学者Minematsu等对454例自发性头颈部动脉夹层研究后提出的自发性头颈部动脉夹层诊断(SCADS)标准[25](见表1),该患者可明确诊断为iPICA-D(标准5、6、7、8匹配)。
有研究发现,iPICA-D比VAD[26]更容易引起蛛网膜下腔出血(SAH)。一些缺血发作的患者最初预期预后良好,但后来可能发展为SAH并导致死亡。因此,及时运用合适的检查方法尽早确诊,是确定合理治疗方案、改善预后的基础。虽然DSA可能为患者的PICA情况提供了有用的信息,但对于本病例,无创的HRMR-VWI技术足以明确血管状况,确定iPICA-D的诊断。因此,我们认为HRMR-VWI是诊断iPICA-D的一种有用且必需的技术。
iPICA-D治疗方案尚未达成一致,故规范的临床和影像学随访对于预后评估及指导治疗至关重要。DSA为有创检查,花费较高,并不是对iPICA-D患者进行随访的最合适检查。有学者认为HRMR-VWI可作为动脉夹层血管内治疗后首选的无创随访手段[11],且HRMR-VWI对于IMH治疗后的随访价值,国外也有相关报道[27]。本研究通过运用HRMR-VWI对患者进行最后确诊及随访,显示出HRMR-VWI对iPICA-D的诊断具有安全方便、准确性高、花费较低的优点,可以作为iPICA-D患者诊断及治疗有效性判断的可靠手段。
本研究存在一定的局限性。如本文所示,由于PICA的直径很小、HRMR-VWI的空间分辨率有限,HRMR-VWI未发现“内膜瓣”或“双腔征”的iPICA-D直接征象。另外,与常规MRI及CTA相比,HRMR-VWI的扫描时间更长,在躁动不安的患者,尤其是蛛网膜下腔出血患者中很难实施该技术。考虑到这些局限性,有必要对更多的iPICA-D患者进行前瞻性研究,探讨HRMR-VWI技术在明确诊断iPICA-D方面比传统血管造影的优势。
