碱熔-离子色谱法测定土壤中氟的方法研究
2022-10-18王斌堂乔浩吕旭邓长生李鹏飞马传亮
王斌堂,乔浩,吕旭,邓长生,李鹏飞,马传亮
(核工业二一六大队,新疆 乌鲁木齐 830011)
氟是自然界分布最广泛的元素之一,也是人和动物的必需微量元素。人和动物中的氟主要通过水和食物获得,而水和食物中的氟主要来源于土壤,因此土壤中的氟与人类密切相关。如果土壤中氟含量过低,则会导致水和食物中氟的缺乏,最终导致人和动物的氟缺乏,引发龋齿病,严重时形成大骨节病[1]。但是,如果土壤中的氟含量过高,则会导致氟中毒[2],轻则表现为氟斑牙,重则导致氟骨症。由于氟在土壤中具有不同的形态,不同条件下的评价标准有所不同。在酸性条件下,土壤氟的活性低,对水体的氟含量影响小,在此条件下可利用土壤中的全氟进行评价,评价标准为800 mg·kg-1[3-4];在碱性条件下,土壤中全氟的含量低,水溶性氟含量相对较高,土壤氟的活性高,对水体的氟含量影响大,因此在此条件下,可利用与水体氟含量关系密切的土壤水溶性氟来 评 价 判 断,其 评 价 标 准 为2.5 mg·kg-1[3-4]。由于土壤中的氟含量影响人类和动物的身体健康,对土壤中氟含量的监督、检测十分重要。土壤中氟的检测方法较多,目前主要有离子选择电极法[5]、比色法和离子色谱法[6]。
目前,测定土壤中氟的国家标准方法为《GB/T 22104—2008土壤质量 氟化物的测定离子选择电极法》[7],此方法简单易行,仪器操作简便。离子色谱测定法是一种集分离、检测于一体的分析方法,具有方法简单,操作方便,灵敏度高[8]等特点。本文参考《HJ 84—2016水质 无机阴离子(F-、Cl-、NO2-、Br-、NO3-、PO43-、SO32-、SO42-)的测定》[9]进行离子色谱法测定土壤中氟的方法研究,相较于现有国家标准方法氟离子选择电极法只能测定氟离子,离子色谱法在碱熔[10-12]处理样品条件下,具有明显的经济优势和工作效率提升,此方法具有较大的研究价值,研究发现离子色谱法实验操作简单快捷,检出限低、结果准确、经济适用,适合于大批量土壤中氟的测定。
1 离子色谱法实验
1.1 主要仪器与试剂
1)仪器:ICS-1100型离子色谱仪(美国戴安公司)(配备Dionex AERS500-4mm抑制器)、Dionex AS-DV型 自动 进样器,EGCШKOH淋洗液在线发生器;Milli-Qlntegral超纯水系统;50 mL镍坩锅;马弗炉;RP柱(美国戴安);孔径0.22 μm一次性水系微孔滤膜针筒过滤器;1~10 mL一次性注射器。
2)主要试剂:分析纯NaOH固体;中国地质科学院地球物理地球化学勘查研究所土壤及沉积物标准样品;离子色谱分析用F-、Cl-、Br-、NO3-和SO42-多元素标准溶液,标准值1 000 μg·mL-1;KOH淋洗液由KOH淋洗液在线发生器在线生成,浓度可在0~200 mmol·L-1内调节;电阻率>18.2 MΩ·cm(25℃)超纯水;732型强酸性阳离子交换树脂(H+交换树脂)。
1.2 色谱条件
1)色 谱 柱:AS-19 250*4 mm阴 离 子 分析柱,AG-19 50*4 mm保护柱;电导池温度35℃;柱温35℃。
2)流动相:20 mmol·L-1KOH,淋洗液流速1 mL·min-1,进样量25μL,电流50 mA,背景电导值小于1.0 μS。
1.3 实验方法与步骤
1.3.1试样制作
准确称取充分风干的土壤试样0.5 g(精确到0.000 1 g),过100目筛,对未过筛部分反复充分碾磨过筛。将过筛后的土壤样品放入洁净的50 mL镍坩锅中,加入3.0 g分析纯NaOH固体(±0.1g),用玻璃棒搅拌均匀后再均匀覆盖0.5 g分析纯NaOH固体,加盖后低温置于马弗炉中缓慢升温至370℃,使NaOH熔融并与试样充分混合,然后继续升温到600℃灼烧25 min后取出样品,等样品稍冷,用10 mL沸纯水将其溶解后转移至100 mL容量瓶中,用超纯水少量多次洗涤冲洗加入容量瓶定容。定容后静置澄清55 h后取上层清液,用732型强酸性阳离子交换树脂填充柱进行交换10 min后取得滤
液①:732型强酸性阳离子交换树脂填充柱是使用树脂填充在U型填充柱由实验员自行填充的,取澄清好的上清液加入交换柱,交换10 min后取得滤液作为待测液。每次交换过后使用5%盐酸洗脱再生,然后用水冲洗,至出水pH为5左右为止。,经0.22 μm过滤头过滤后即得到待测样品。根据上述方法同时做试剂空白。
1.3.2标准曲线绘制
使用以表1中选取的土壤和水系沉积物成分标准物质,按第1.3.1节方法进行处理制得系列标准溶液,氟离子浓度分别为1.02、2.03、4.30、6.50、9.90和11.20 μg·mL-1。以氟离子浓度x(μg·mL-1)为横坐标,峰面积y为纵坐标绘制出标准曲线,可得到线性方程y=0.388 5x+0.081 3,相关系数r=0.999 7,氟离子浓度与峰面积呈良好的线性关系(图1)。

表1 标准物质曲线选取的国家标准土壤样品Table 1 National standard soil samples selected by standard material curve
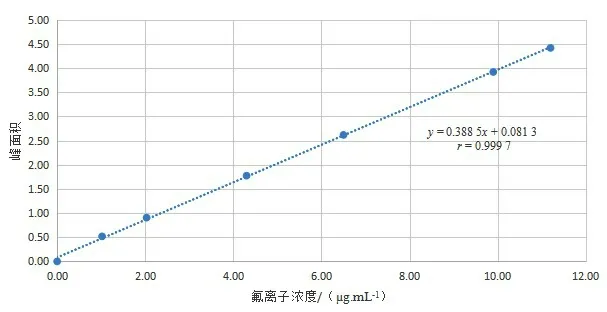
图1 标准物质曲线Fig.1 Standard material curve
1.3.3样品测定
取第1.3.1节处理好的待测样品,注入进样管依次放入自动进样盘,在离子色谱仪上进行测定,测得土壤样品中的氟离子浓度(如土壤样品中有机质较多,可选用美国戴安公司生产的RP柱对土壤样品熔出液预处理[8])。
2 实验方法分析研究
2.1 试样准备
2.1.1熔矿方法
处理固体样品中的含氟化合物目前有两种方法可以采用,1)高温水解法[13-14];2)碱熔法。高温水解法能够有效、可靠地处理固体含氟化合物,也能更加准确地测定氟含量,但是对操作技术要求高,测量费时费力,不适于处理批量样品,还需要昂贵的专用仪器才能完成。相比之下碱熔法易掌握、易操作、耗时短、成本低,且能满足批量处理的要求。根据我国幅员辽阔,各地域之间发展不平衡,土壤种类多样,氟含量可能因外部条件发生变化的基本状况,本文实验分析试样都是采用了更适用于我国国情的碱熔法取得。
2.1.2熔融剂用量
熔融剂的用量也对实验造成一定影响,用量少时会导致矿样不能完全熔融,用量过多则加热过程中溢出造成样品损失,且加入熔融剂量大还会造成后期样品pH值偏高影响到仪器测定精度。
选取土壤国家标准物质GBW07401、GBW07402和GBW07403开展NaOH用量条件实验,使用碱量1.0、2.0、2.5、3.0、3.5和4.0 g分析纯固体NaOH作为熔融剂进行条件实验,加盖后低温置于马弗炉中缓慢升温至370℃,让NaOH熔融并与试样充分混合,在炉温600℃下,每种加碱量条件下分别进行熔融25 min后,以第1.3节实验方法处理测定氟含量取平均值。以NaOH用量为横坐标,氟含量为纵坐标绘制NaOH用量与土壤氟熔出量关系图。实验证明在加入3.5 g固体NaOH的条件下,土壤试样已熔解充分,如图2所示。
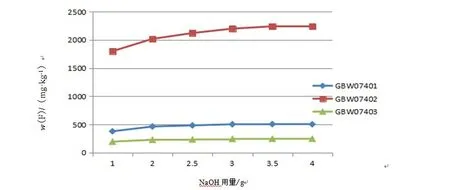
图2 NaOH用量与土壤氟熔出量关系Fig.2 Relationship between fluorine content and NaOH content in soil
2.1.3熔融温度控制
选取土壤国家标准物质GBW07401、GBW07402和GBW07403开展熔融温度条件实验,加入3.5 g分析纯固体NaOH作为熔融剂进行条件实验,熔融25 min,每种温度条件下分别进行5次熔融后,以本文第1.3节实验方法处理测定氟含量取平均值,以熔融温度为横坐标,氟含量为纵坐标绘制熔融温度与土壤氟熔出量关系图,由图3可见,500~600℃是熔融的最佳温度。使用NaOH作为熔融剂,升温至600℃灼烧,以更彻底清除残存有机物,避免大分子物质俘获氟离子造成测定值偏低,如图3所示。温度超过650℃会损坏坩埚,一定要合理控制温度。

图3 熔融温度与土壤氟熔出量关系Fig.3 Relationship between melting temperature and fluorine content in soil
2.1.4样品熔融时间选择
选取土壤国家标准物质GBW07401、GBW07402和GBW07403开展熔融时间条件实验,加入3.5 g分析纯固体NaOH作为熔融剂进行条件实验,加盖后低温置于马弗炉中缓慢升温至370℃,让NaOH熔解并与试样充分混合,然后继续升温到600℃后分别熔融10、15、20、25和30 min后取出样品,每种熔融时间条件下分别进行5次熔融后,以本文第1.3节实验方法处理测定氟含量取平均值,以熔融时间为横坐标,氟含量为纵坐标绘制熔融时间与土壤氟熔出量关系图,由图4可见,熔融25 min后土壤试样已熔解充分。
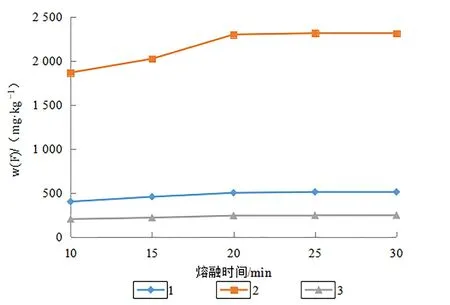
图4 熔融时间与土壤氟熔出量关系Fig.4 Relationship between melting time and amount of fluorine in soil
2.1.5静置澄清时间
试样混合液静置澄清时间[15]和试样中氟离子的浓度息息相关,由于没有明确规定澄清时间,有时熔样后当天测定,有时则隔夜测定,但大批量分析样品多为沉淀澄清过夜后第2天测定,由此造成澄清时间的选择随意性较大,导致数据可比性差。
分别取1#、2#土壤普查样及国家标准土壤样品GBW07405进行实验,按照第1.3.1节进行前处理后,在不同静置澄清时间下取得试样上机测试,使用标准物质曲线法计算土壤氟含量,结果如表2所示,实验验证可知,起始氟离子浓度随着静置时间延长迅速增大,达到25 h后氟离子浸出变得缓慢,约55 h达到峰值。可根据对实验准确度和实验进度选择适宜的静置澄清时间,通常以50~55 h为宜,55 h后试液中氟离子浓度已稳定。
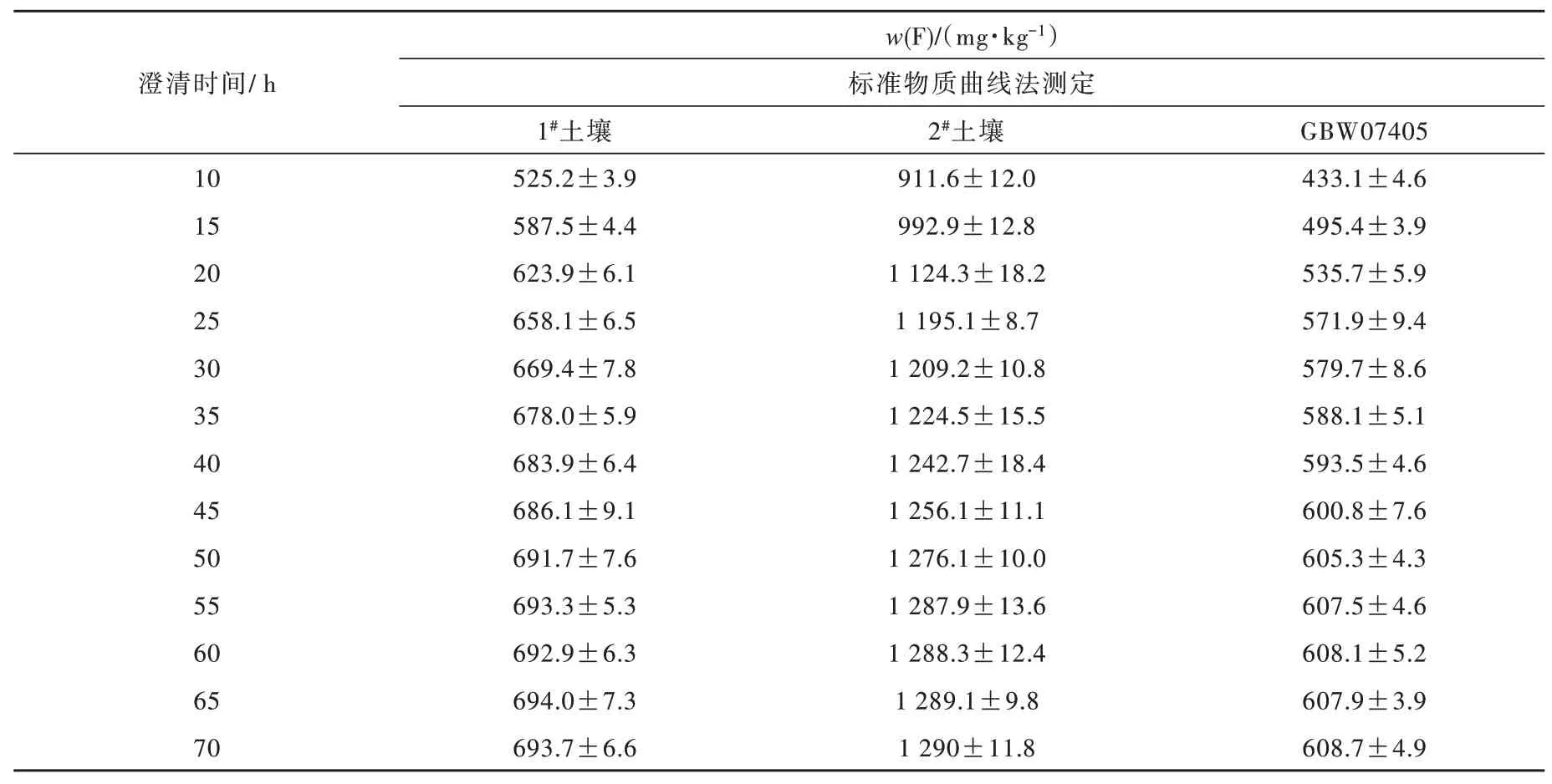
表2 不同澄清时间在标准物质曲线法下测得的氟含量Table 2 Fluorine content measured by standard substances curve method at different clarification times
2.2 共存离子的干扰和消除
2.2.1样品基体干扰消除
由于试样前处理期间加入NaOH,待测液呈强碱性同时存在大量的Na+,氟离子在离子色谱柱最先出峰,当样品液中存在大量的阳离子时,会导致抑制器过载,在死体积处出峰,影响氟离子的出峰,过量的OH-也会导致离子色谱柱受损,加入酸来调节pH值又会大量引入影响样品测定的阴离子,用732型强酸性阳离子交换树脂进行处理,将样品溶液调节至稍偏碱性可在不引入其他阴离子情况下消除基体干扰[15-16]。
2.2.2氟离子特性干扰排除
离子色谱法是分离、检测于一体的实验方法,可以同时分离和测量样品中多种共存的阴离子如:Cl-、SO42-、HPO42-和NO3-等;多次实验结果显示,阳离子的存在,如Mg2+和Ca2+等对测定有影响,有文献表明碱熔法测得的氟离子含量全部偏低,与热水解法的相对偏差范围介于4.23 %~34.82 %之间,平均相对偏低19.12 %[17],这可能缘于调节pH值大量阳离子形成的氢氧化物沉淀絮凝网捕、包裹、挟带、吸附了部分氟离子,从而降低了溶液中的氟含量;熔剂和土壤样品中的大量干扰离子如Al3+、Fe3+、Ca2+、Mg2+和Ti4+等与氟的络合降低了氟离子的活度[18]。为了提高测定结果的准确度和消除离子干扰使用标准物质曲线校正法,使用土壤和水系沉积物国家标准物质按照第1.3.1节绘制标准曲线。用标准溶液曲线法和标准物质曲线法分别进行测定,测定结果如表3所示,使用标准物质曲线法测得值和标准值更吻合,可以有效校正离子干扰。
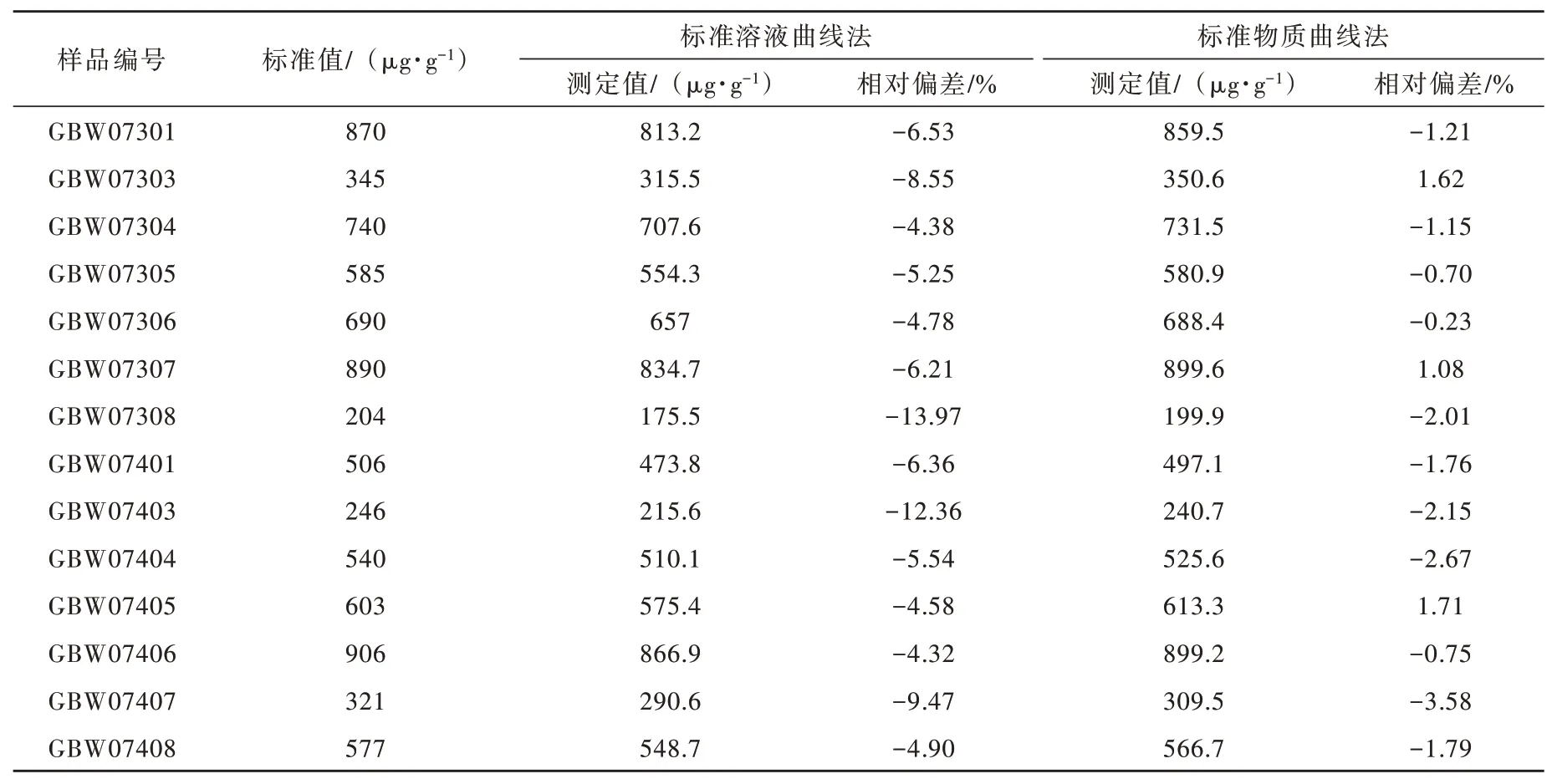
表3 标准溶液曲线法和标准物质曲线法测定结果对比表Table 3 Comparison of determination results by standard solution curve method and standard substance curve method
2.3 检出限
在熔融土壤样品相同的条件下同时进行10个空白样品熔融,在相同的离子色谱条件下进行10次空白样品的测定,由空白测量值的3倍标准偏差为检出限计算得:本实验F-的检出限为0.005 μg·mL-1,计算得到土壤中氟的检出限为1.0 mg·kg-1。
2.4 精密度
在上述条件离子色谱实验中,准确称取土壤标准样品GBW07403、GBW07450和GBW07402各10份,按第1.3.2节中标准曲线实验方法处理,将处理好的溶液进行10次重复测定,计算方法的精密度分别为2.2%、1.91%和1.69%,3组 样 品10次 测 定 值 的RSD均 小 于3%,表明精密度良好,完全能满足土壤样品和水系沉积物中氟的测定,实验结果见表4。

表4 土壤和水系沉积物中测定氟的精密度Table 4 Precision of determination of fluorine in soil and stream sediments
2.5 准确度
按本实验方法分析步骤测定土壤和水系沉积物国家标准物质,测定结果见表5,相对偏差均小于5%,测量值均在标准值的不确定度范围内,本实验方法的准确度良好。

表5 土壤和水系沉积物中测定氟的准确度Table 5 Accuracy of determination of fluorine in soil and stream sediments
2.6 加标回收率
选取含量从低到高3种国家标准物质GBW07403、GBW07450和GBW07402重复测定10次,进行加标回收率实验,实验结果如表6所示,加标回收率介于91%~105%之间。
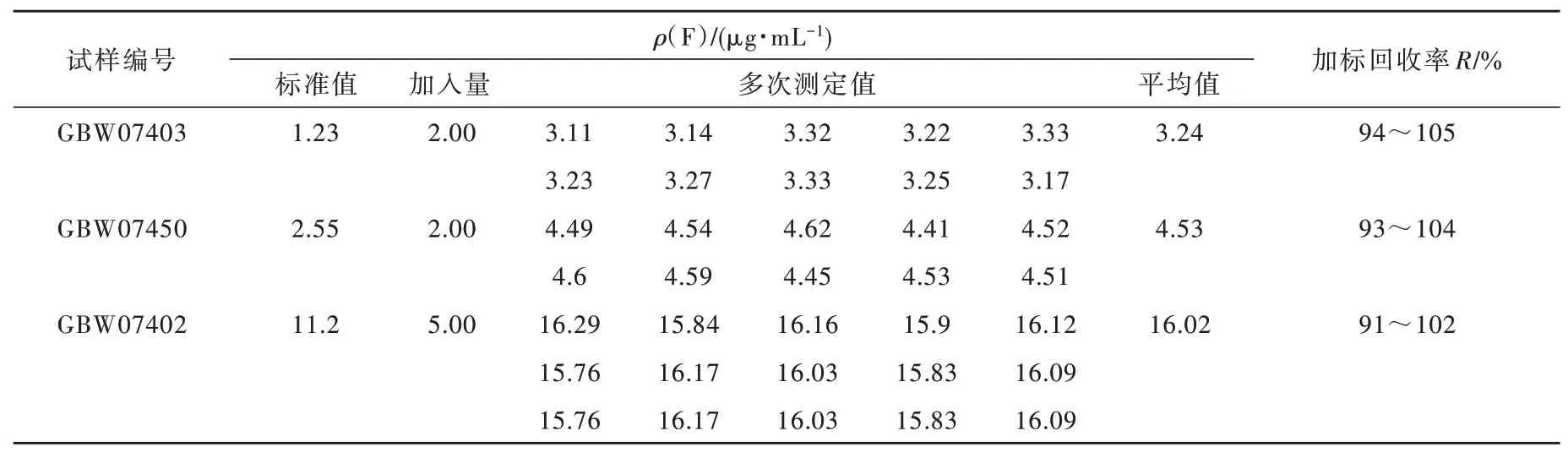
表6 土壤样品和水系沉积物中测定氟的加标回收率Table 6 The recoveries of determined fluorine in soil samples and stream sediments
3 结论
以碱熔-自动进样离子色谱组合的方法测定土壤中氟的含量,具有明显的经济优势和较大的工作效率提升。且本实验方法有以下优点:1)离子色谱法测定效率高,而且与其他方法相比检出限更低;2)溶出液静置55 h后测定,可以有效降低沉淀絮凝效果;3)用732型强酸性阳离子交换树脂进行处理溶出液,消除基体干扰;4)使用标准物质曲线法测定来校正测量数据,用以校正基体干扰,实验数据更准确;5)精密度、准确度、加标回收率和检出限均满足土壤检测的要求。
