发酵红参总皂苷对高糖诱导大鼠肾小管上皮细胞间充质转化的抑制作用及其机制
2022-10-18陈博学姜雨竹王胜告于春艳董志恒
曲 萌,郑 鸿,李 焱,陈博学,姜雨竹,王胜告,于春艳,董志恒
(1.北华大学基础医学院生物化学与分子生物学教研室,吉林 吉林 132013;2.北华大学基础医学院病理学教研室,吉林 吉林 132013;3.北华大学基础医学院解剖学教研室,吉林 吉林 132013)
糖尿病肾病(diabetic nephmpathy,DN)是导致糖尿病患者死亡的主要原因之一,主要病理改变为肾脏纤维化。研究[1]显示:导致DN发生发展的关键因素是肾小球的改变。近年研究[2]显示:肾小管结构及功能的变化对DN的病程发展有重要影响。作为肾小管间质纤维化的早期变化,上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)具有一定的可控性,其病变特点是肾小管上皮细胞转化为肌成纤维细胞,表现为细胞极性逐渐丧失、黏附力下降、细胞骨架重塑和细胞迁移力增强。在诱导EMT的多个信号通路中,转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smad信号通路受到广泛关注。沉默信息调节因子1(silent information regulator 1,SIRT1) 属 于Sirtuins家族,为一类依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的 第Ⅲ类组蛋白去乙酰化酶,在抗衰老、抗氧化和调节细胞代谢中均发挥重要作用[3]。SIRT1通过去乙酰化修饰Smad3和Smad4,进而下调TGF-β1/Smad途径,抑制EMT发生[4-6]。
发酵红参总皂苷(fermented red ginseng total saponins,FRGTS)是我国传统名贵中草药人参的熟制品红参发酵后的提取成分,与人参及红参比较,其抗氧化和抗炎等生物学活性均有增加。本课题组前期研究[7]显示:发酵红参活性组分可降低高糖条件下肾小球系膜细胞和心肌成纤维细胞的细胞增殖率,促进细胞外基质的分解,改善高糖对细胞的损伤。但FRGTS对高糖条件下肾小管上皮细胞是否同样具有保护作用尚不明确。本研究以大鼠肾小管上皮NRK-52E细胞为研究对象,观察FRGTS对高糖下肾小管上皮细胞EMT的影响,并基于SIRT1及其下游TGF-β1/Smad信号通路初步探讨其可能的作用机制,进一步为临床防治DN提供潜在靶点和有效手段。
1 材料与方法
1.1 细胞、主要试剂和仪器大鼠肾小管上皮NRK-52E细胞购自中国科学院上海分院。FRGTS由吉林大学药学院提供(皂苷含量73.4%),SIRT1抑 制 剂EX527(美 国Selleck Chemicals公司),DMEM培养基和标准胎牛血清(fetal bovine serum,FBS)(美国Gibco公司),ELISA试剂盒(武汉博士德生物工程公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(美国Bimake公司),逆转录试剂盒(北京全式金生物技术有限公司),兔抗E-钙黏蛋白(E-cadherin)、α-平 滑 肌 肌 动 蛋 白(α-smooth muscle actin,α-SMA)抗体、鼠抗SIRT1、TGF-β1和Smad3抗体(美国Santa Cruz公司),羊抗鼠二抗和羊抗兔二抗(美国Proteintech公司),引物由生工生物工程(上海)股份有限公司合成,其他试剂均为国产分析纯。CO2培养箱(日本Sanyo公司),RT-qPCR仪(美国应用生物系统公司),SpectraMax 190型全波长酶标仪(美国Molecular Devices公司),电泳装置及转移系统和凝胶成像系统(美国Bio-Rad公司)。
1.2 细胞培养和实验分组自液氮中取出大鼠NRK-52E细胞复苏,将细胞接种于含15% FBS的DMEM(含5.5 mmol·L-1D-葡萄糖)培养基中,37℃、5% CO2培养箱中培养,24 h半量换液,每2~3 d完全更换培养液1次,并在换液过程中逐渐将FBS浓度降为10%,待细胞长满瓶底后采用0.25%胰酶消化后传代。实验分为正常对照组(5.5 mmol·L-1D-葡萄糖)、高糖组(30.0 mmol·L-1D-葡 萄 糖)、EX527组(30.0 mmol·L-1D-葡 萄糖+10 μmol·L-1EX527)、FRGTS组(30.0 mmol·L-1D-葡 萄 糖+25 mg·L-1FRGTS)和EX527+FRGTS组(30.0 mmol·L-1D-葡萄糖+10 μmol·L-1EX527+25 mg·L-1FRGTS)。取5代NRK-52E细胞,以1×104mL-1密度接种于6孔细胞培养板中,贴壁后同步化(含0.5% FBS、5.5 mmol·L-1D-葡萄糖的DMEM培养液)24 h后按组别继续培养48 h,每组设5个复孔。
1.3 免疫荧光法检测各组细胞中E-cadherin和α-SMA蛋白表达水平待细胞铺满载玻片70%~80%时,4%多聚甲醛固定、0.3% Triton X-100破膜、BSA封闭后加入一抗,4℃湿盒中孵育过夜,滴加荧光标记二抗,室温下孵育2 h。倒置荧光显微镜下观察正常对照组和高糖组细胞中E-cadherin和α-SMA蛋白表达分布情况和表达水平,采用Image J软件,选择Default算法测定荧光强度以,以荧光强度表示各组细胞中E-cadherin和α-SMA蛋白表达水平,荧光强度单位为AU。
1.4 RT-qPCR法检测各组细胞中E-cadherin、α-SMA和SIRT1 mRNA表达水平采用TRIzol试剂提取各组细胞中总RNA,逆转录合成cDNA,以cDNA为模板进行PCR扩增。反应总体积为20 μL,反应条件:95℃预变性10 min,95℃、15 s,60℃、30 s,共40个 循 环。PCR引 物 序 列:E-cadherin,上游引物5′-GGTCGGTGCCCGTATTC-3′,下游引物5′-TGCCCTCGTTGGTCTTGC-3′;α-SMA,上游引物5′-GCGTGGCTATTCCTTCGTGACTAC-3′,下 游 引 物5′-CATCAGGCAGTTCGTAGCTCTTCTC-3′;SIRT1,上游引物5′-AGAGTTGCCACCAACACCTC-3′,下 游 引 物5′-ACTGGAACCAACAGCCTTGA-3′;GAPDH,上 游 引 物5′-ACAGCAACAGGGTGGTGGAC-3′,下 游 引 物5′-TTTGAGGGTGCAGCGAACTT-3′。采用2-△△Ct法计算目的基因mRNA表达水平。
1.5 ELISA法检测各组细胞培养上清液中Ⅰ型胶原(collagen typeⅠ,ColⅠ)水平收集各组细胞培养上清液,ELISA法检测各组细胞培养上清液中ColⅠ水平。严格按照试剂盒说明书操作。绘制标准曲线,计算各组细胞培养上清液中ColⅠ水平,单位为μg·L-1。
1.6 Western blotting法检测各组细胞中SIRT1、TGF-β1和Smad3蛋白表达水平收集各组细胞,加 入 蛋 白 裂 解 液,4℃、2 h,10 000 r·min-1离心5 min后留取上清,测定蛋白浓度,煮沸变性,各取50 μg蛋白样品上样,10% SDS-PAGE电泳分离蛋白,恒流转移至PVDF膜,脱脂奶粉封闭后按说明书方法加入一抗,4℃孵育过夜,加入相应二抗,DAB显色,凝胶成像系统拍照。以β-actin为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.7 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组细胞中E-cadherin、α-SMA和SIRT1 mRNA表达水平,各组细胞培养上清液中ColⅠ水平,各组细胞中SIRT1、TGF-β1和Smad3蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
2 结 果
2.1 2组NRK-52E细胞中E-cadherin和α-SMA蛋白表达水平免疫荧光法检测结果显示:正常对照组NRK-52E细胞贴壁生长,呈三角形、多边形,细胞轮廓清晰,铺路石样排列,细胞膜上E-cadherin表达[(174.293±14.048)AU]明显,胞质内少量 α-SMA表达 [(108.118±7.793)AU]。与 正 常 对 照 组 比 较,高 糖 组NRK-52E细胞形态逐渐变为不规则形和梭形,E-cadherin表达水平[(80.341±6.867)AU]明显降低(P<0.01),α-SMA表达水平[(207.210±11.135)AU]明显升高(P<0.01)。见图1。
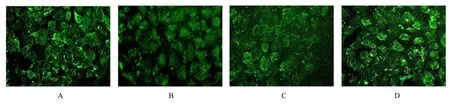
图1 2组细胞中E-cadherin和α-SMA蛋白表达(免疫荧光,×400)Fig.1 Expressions of E-cadherin and α-SMA protein of cells in two groups(Immunofluorenscence,×400)
2.2 各组NRK-52E细胞中E-cadherin和α-SMA mRNA表达水平与正常对照组比较,高糖组NRK-52E细胞中E-cadherin mRNA表达水平明显降低(P<0.01),α-SMA mRNA表达水平明显升高(P<0.01);与高糖组比较,FRGTS组NRK-52E细胞中E-cadherin mRNA表达水平明显升高(P<0.01),α-SMA mRNA表达水平降低(P<0.05);与FRGTS组比较,EX527+FRGTS组NRK-52E细胞中E-cadherin mRNA表达水平明显降低(P<0.01),α-SMA mRNA表达水平升高(P<0.05)。见表1。
表1 各组NRK-52E细胞中E-cadherin和α-SMA mRNA表达水平Tab.1 Expression levels of E-cadherin and α-SMA mRNA in NRK-52E cells in various groups (n=5,±s)

表1 各组NRK-52E细胞中E-cadherin和α-SMA mRNA表达水平Tab.1 Expression levels of E-cadherin and α-SMA mRNA in NRK-52E cells in various groups (n=5,±s)
*P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs high glucose group;#P<0.05,##P<0.01 vs FRGTS group.
Group Normal control High glucose EX527 FRGTS EX527+FRGTS E-cadherin 1.000±0.000 0.316±0.030*0.314±0.025*0.488±0.047*△△0.336±0.031*##α-SMA 1.000±0.000 2.317±0.247*2.464±0.236*1.917±0.191*△2.386±0.218*#
2.3 各组NRK-52E细胞培养上清液中ColⅠ水平正常对照组NRK-52E细胞培养上清液中ColⅠ水平较低。与正常对照组比较,高糖组NRK-52E细胞培养上清液中ColⅠ水平明显升高(P<0.01);与高糖组比较,FRGTS组NRK-52E细胞培养上清液中ColⅠ水平降低(P<0.05);与FRGTS组 比 较,EX527+FRGTS组NRK-52E细胞培养上清液中ColⅠ水平升高(P<0.05)。见表2。
表2 各组NRK-52E细胞培养上清液中ColⅠ水平Tab.2 Levels of ColⅠin cell supernatant of NRK-52E cells in various groups [n=5,±s,ρB/(μg·L-1)]

表2 各组NRK-52E细胞培养上清液中ColⅠ水平Tab.2 Levels of ColⅠin cell supernatant of NRK-52E cells in various groups [n=5,±s,ρB/(μg·L-1)]
*P<0.01 vs normal control group;△P<0.05 vs high glucose group;#P<0.05 vs FRGTS group.
Group Normal control High glucose EX527 FRGTS EX527+FRGTS ColⅠ1.031±0.045 3.042±0.181*3.003±0.209*2.667±0.220*△3.010±0.116*#
2.4 各组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平与正常对照组比较,高糖组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平均明显降低(P<0.01);与高糖组比较,FRGTS组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平均升高(P<0.05或P<0.01);与FRGTS组比较,EX527+FRGTS组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平均明显降低(P<0.01)。见表3和图2。

图2 各组NRK-52E细胞中SIRT1蛋白表达电泳图Fig.2 Electrophoregram of expression of SIRT1 protein in NRK-52E cells in various groups
表3 各组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平Tab.3 Expression levels of SIRT1 mRNA and protein in NRK-52E cells in various groups (n=5,±s)

表3 各组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平Tab.3 Expression levels of SIRT1 mRNA and protein in NRK-52E cells in various groups (n=5,±s)
*P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs high glucose group;#P<0.01 vs FRGTS group.
Group Normal control High glucose EX527 FRGTS EX527+FRGTS SIRT1 mRNA 1.000±0.000 0.295±0.051*0.257±0.042*0.380±0.047*△0.277±0.032*#SIRT1 protein 1.092±0.075 0.361±0.039*0.304±0.026*0.542±0.050*△△0.319±0.026*#
2.5 各组NRK-52E细胞中TGF-β1和Smad3蛋白表达水平正常对照组NRK-52E细胞中TGF-β1和Smad3蛋白均有少量表达。与正常对照组比较,高糖组NRK-52E细胞中TGF-β1和Smad3蛋白表达水平明显升高(P<0.01);与高糖组比较,FRGTS组NRK-52E细胞中TGF-β1和Smad3蛋白表达水平降低(P<0.01);与FRGTS组比较,EX527+FRGTS组NRK-52E细 胞 中TGF-β1和Smad3蛋白表达水平明显升高(P<0.01)。见表4和图3。
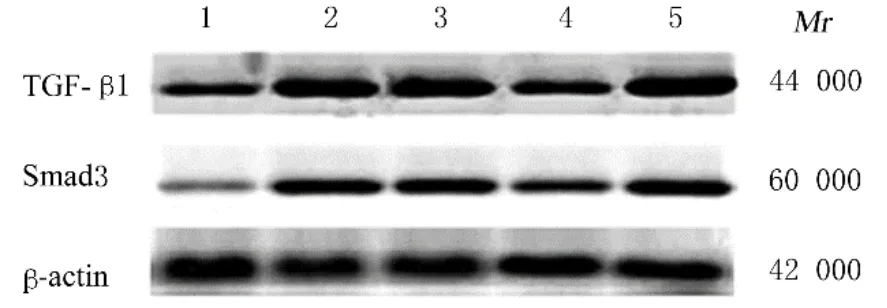
图3 各组NRK-52E细胞TGF-β1和Smad3蛋白表达电泳图Fig.3 Electrophoregram of expressions of TGF-β1 and Smad3 proteins in NRK-52E cells in various groups
表4 各组NRK-52E细胞中TGF-β1和Smad3蛋白表达水平Tab.5 Expression levels of TGF-β1 and Smad3 proteins in NRK-52E cells in various groups (n=5,±s)
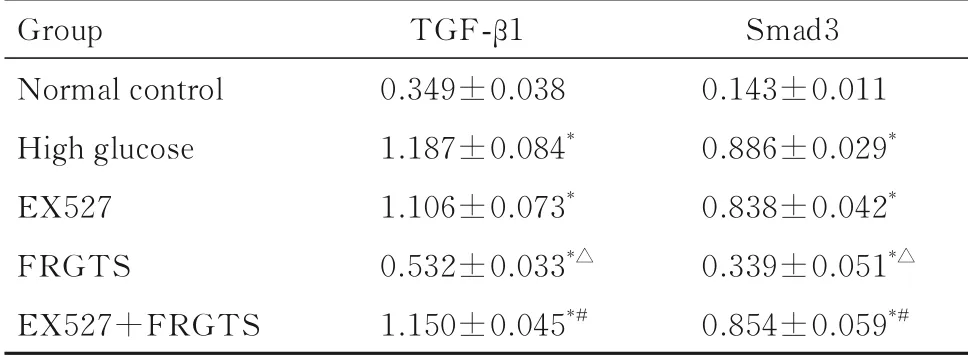
表4 各组NRK-52E细胞中TGF-β1和Smad3蛋白表达水平Tab.5 Expression levels of TGF-β1 and Smad3 proteins in NRK-52E cells in various groups (n=5,±s)
*P<0.01 vs normal control group;△P<0.01 vs high glucose group;#P<0.01 vs FRGTS group.
Group Normal control High glucose EX527 FRGTS EX527+FRGTS TGF-β1 0.349±0.038 1.187±0.084*1.106±0.073*0.532±0.033*△1.150±0.045*#Smad3 0.143±0.011 0.886±0.029*0.838±0.042*0.339±0.051*△0.854±0.059*#
3 讨 论
细胞外基质(extracellular matrix,ECM)过量聚积导致肾间质纤维化是DN的主要病理特征之一。EMT在肾间质纤维化过程中发挥着重要作用,所形成的肌成纤维细胞不但可使ColⅠ、Ⅲ型胶原(collagen typeⅢ,ColⅢ)和纤连蛋白等ECM成分过量分泌,还可破坏肾脏固有结构[8-9]。发生EMT的肾小管上皮细胞,其上皮细胞的特性被抑制,细胞形态改变,转化为具有纺锤体形态的间充质细胞。具体表现为上皮标志物如E-cadherin和β-连环蛋白(β-catenin)下调,细胞间黏附连接丧失[10-11];肌动蛋白骨架重组,间充质标志物如α-SMA和波形蛋白的获得;通过锌离子依赖性基质金属蛋白酶破坏肾小管基底膜而浸入间质,分泌大量ECM以导致肾纤维化。本研究结果显示:高糖刺激大鼠肾小管上皮NRK-52E细胞48 h后,与正常对照组比较,高糖组NRK-52E细胞形态呈不规则形和梭形,E-cadherin mRNA和蛋白表达水平均降低,α-SMA蛋白表达水平升高,同时ColⅠ水平明显升高,提示高糖诱导NRK-52E细胞发生EMT。
在与纤维化相关的各种肾脏疾病中,TGF-β1作为关键因子呈高表达。在DN中,高血糖会刺激TGF-β1 mRNA和蛋白表达水平及其受体表达水平均上调。高表达的TGF-β1与细胞表面上转化生长因子β受体(transforming growth factor-β receptor,TGF-βR)结合后,将信号传入细胞内,招募并磷酸化激活Smad2和Smad3,Smad4可与活化的Smad2和Smad3形成异三聚复合体,并易位于细胞核,结合和调控靶基因转录,导致ECM合成增加和降解受阻,诱导肾小球和肾小管发生EMT[12-15]。本研究结果显示:高糖作用下NRK-52E细胞中TGF-β1和Smad3表达水平增加,提示TGF-β1/Smad信号通路被激活。TGF-β1是肾纤维化的主要推动力,可以作为DN治疗的理想靶点,在DN小鼠模型中也成功地利用TGF-β1中和性单克隆抗体预防了肾小球肥大[16-17]。然而,研究[18]显示:在临床上使用TGF-β1特异性抗体治疗,并未能延缓DN患者肾小球滤过率和尿蛋白含量降低。TGF-β1靶向治疗的失败,使研究热点转而关注于TGF-βR及下游的Smads。Smad3过度活化及Smad7表达下调可直接导致TGF-β1/Smad通路信号失衡,减少信号失衡是延缓肾纤维化发生发展的关键。Smad3激活后可促进与致纤维化基因的结合,上调ColⅠ和ColⅢ等蛋白表达。小鼠Smad3基因缺失可延缓DN模型鼠的病程进展,表现为小鼠尿白蛋白排泄和血清肌酐水平未见明显升高,而使用Smad3特异性抑制剂可有效减缓近端肾小管上皮细胞的EMT,进而减轻肾纤维化[19-21]。可见,Smad3在DN的发展过程中同样起重要作用,而Smad3的活性不但受磷酸化水平控制,同时也受乙酰化修饰的影响,高表达的TGF-β1同时会升高Smad3乙酰化水平。
SIRT1可对不同类型的底物去乙酰化,包括转录因子、DNA修复蛋白和信号传导因子,广泛参与基因转录、细胞衰老、能量代谢和胰岛素分泌等过 程[3,22-23]。SIRT1活 性 与NAD浓 度 密 切 相 关,依据胞内NAD浓度,SIRT1感知细胞能量状态,去乙酰化修饰特定底物参与多种代谢调节。SIRT1在DN发生发展中的作用被广泛关注[24-25]。在DN动物模型中,通过激活SIRT1,可缓解系膜细胞、成纤维细胞及肾小管上皮细胞中因TGF-β介导的Smad2和Smad3乙 酰 化 水 平 的 升 高[4-5]。Smad3乙酰化反应由肾脏间质纤维化的早期开始持续至终末期。研 究[4,6]表 明:SIRT1通 过 对Smad3去 乙 酰化,可明显减少因TGF-β/Smad3信号通路激活而上调的α-SMA、Ⅳ型胶原(collagen typeⅣ,ColⅣ)和纤连蛋白表达水平,延缓肾纤维化,而敲除SIRT1后,上述作用消失。因此,可以通过激活SIRT1来阻断TGF-β1/Smad信号通路,进而抑制器官纤维化。本研究采用高糖处理NRK-52E细胞48 h后,与正常对照组比较,高糖组NRK-52E细胞中SIRT1 mRNA和蛋白表达水平明显降低。综上所述,SIRT1在抗纤维化中发挥作用并对TGF-β1/Smad通路有重要调节作用。本研究设立了SIRT1特异性小分子抑制剂EX527组和EX527加FRGTS干预组,以观察FRGTS对SIRT1的调节作用。
红参发酵后其生物利用度和生物学活性增加。与红参比较,红参发酵产物清除DPPH自由基能力和抑制脂质氧化能力增强[26]。BAE等[27]对卵清蛋白诱导的过敏性鼻炎小鼠的研究显示:发酵红参可通过抑制白细胞介素4和免疫球蛋白E表达进而减轻炎症反应。CHEON等[28]研究显示:发酵红参可改善ob/ob小鼠胰岛素敏感性,小鼠的血糖、甘油三酯、总胆固醇和游离脂肪酸等均降低。在链脲佐菌素诱导的DM动物模型和2型糖尿病临床研究[29-30]中均证实了发酵红参的降糖作用。本课题组前期研究[7]显示:红参发酵产物可明显抑制高糖诱导下的大鼠肾小球系膜细胞增殖,同时上调基质 金 属 蛋 白 酶2(matrix metalloproteinase-2,MMP-2)的表达,下调组织金属蛋白酶抑制因子2(tissue inhibitor of metalloproteinase-2,TIMP-2)的表达,促进ECM的降解。FRGTS是红参发酵产物中总皂苷组分,本研究通过高糖诱导大鼠肾小管上皮细胞发生EMT,使用FRGTS干预后,上皮细胞标记蛋白E-cadherin表达水平升高,而上皮细胞转分化为肌成纤维细胞的标志蛋白α-SMA表达水平降低,ColⅠ水平明显降低,表明FRGTS对高糖所致的EMT有一定的抑制作用。同时,FRGTS对 高 糖 所致的TGF-β1和Smad3表 达具有下调作用,并上调SIRT1表达,应用SIRT1特异性抑制剂EX527后,减弱了上述作用。由此推断,SIRT1可能为FRGTS的效应靶点之一。
综上所述,FRGTS可减缓高糖刺激导致的肾小管上皮细胞EMT的发生,其作用机制可能与FRGTS有效上调SIRT1表达、进而下调TGF-β1/Smad信号通路活性有关。本研究进一步证实发酵红参对DN中肾纤维化具有一定的抑制作用,但仅对其作用机制进行了初步探讨,其具体作用机制尚有待于后续实验的深入研究。
