细梗香草总皂苷-A对人结肠癌SW620 细胞侵袭与迁移的作用机制研究
2022-10-18田慧芹荆雪宁房俊楠高荧
田慧芹,荆雪宁,房俊楠,高荧
(山东中医药高等专科学校药理教研室,山东烟台 264100)
近年来,许多学者针对中药提取物抗肿瘤活性进行了广泛深入研究。对于细梗香草皂苷的研究,十年以来成为了热点,它们具有显著的抗肿瘤增殖和诱导凋亡的活性。浙江大学于秀颖课题组研究发现,在3个单体皂苷细梗香草总皂苷-A(LC-A)、LC-B、LC-C中,LC-B 和LC-C 溶血性较强,制备成单体药物具有一定的困难; 而LC-A 溶血性低,具有相对较大的研究利用价值[1]。经过进一步的研究,制定出了较完善的LC-A 制备工艺,并进行了相关药代动力学研究。山东中医药大学宫明华对LC-A 的体内外抗肿瘤药效进行了评价,通过LC-A 在体外对几种常见人源肿瘤细胞株的增殖抑制作用研究,得到该药的抗瘤谱,结果显示LC-A 对结肠癌SW620 细胞有明显的抑制作用[2]。在对细梗香草总皂苷对非小细胞肺癌放疗增敏作用的研究中,浙江中医药大学陈素梅发现细梗香草总皂苷具有抑制肺癌细胞侵袭转移的能力[3]。LC-A对SW620细胞的侵袭和转移是否也有作用,之前尚未研究。大量研究表明,结肠癌发生发展过程中,NF-κB信号通路的异常激活发挥了重要作用。结肠癌细胞中,核因子-κB(NF-κB )通路持续激活,活化后的NF-κB 通过促进B淋巴细胞瘤-2(Bcl-2)、c-Myc、基质金属蛋白酶-9(MMP-9)和基质金属蛋白酶-2(MMP-2)等下游基因的高表达,引起结肠癌细胞的增殖、迁移和侵袭[4]。本研究进一步检测LC-A抑制SW620细胞增殖的活性。通过划痕实验、Transwell小室实验,检测LC-A对SW620细胞侵袭和转移的影响。若出现预期结果,最后将采用蛋白质印迹(WB)法检测侵袭转移相关蛋白MMP-2,MMP-9和NF-κB通路激活因子肿瘤细胞因子-α(TNF-α),环氧化酶-2(COX-2)等的表达,探讨其可能的NF-κB信号通路机制。
1 材料与方法
1.1 材料 完全DMEM(高糖)培养基(KGM12800S,凯基生物)、不完全DMEM(高糖)培养基(KGM12800N,凯基生物)、FBS(10099-141,Gibco)、胰蛋白酶-EDTA消化液(T1300,Solarbio)、PBS(0.01M,pH=7.4)(KGB5001,凯基生物)、SW620(S30140、源叶生物)、LC-A(B21177,源叶生物)、CCK-8法细胞增殖检测试剂盒(KGA317,凯基生物)、RIPA细胞裂解液(C1053,普利莱基因技术)、BCA蛋白定量试剂盒(CW0014S,康为世纪)、30% 丙烯酰胺(A1010,Solarbio)、1M Tris-HCL缓冲液(pH=6.8)(T1020,Solarbio)、1.5M Tris-HCL、缓冲液(pH=8.8)(T1010,Solarbio)、SDS(151-21-3,西陇科学股份有限公司)、过硫酸铵(天津市致远化学试剂有限公司)、甘氨酸(G8200,Solarbio)、四甲基乙二胺(TEMED)(T105496,阿拉丁)、Marker(#26617,Thermo)、PVDF 膜(IPVH00010,Millipore)、封闭专用脱脂奶粉(P1622,普利莱基因技术)、牛血清白蛋白(BSA)(A8020,索莱宝)、超敏发光液(RJ239676,赛默飞)结晶紫染色液(G1061,Solarbio)抗体根据不同实验选择,内参一抗:Mouse Monoclonal Anti-βACTIN(TA-09,中杉金桥,1/2 000);二抗:辣根酶标记山羊抗鼠IgG(H+L)(ZB-2305,中杉金桥,1/2 000);目的一抗:Rabbit Anti MMP-2 (AF0577,Affinity,1/500);目的一抗:Rabbit Anti MMP-9(AF5228,Affinity,1/500);目的一抗:Rabbit Anti TNF-α (AF7014,Affinity,1/500);目的一抗:Rabbit Anti COX2 (AF7003,Affinity,1/500);二抗:辣根酶标记山羊抗兔IgG(H+L)(ZB-2301,中杉金桥,1/2 000)。本研究经山东中医药高等专科学校实验伦理审查批准。
1.2 研究方法 ①细胞实验。人结肠癌细胞株SW620购于源叶生物(B21177),SW620细胞传代扩培,铺96孔板。实验分组进行细胞加药处理,24 h完成造模进行CCK8检测,摸索药物最佳浓度。LC-A浓度摸索分组如下:空白组、5 μg/ml LC-A处理组、10 μg/mL LC-A处理组、15 μg/mL LC-A处理组、20 μg/mL LC-A处理组、25 μg/mL LC-A处理组、30 μg/mL LC-A处理组、40 μg/mL LC-A处理组、45 μg/mL LC-A处理组、50 μg/mL LC-A处理组、60 μg/mL LC-A处理组、70 μg/mL LC-A处理组。②实验分组。对照组:用10 μg/mL的LC-A处理SW620细胞;低剂量组(Medium succinate acid group):用10 μg/mL的LC-A处理SW620细胞;中剂量组(Low succinate acid group): 用 15 μg/mL 的LC-A处理SW620细胞;高剂量组(High succinate acid group):用20 μg/mL的LC-A处理SW620细胞。③CCK8法。药物处理前12 h铺板,密度稀释为每孔5×103个SW620细胞,每孔加悬液100 μL;培养过夜后加入4种不同浓度的LC-A,将细胞继续培养24 h。吸掉培养基,每孔加10 μLCCK8试剂,于培养箱中孵育96孔板2 h;采用酶标仪(北京市六一仪器厂,型号:WD-2102B)测定在450 nm处每孔的吸光值,计算存活率。④划痕实验。将SW620细胞接种于6孔板,待贴壁的单层细胞密度达到90%以上,用200 μL枪头在孔内划线,每孔划3条平行线,PBS清洗3次洗去划下的SW620细胞,再换用不含血清的培养基,加入不同浓度的LC-A,采用倒置显微镜(OLYMPUS,型号:CX41)观察并给每孔的划痕拍照(0 h);培养箱孵育48 h后再次拍照(48 h)。测量0 h和48 h划痕的宽度,进而计算出细胞的迁移速率。迁移速率=迁移距离/迁移时间×100%。⑤Transwell实验。将造模后的SW620细胞消化、收集、离心,用无血清的培养处理细胞,计数,每个小室细胞数5×104个;在侵袭小室下室加入500 μL完全培养基,上室细胞与无血清培养基总体积300 μL;培养箱培养48 h后染色。⑥WB检测。取指数生长期SW620细胞接种于6孔板,过夜,待细胞贴壁后,各孔中分别加入不同浓度的LC-A孵育48 h。弃培养基,PBS洗2遍,在冰上每孔加入100 μL的细胞裂解液。将细胞刮至一侧,移液枪吸入已做好标记的EP管中。采用高速离心机(Eppendorf,型号:5424R )以12 000 r/min离心10 min,取上清液移至新的EP管(BCA测定),蛋白变性,置于-20 ℃环境下保存。上样、电泳(SDSPAGE)1.5 h,用300 mA恒流转膜1.5 h。将转有蛋白质的PVDF膜放入一抗孵育盒,4 ℃冰箱孵育过夜,次日将PVDF膜放入二抗孵育盒,室温2 h,洗膜,显影成像。
1.3 统计学分析 采用SPSS 20.0统计学软件进行数据处理。计量资料以()表示,采用t检验。组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 LC-A 对人结肠癌细胞增殖影响 通过CCK8法检测LC-A对人结肠癌细胞SW620 增殖的抑制情况,LC-A 浓度大于或等于15 μg/mL时,细胞增殖受到显著抑制,见图1。
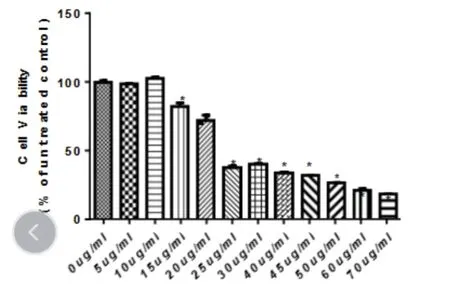
图1 不同浓度的LC-A 对SW620细胞增殖的影响
2.2 LC-A 对SW620细胞迁移影响 迁移实验结果显示,处理组与对照组低、中、高剂量的发生迁移的细胞数目比较,差异无统计学意义(P>0.05),见图2、图3。
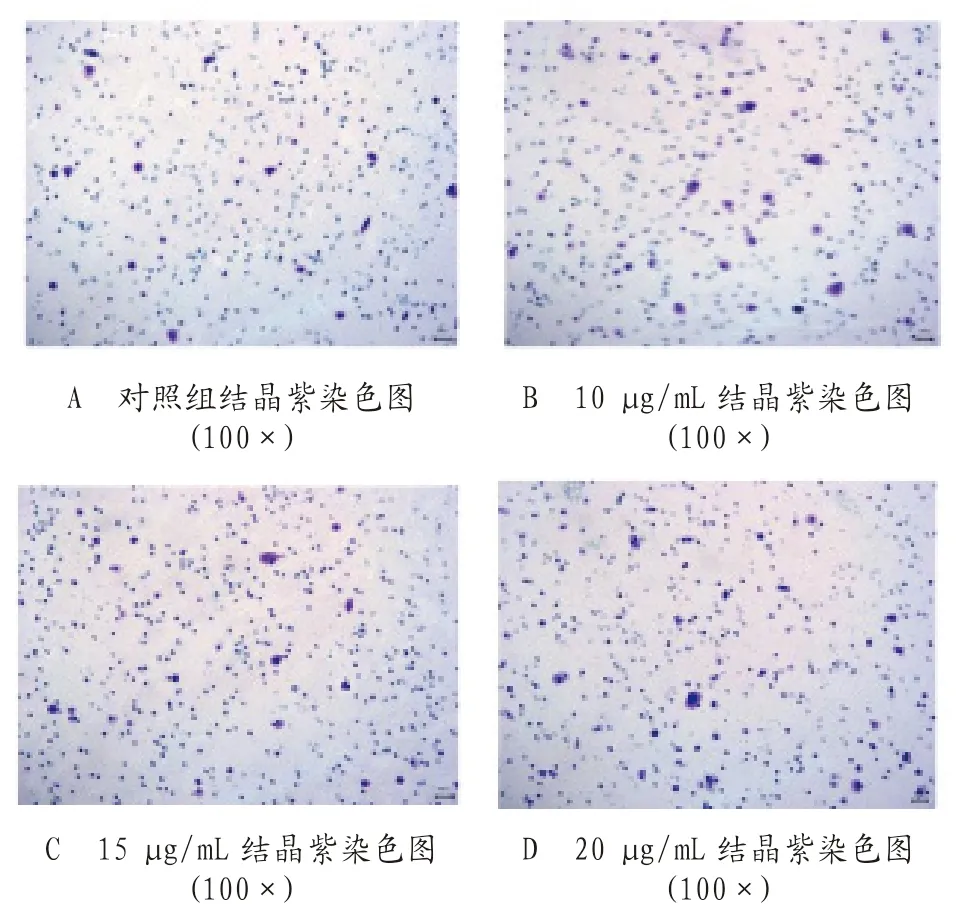
图2 Transwell(不带胶小室)检测不同剂量LC-A 对SW620细胞迁移的影响
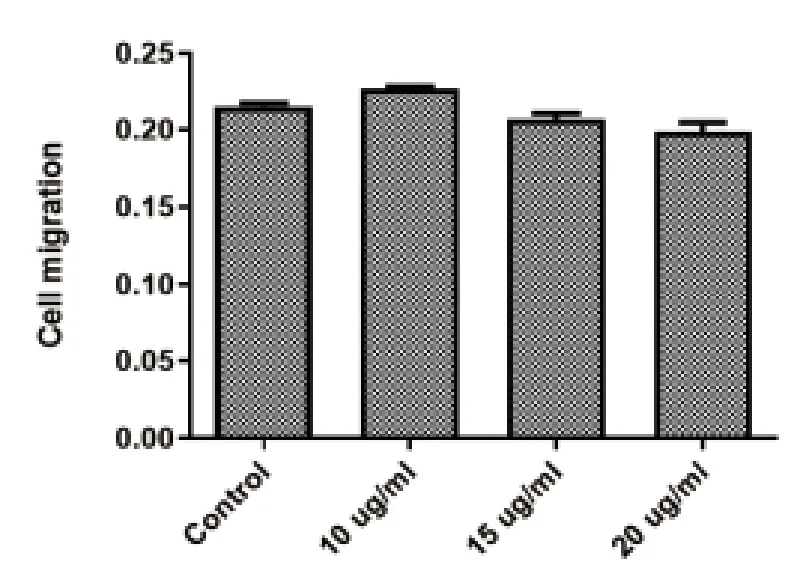
图3 Transwell(不带胶小室)检测不同剂量LC-A 对SW620细胞迁移能力定量分析
2.3 LC-A对SW620细胞侵袭影响 细胞侵袭实验结果显示,处理组低、中、高剂量的发生迁移的细胞侵袭少于对照组,细胞的侵袭能力受到抑制,差异有统计学意义(P<0.05),见图4、图5。
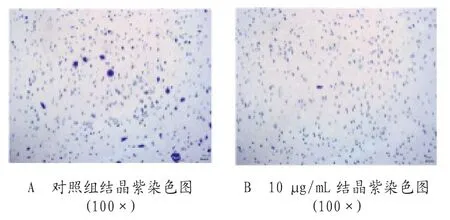
图4 Transwell(带胶小室)检测不同剂量LC-A 对SW620细胞侵袭能力

图5 Transwell(带胶小室)检测不同剂量LC-A 对SW620细胞侵袭能力定量分析
2.4 Western blot 检测结果显示,与对照组相比,不同剂量LC-A 的处理组中人结肠癌细胞的侵袭转移相关蛋白MMP-2、MMP-9 表达均下调;NF-κB 通路激活因子TNF-α、COX2 表达也下调,见图6。

图6 WB 检测侵袭转移相关蛋白及NF-κB 通路激活因子的表达
3 讨论
实验结果显示,LC-A 能够显著抑制SW620 细胞的增殖。在后续的实验中选用0、10 μg/mL、15 μg/mL 和20 μg/mL作为药物处理组的加药浓度,划痕实验结果显示LC-A 可以显著抑制结肠癌细胞SW620 的迁移和侵袭,但不呈浓度依赖性。Transwell 实验结果显示LC-A 显著抑制SW620侵袭,呈浓度依赖性。结肠癌细胞的迁移侵袭过程中,细胞外基质(ECM)与细胞之间相互作用。在各种ECM 蛋白分解过程中,基质金属蛋白酶家族(MMPs)起到重要作用。MMP-9是基质金属蛋白酶家族的重要一员,MMP-9通过降解基底膜的主要成分:Ⅳ型胶原蛋白,促进肿瘤细胞的迁移侵袭[5]。众多研究发现,结肠癌细胞中MMPs 过表达,尤其是MMP-9,所以,减少MMPs 的表达是一种可能的抗结肠癌途径[6]。本研究WB 实验结果显示,LC-A 明显抑制MMP-9 和MMP-2 的表达,且呈现特异性蛋白-1(浓度依赖性。各种转录因子[如激活蛋白-1(AP- 1)、NF- κB、Sp-1 )等]均调控MMP-9 和MMP-2 的基因表达[7]。通过WB 实验结果显示,LC-A可以明显下调NF- κB 信号通路TNF-α、COX2 等激活因子的表达。在结肠癌细胞中,NF-κB的持续激活,促进MMP-9和MMP-2等下游目的基因的高表达,这在结肠癌细胞的增殖、迁移侵袭中起到重要作用[8],抑制NF-κB的活性可能成为抗结肠癌的重要途径[9-10]。
综上,LC-A 通过抑制NF-κB 信号通路的激活抑制结肠癌SW620细胞的迁移侵袭,LC-A是一种潜在的治疗结肠癌的药物。
