细胞骨架相关蛋白PDLIM5 在人成纤维细胞内的定位及调控作用
2022-10-16黄小兰彭彦杨宇超樊庭宇孙冰AsmatUllahKhan戴景兴欧阳钧钟世镇
黄小兰,彭彦,杨宇超,樊庭宇,孙冰,Asmat Ullah Khan,戴景兴,欧阳钧,钟世镇
南方医科大学基础医学院人体解剖学教研室暨广东省医学生物力学重点实验室,广州 510515
干细胞作为骨组织工程中的重要种子细胞来源而备受关注,有研究表明人成纤维细胞(fibroblast)具有干细胞特性,可以重编程为诱导多能干细胞,然后分化为神经细胞、心肌细胞和造血干细胞等,在再生医学中作为理想的细胞种子来源而受到广泛的应用[1,2]。因此研究调控人成纤维细胞的生物学行为的相关调控分子具有重要意义。而细胞骨架相关蛋白PDLIM5,作为一个肌动蛋白细胞骨架衔接蛋白而受关注,它在参与形成特异性蛋白大分子复合物中发挥着重要的介导作用[3],而且细胞骨架作为细胞与胞外信号连接的桥梁,参与众多信号通路的转导,完整的细胞骨架是细胞内信号分子协同作用的基础[4]。已有相关研究报道PDLIM5 在心血管系统、神经系统,肿瘤等领域中作为重要的调节因子而发挥关键作用,但其在人皮肤成纤维细胞中扮演的角色还未完全阐明。因此,本研究旨在通过研究细胞骨架相关蛋白PDLIM5 对人成纤维细胞的调控作用及其细胞定位来探讨调控人成纤维细胞的可能相关调控因子,从而为临床应用于骨组织工程研究的种子细胞提供更多选择。
1 材料与方法
1.1 人皮肤成纤维细胞的培养
人皮肤成纤维细胞(HSFs)购自中乔新舟公司细胞库。取购回的人皮肤成纤维细胞,按照说明书用生长培养基重悬后接种于细胞培养皿中于37 ℃恒温、5% CO2的细胞培养箱内培养,待细胞融合度达80%~90%时进行传代培养。细胞培养液为全DMEM 培养液(含15% FBS、1% 双抗)。细胞用0.25% 胰酶-0.02% EDTA 消化传代。FBS、双抗购自Gibco 公司。
1.2 慢病毒介导的转导
为了下调PDLIM5,将PDLIM5 特异性短发卡RNA 包装成慢病毒(慢病毒来自上海吉凯)。为了感染靶细胞,病毒上清液在转导前在新鲜培养基中按照转染接种的细胞密度及试剂商提供的病毒浓度来计算所需感染细胞的病毒浓度,并添加病毒感染增强液P 液。感染前一天,将细胞消化后按7 000 个/cm²的密度接种板,于37 ℃培养16~24 h,至细胞汇合度为20%~30%。到第2 天,根据细胞MOI 及病毒滴度,加入相应病毒量及相应的感染增强液,混匀,继续培养。感染后12 h 用完全培养基进行换液,继续培养到72~96 h 后,显微镜下观察感染效果,选择感染效率达80%,且细胞生长良好的组用于后续实验。
1.3 蛋白免疫印迹实验
使用全蛋白提取试剂盒(购自凯基生物)提取总蛋白,使用10 % SDS-PAGE 分离蛋白,转至PVDF 膜,用5%牛奶封闭1 h,孵育一抗(GAPDH、PDLIM5,购自Abcam),4 ℃过夜,0.01%TBST 清洗3 遍后室温下孵育二抗2 h,0.01% TBST 清洗3 遍后,使用超敏ECL 发光液显色,蛋白化学发光图像分析仪进行。
1.4 qRT-PCR 实验
使用Trizol 试剂(美国Invitrogen)根据提供的说明进行操作,从细胞中提取总RNA。然后使用逆转录试剂盒(美国Thermo Fisher)进行逆转录后,进行实时聚合酶链反应,用荧光标记SYBR Green 试剂,使用针对PDLIM5 和GAPDH 的特异性引物用ABI Step One Plus 系统(美国Applied Biosystems)一式三份进行反应。GAPDH 用作内源性对照,通过ΔΔCt 方法计算不同基因转录本的相对表达。以下引物用于qRTPCR:PDLIM5,上游引物:5'‑ TTAGTGGCACTGGGG AAATC‑3'和下游引物:5'‑ GATCTTCCTTTGGCATC GA C‑3';GAPDH,上游引物:5'‑ TCGGAGTCAACGG ATTTGGT ‑3'和下游引物:5'‑ TTCCCGTTCTCAG CCTTGAC ‑3'。
1.5 细胞增殖实验(CCK8 检测)
PBS 将贴壁细胞清洗3 遍后换用无血清DMEM/F12 配制10%的CCK8(Cell CountingKit-8)工作液,将培养板在培养箱内孵育1 h,用酶标仪测定样品在450 nm 处的吸光度。
1.6 细胞划痕实验
取6 孔板,在板上做好分组标记。以1~4×105密度种板,以第2 天铺满为准,培养1 d。第2 天取出铺满6 孔板的细胞,用200 µL 枪头做划痕,然后弃掉旧的培养基,用PBS 冲洗细胞表面3 次,去除划下的细胞后,加入无血清培养基进行培养,分别于0、12、24、48 h 镜下观察细胞的运动能力并拍照。
1.7 细胞迁移实验
24 孔板上放入8.0 µm 孔径大小的小室(BD 公司),每小室加入100 µL 无血清培养液,将消化混匀重悬的细胞液200 µL(2.5×105/mL,无血清)加入小室内,下室加入750 µL 完全培养液,于37 ℃,5% CO2细胞培养箱内培养12~16 h 后,用PBS 冲洗2 次,4 %甲醛固定30 min,PBS 冲洗2 次,用结晶紫染色液(Solarbio 公司)染色30 min,PBS 冲洗2 次,用棉签轻轻刮去小室中未迁移的细胞,在显微镜下观察拍照细胞迁移情况。
1.8 免疫荧光染色
将培养于盖玻片上的HSFs 用DMEM 基础培养基洗涤3 遍后,置于4 %多聚甲醛中室温固定10 min,用PBS 洗涤3 遍。细胞在0.1 %Triton X-100 的PBS 溶液中室温通透5 min 后,PBS 洗涤3 遍,2 % BSA 封闭1 h 后加一抗于4 ℃过夜。将盖玻片用PBS 洗涤3 遍,每次10 min,分别与Alexa Fluor 488(1:500;碧云天)、Alexa Fluor 568 phalloidin(1:500;Themo)二抗孵育1 h后,PBS 洗涤3 遍,用4‘6-二胺基-2-苯基吲哚(DAPI)固定液(购自Santa Cruz)洗涤贴在玻片上,用共聚焦显微镜(Zeiss)成像。
1.9 统计学处理
除非特殊说明,所有实验重复3 次以上。采用GraphPad Prism5.0 软件进行统计学分析,采用t检验进行分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 PDLIM5 敲减效率验证
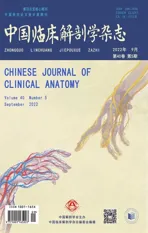
在人成纤维细胞中,感染了shPDLIM5 慢病毒组(实验组)、shScr组(空质粒对照组)的感染效达到80%~90%以上,提示病毒转染成功(见图1A)。慢病毒感染人成纤维细胞后,通过Western Blot 和RTqPCR 检测PDLIM5 表达水平。结果提示在感染shPDLIM5 后人成纤维细胞系的PDLIM5 蛋白及mRNA 水平均明显降低(图1B-C),提示下调PDLIM5表达有效,构建PDLIM5 表达下调的人成纤维细胞成功。
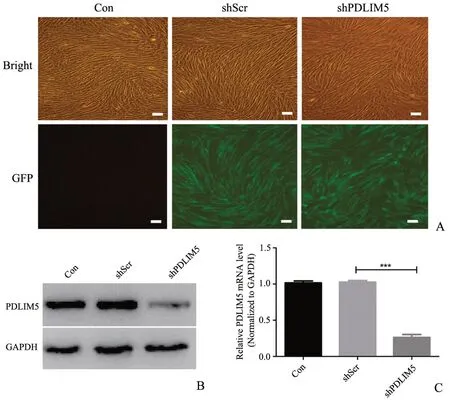
图1 慢病毒转染下调PDLIM5 表达效果验证A:病毒感染5 天后HSF 荧光强度B:慢病毒感染后的PDLIM5 的蛋白表达水平C:慢病毒感染后的PDLIM5的mRNA 表达水平Con组为空白对照,shScr组是空质粒对照组,shPDLIM5 是沉默了PDLIM5 的实验组,标尺为100 μm,***P<0.001Fig.1 Verification of down-regulation of PDLIM5 expression by lentivirus transfectionA: HSFs fluorescence intensity 5 days after virus infection; B: PDLIM5 protein expression level after lentivirus infection; C: mRNA level of PDLIM5 after lentivirus infectionCon: Blank control group; shScr: empty control group; shPDLIM5: experimental group of knock-down PDLIM5,Scale bar=100 µm,***P<0.001
2.2 下调PDLIM5 抑制人成纤维细胞的增殖
在人成纤维细胞系中下调PDLIM5 表达后,分别取0、1、2、3、4、5、6 d 的实验组和对照组细胞在加入CCK8 溶液后于450 nm 吸光度出测得CCK8 实验结果表明,实验组较对照组的OD 值低(图2),证实了细胞增殖明显受到抑制,差异具有统计学意义。
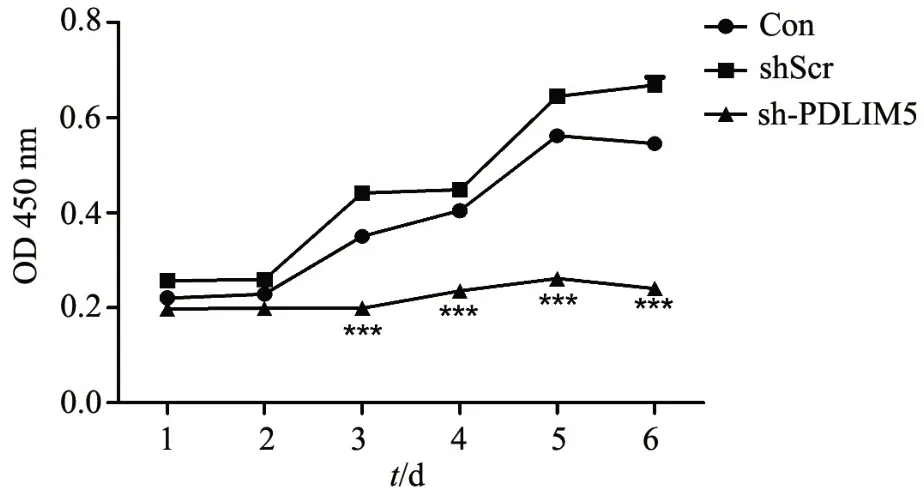
图2 下调HSFs 的PDLIM5 表达后,细胞增殖能力受到抑制 ***P<0.05, n=3Fig.2 Down-regulating of PDLIM5 inhibits HSFs proliferation,shPDLIM5,PDLIM5 expression down regulated ***P<0.001, n=3
2.3 下调PDLIM5 表达导致人成纤维细胞的运动、迁移能力下降
通过划痕实验检测下调PDLIM5 表达的人成纤维细胞的运动能力,结果表明,实验组(shPDLIM5)细胞的划痕愈合能力较对照组(shScr)明显下降(图3 A)。统计分析细胞划痕愈合面积显示,实验组细胞12、24、48 h 的划痕愈合面积较对照组显著减少(图3 B~D)。
图3 下调PDLIM5 表达的HSFs 划痕愈合实验结果情况A:实验组(shPDLIM5)与对照组(shScr)细胞划痕愈合能力比较 B-D: 12 h、24 h、48 h 后愈合面积的统计比较(***P<0.001,n=3,标尺为100 µm)Fig.3 Results of cell scratch assay of HSFs after knockdown of PDLIM5A: The cell scratch healing ability in the experimental group (shPDLIM5) and control group (shScr); B-D: The wound healing area 12 h,24 h,48 h after treatment,respectively (***P<0.001, n=3,scale bar=100 µm)
为了进一步证实上述结果,在人成纤维细胞中饥饿24h 后进行transwell 迁移实验,以阐明PDLIM5 基因抑制对细胞迁移的影响。结晶紫染色图像显示,小室下面shPDLIM5组细胞数量明显低于其他两个对照组(图4)。
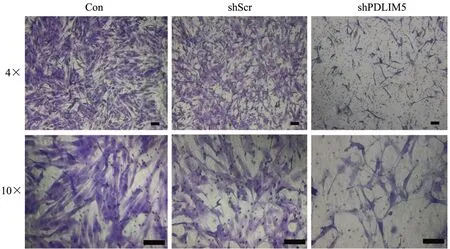
图4 Transwell 细胞迁移实验结果(标尺为100 µm)Fig.4 Results of Transwell cell migration experiment (bar=100 µm)
2.4 PDLIM5 在人成纤维细胞中与微丝共定位于细胞质
通过免疫荧光染色,观察到PDLIM5 在成纤维细胞中的位置。可以看到PDLIM5 在成纤维细胞中主要表达于细胞质,并且与肌动蛋白细胞骨架共定位(见图5)。

图5 PDLIM5 在HSFs 中的亚细胞定位荧光结果(标尺为10 µm)Fig.5 Fluorescence results of subcellular localization of PDLIM5 in HSFs (bar=10 µm)
3 讨论
成纤维细胞是由胚胎时期的间充质细胞分化而来,是结缔组织中最常见的细胞,成纤维细胞代谢旺盛、增殖能力强,具有合成和分泌蛋白质的功能,在不同微环境中可分化为不同细胞,拥有与干细胞接近的多向分化潜能,因此常运用于转分化、细胞培养、损伤修复以及组织工程,其中促进干细胞增殖及诱导分化的作用尤为显著[5,6]。早在2006年,Takahashi 团队通过将4 种转录因子(Oct3/4、Sox2、c-Myc 和Klf4)导入到小鼠成纤维细胞中,重编程获得了一种和胚胎干细胞相似的多能诱导的全能干细胞[7],随后又通过采用不同的转录因子将人皮肤成纤维细胞转化为诱导性多能干细胞,可以分化为软骨细胞、成骨细胞、脂肪细胞等[8]。因此,成纤维细胞具有应用于骨缺损及相关疾病治疗的潜能,而研究调控成纤维细胞的蛋白分子对进一步了解成纤维细胞的生物学特征具有重要意义。
细胞骨架相关蛋白PDLIM5 作为一个肌动蛋白细胞骨架支架蛋白,在参与细胞生物学功能的过程中发挥着不可或缺的作用。有研究表明,PDLIM5 被认为是通过形成片状伪足在细胞迁移中必须的,并且PDLIM5 的磷酸化失活可通过灭活Rac1 来削弱细胞转移能力[9]。此外,PDLIM5 参与成纤维细胞中的细胞伸展过程,是细胞伸展形成中的靶蛋白之一,下调PDLIM5 可减少扩展中肌动蛋白丝的组装[10]。本实验通过慢病毒转染包装技术,利用针对缺失PDLIM5 靶基因的慢病毒载体转染整合至HSFs 上,从而达到在人成纤维细胞中下调PDLIM5 表达的目的,研究PDLIM5 对HSFs 生物学功能的影响。实验发现,在人成纤维细胞中下调PDLIM5 表达后,不仅抑制了HSFs的的增殖能力,还降低了HSF 的运动和迁移能力。这说明了PDLIM5 参与了成纤维细胞的生命活动过程,并且可能作为一个关键调控因子影响着细胞的生物学行。此外,实验结果表明,PDLIM5 与细胞骨架微丝共定位,随F-actin 整齐排列,而本课题组前期研究表明,通过对肌动蛋白聚合状态的调控,可以抑制或促进成纤维细胞的成骨分化[11]。我们猜测,PDLIM5作为细胞骨架衔接分子,对成纤维细胞生物行为的调控可能与肌动蛋白相关。
总之,本实验验证了细胞骨架相关蛋白PDLIM5对成纤维细胞生物学功能的调控,并且PDLIM5 与肌动蛋白微丝存在共定位。未来还需要研究PDLIM5对成纤维细胞多向分化能力的影响,尤其是在成骨分化方面探讨其与微丝的联系对成纤维细胞成骨分化能力的影响。