小檗碱对多囊卵巢综合征大鼠卵巢局部胰岛素抵抗的调控作用
2022-10-16张多加张明明王婷婷张春兰吴效科李慕白
张多加 张明明 王婷婷 张春兰 郭 滢 吴效科 李慕白
(1 黑龙江中医药大学附属第一医院妇一科,哈尔滨,150040; 2 黑龙江中医药大学,哈尔滨,150040)
多囊卵巢综合征(Polycystic Ovary Syndrome,PCOS)是一种妇科常见的内分泌代谢异常疾病,是导致患者无排卵性不孕的常见原因。研究显示超过70%的PCOS患者表现为胰岛素抵抗(Insulin Resistance,IR)和(或)高胰岛素血症[1]。尽管肥胖被普遍认为是IR的重要促成因素,但有研究显示,患有PCOS的肥胖女性和非肥胖女性均可伴有胰岛素敏感性降低[2]。高胰岛素血症和胰岛素抵抗同样可引起PCOS患者生殖内分泌紊乱[3]。一项在全国22家医疗分中心收集1 000例不育的PCOS患者的大样本流行病学调查显示,血清空腹胰岛素及稳态模型胰岛素抵抗指数(Homeostatic Model Assessment for Insulin Resistance,HOMA-IR)水平与经过促排卵诱导的PCOS患者的生育结局密切相关,并认为血清胰岛素水平可预测PCOS患者的包括排卵、受孕、妊娠及活产率等生育结局,主要研究结果发表在美国JAMA杂志上[4-5]。研究显示,卵泡内过量的雄激素,具有阻碍优势卵泡发育的作用[6]。另外,伴有IR的PCOS患者窦卵泡生长显示受阻[7]。高胰岛素血症和IR主要通过干扰卵泡发育,导致PCOS排卵功能障碍。
小檗碱(Berberine),又称黄连素,含多种异哇琳类生物碱,归中焦脾胃经,具有清热燥湿的作用,可有效增加胰岛素敏感性,改善胰岛素抵抗。宋代《太平圣惠方》中治疗消渴病的177首方剂常用的10味药,黄连就居于前3味。系统评价中药单体小檗碱对PCOS女性生殖内分泌和代谢的影响的研究发现,虽然没有确凿的证据表明小檗碱可以提高PCOS妇女的活产率或妊娠率,但认为小檗碱有助于恢复正常的内分泌和生育能力[8-9]。同时发现,在改善IR方面,小檗碱与二甲双胍作用相似,而在改善体脂分布、降低雄激素水平及改善血脂方面,小檗碱优于二甲双胍;与安慰剂和不治疗比较,小檗碱与降低黄体生成素(Luteinizing Hormone,LH)水平相关,且和二甲双胍比较,在降低LH/促卵泡素(Follicle Stimulating Hormone,FSH)水平方面有显著优势[9]。十一五“科技支撑计划”项目在全国19个分中心收集880例PCOS患者,以小檗碱、来曲唑进行随机双盲对照试验,观察排卵率、妊娠率、活产率等妊娠结局,首次发现小檗碱治疗PCOS的6个月活产率为22%(44/214),小檗碱联合来曲唑的疗效达到34%(74/215),疗效水平类似现代医学一线促排卵药物枸橼酸氯米芬。研究成果发表在Lancet和Fertil Steril上[10-11]。有研究表明,PCOS患者服用小檗碱3个月后,全身胰岛素抵抗有所改善[12]。与二甲双胍比较,小檗碱有助于恢复PCOS妇女的生殖内分泌水平和生育能力,并且不良反应更少,因此,小檗碱似乎是用于改善PCOS患者生殖代谢紊乱和增强生育能力的有效且安全的药物[9]。
小檗碱对于PCOS的治疗靶点在于单磷酸AMP活化蛋白激酶(Adenine Monophosphate Activated Protein Kinase,AMPK)[13-15],但是并不清楚其对胰岛素信号通路的调控机制,因此,本实验基于AMPK/哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)通路研究小檗碱对PCOS卵巢局部胰岛素信号通路转导障碍的改善,同时从生殖内分泌、卵巢组织形态学方面的变化,探究小檗碱改善卵巢局部IR的机制。
1 材料与方法
1.1 材料
1.1.1 动物 选取60只清洁型雌性Sprague-Dawley(SD)大鼠,6~7周龄,体质量160~170 g,由哈尔滨光大动物养殖中心提供,生产许可证号码:SCXK9(黑)2018-003。饲养条件保持在18~22 ℃的室温和50%~60%的湿度下,在无特定病原体(Specific Pathogen Free,SPF)环境中,12 h暗/光周期。所有大鼠都随意接受正常食物和自来水。所有实验程序均经黑龙江中医药大学动物护理和使用委员会批准(伦理审批号:2019061801)。
1.1.2 药物 盐酸小檗碱片(东北制药集团沈阳第一制药有限公司,批号:2190612);盐酸二甲双胍片(格华止)(中美上海施贵宝制药有限公司,批号:H20023370);生物合成人胰岛素注射液(诺和灵,诺和诺德公司,丹麦,批号:J20171005);注射用绒促性素(丽珠集团丽珠制药厂,批号:200309)。
1.1.3 试剂与仪器 酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)检测试剂盒大鼠胰岛素(Insulin,INS,货号:DECO3003)、总睾酮(Testosterone,T,货号:DECO2994)、雄烯二酮(Androstenedione,ASD,货号:DECO2996)、17α-羟孕酮(17α-hydroxyprogesterone,17α-OHP,货号:DECO2998)、黄体生成素(LH,货号:DECO2410)、促卵泡素(FSH,货号:DECO2320)、性激素结合球蛋白(Sex Hormone Binding Globulin,SHBG,货号:DECO2771)ELISA试剂盒均购自上海舜冉生物科技有限公司,兔抗大鼠磷酸化哺乳动物雷帕霉素靶蛋白丝氨酸-2481(pSer2481-mTOR)单克隆抗体(货号:ab137133)、兔抗大鼠磷酸化AMP活化蛋白激酶苏氨酸-172α(α-pT172-AMPK)单克隆抗体(货号:2535T)、兔抗大鼠糖原合酶激酶3β(Glycogen Synthase Kinase3β,GSK3β)单克隆抗体(货号:8885T)均购自美国Cell Signaling Technology公司,兔抗大鼠磷酸化蛋白激酶B丝氨酸-473(Phospho-Ser473-protein Kinase B,pSer473-AKT)单克隆抗体(Abcam公司,英国,货号:ab81283),实时荧光PCR试剂盒(KAPA Biosystems公司,南非,货号:KK4601)。光学显微镜(NIKON公司,日本,型号:Eclipse ci),离心机(赛默飞公司,美国,型号:Sorvall ST 40,SCILOGEX),生化分析仪(迈瑞公司,型号:BS200),酶标分析仪(Tecan公司,瑞士,型号:Infinite F50),SDS电泳仪(Bio-rad公司,美国,型号:042BR13724),包埋机武汉俊杰电子有限公司,型号:JB-P5),凝胶成像系统(Bio-Rad公司,美国,型号:Universal hood II),StepOne Plus实时定量聚合酶链式反应仪(ABI公司,美国,型号:ABI7500)。
1.2 方法
1.2.1 分组与模型制备 SD大鼠适应性喂养1周后,采用随机数字表法随机分为空白组(15只)和PCOS模型组(45只)。PCOS模型组大鼠从造模第1天起,颈背部皮下注射胰岛素(Insulin,INS)0.5 IU,1次/日,此后每日递增0.5 IU,递增至6.0 IU/d后,保持该注射剂量至造模结束;造模第14天起,每只大鼠皮下注射人绒毛膜促性腺激素(Human Chorionic Gonadotropin,HCG)6 IU/d,2次/d(上午、下午各3 IU/次),至造模结束,共9 d。空白组每日给予普通饲料喂食,颈背部皮下注射等剂量生理盐水,共22 d。
1.2.2 给药方法 采用随机数字表法将PCOS模型组大鼠随机分为模型组(15只)、小檗碱组(15只)、二甲双胍组(15只)。小檗碱组给予小檗碱混悬液灌胃(170 mg/kg·d);二甲双胍组给予二甲双胍混悬液灌胃(200 mg/kg·d);空白组和模型组每日给予等体积生理盐水灌胃。各组均连续灌胃31 d。
1.2.3 检测指标及方法
1.2.3.1 大鼠动情周期检测 造模结束后,随机选取大鼠进行阴道涂片,观察阴道上皮角化程度,连续观察3个动情周期。
1.2.3.2 口服葡萄糖耐量试验(Oral Glucose Tolerance Test,OGTT) 用药干预结束后,各组大鼠禁食12 h后,空腹采血,之后口服3 g葡萄糖,并开始计时,分别于服糖后60 min、120 min、180 min分别采血,检测血清葡萄糖水平。
1.2.3.3 大鼠血清性激素和糖脂代谢水平检测 用药干预结束后,所有大鼠禁食12 h,次日清晨对动情周期处于间期的大鼠进行眼眶静脉取血,分离血清,于-80 ℃冰箱中储存。之后断颈处死各组大鼠。计算HOMA-IR:HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(Fasting Insulin,FINS)(mIU/L)/22.5。使用生化分析仪检测血清中三酰甘油(Triacylglycerol,TG)、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)、高密度脂蛋白胆固醇(High Density Lipoprotein Cholesterol,HDL-C)和总胆固醇(Total Cholesterol,TC)水平。采用ELISA法检测大鼠血清中FINS、LH、FSH、T、ASD、17α-OHP和SHBG水平,严格按照试剂盒说明书操作。
1.2.3.4 苏木精-伊红(Hmatoxylin-eosin,HE)染色法检测大鼠卵巢组织形态学变化 摘取各组大鼠卵巢组织,一侧卵巢于液氮中静置30 min后,于-80 ℃冰箱保存,另一侧卵巢以甲醛固定液固定,常规石蜡包埋,切片。空白组、模型组、小檗碱组和二甲双胍组4组卵巢组织切片中每张切片挑选3个100倍视野对卵泡进行截图,于光学显微镜下观察。截图时保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件以100倍标尺为标准,选取合适的视野,每张图片分别测量卵泡5处颗粒层厚度(mm)并计算出平均值。
1.2.3.5 卵巢组织相关靶基因蛋白表达检测 以蛋白质印迹法(Western Blotting,WB)检测卵巢组织α-pT172-AMPK、pSer2481-mTOR、pSer473-AKT、GSK3β蛋白表达水平。将卵巢组织进行蛋白提取、裂解,得到总蛋白产物,进行蛋白含量测定、配胶、电泳、转膜,洗涤后封闭2 h;加入一抗,孵育过夜;次日用洗涤缓冲液(Tris Buffered Saline Tween,TBST)洗涤后加入二抗,孵育40 min;充分洗涤后,化学发光,显影,使用凝胶图像处理系统分析灰度值,其结果用待测蛋白与内参β-actin的灰度值比值表示。
1.2.3.6 卵巢组织葡萄糖转运蛋白4 mRNA表达检测 实时荧光聚合酶链式反应法(Polymerase Chain Reaction,PCR)检测卵巢组织中葡萄糖转运蛋白4(Glucose Transporter 4,GLUT4)mRNA的表达。取冻存的卵巢组织进行总RNA提取、电泳、反转录,使用ABI 7500荧光定量PCR仪、采用2-△△Ct法进行数据的相对定量分析。引物信息见表1。

表1 引物序列表
2 结果
2.1 动情周期比较 造模结束后,光镜下观察大鼠阴道涂片,可见阴道上皮细胞持续处于以大量白细胞为主的动情间期,提示造模后大鼠动情周期紊乱,PCOS大鼠造模成功。药物干预后,小檗碱组和二甲双胍组大鼠动情周期恢复。
2.2 各组大鼠卵巢组织形态学变化观察 镜下可观察到,空白组大鼠卵巢可见各发育时期的卵泡,颗粒细胞形态完整,排列整齐;与空白组比较,模型组大鼠卵巢各级发育期卵泡明显消退,卵泡颗粒细胞层厚度明显减少(P<0.05),囊性扩张卵泡和闭锁卵泡数量明显增加;与模型组比较,小檗碱组和二甲双胍组大鼠卵巢中可见各发育时期的卵泡,卵泡颗粒细胞层厚度明显增加(P<0.01,P<0.05),囊性扩张卵泡和闭锁卵泡数量明显减少。见图1,表2。

表2 各组大鼠卵巢卵泡颗粒细胞层厚度比较
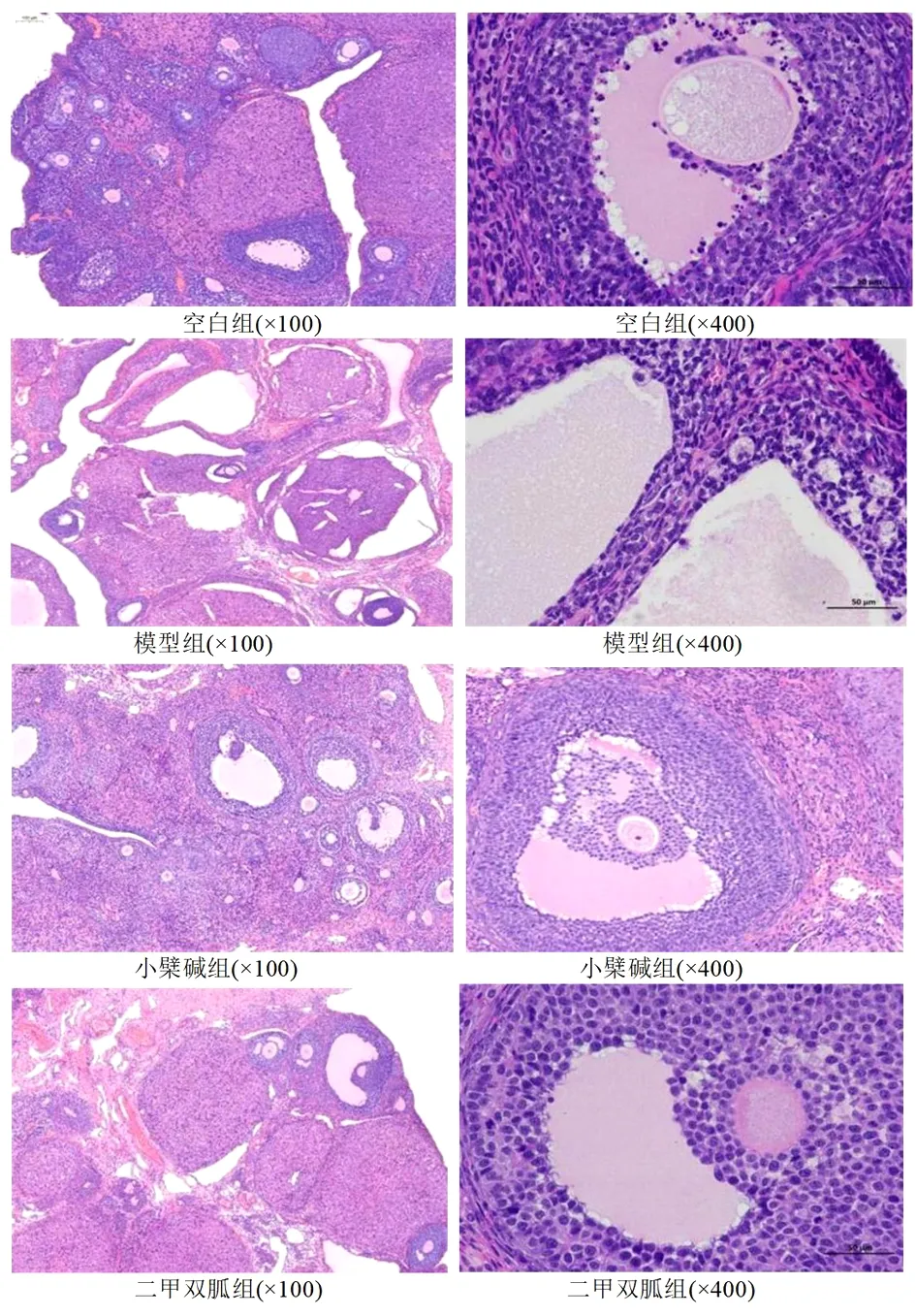
图1 各组大鼠卵巢组织形态学变化比较(HE染色)
2.3 各组大鼠血清性激素水平的比较 与空白组比较,模型组大鼠血清性激素中T、LH、LH/FSH、17α-OHP、ASD水平显著升高,SHBG水平显著下降,差异均有统计学意义(均P<0.01);与模型组比较,小檗碱组大鼠血清性激素中T、LH、LH/FSH、17α-OHP、ASD水平显著降低,SHBG水平显著升高,差异均有统计学意义(均P<0.01);与模型组比较,二甲双胍组T水平下降(P<0.05),LH、LH/FSH、17α-OHP、ASD水平明显下降(均P<0.01),SHBG水平显著升高(P<0.01);与二甲双胍组比较,小檗碱组LH和ASD水平显著降低,SHBG水平显著升高,差异均有统计学意义(均P<0.01)。见表3。
表3 各组大鼠血清性激素水平比较
2.4 各组大鼠糖脂代谢水平的比较
2.4.1 各组糖代谢水平比较 与空白组比较,模型组OGTT试验各时段血糖水平、FINS和HOMA-IR水平显著升高(P<0.05,P<0.01);与模型组比较,小檗碱组和二甲双胍组OGTT试验各时段血糖水平、FINS和HOMA-IR水平显著降低(P<0.05,P<0.01)。见表4。
表4 各组大鼠糖代谢水平比较
2.4.2 各组脂代谢水平比较 与空白组比较,模型组血清TG、LDL-C、TC水平明显升高,差异有统计学意义(P<0.01),HDL-C水平明显降低,差异有统计学意义(P<0.01);与模型组比较,小檗碱组和二甲双胍组血清TG、LDL-C、TC水平明显降低,差异有统计学意义(P<0.01);与二甲双胍组比较,小檗碱组无统计学意义(P>0.05)。见表5。
表5 各组大鼠血脂水平比较
2.5 各组大鼠卵巢组织靶基因蛋白表达比较 与空白组比较,模型组大鼠卵巢组织AMPK的Thr 172位点和AKT的Ser473位点磷酸化水平显著降低,mTOR的Ser2481位点磷酸化水平和GSK3β蛋白表达水平显著升高,差异有统计学意义(P<0.01);与模型组比较,小檗碱组大鼠卵巢组织AMPK的Thr 172位点和AKT的Ser473位点磷酸化水平显著升高,mTOR的Ser2481位点磷酸化水平和GSK3β蛋白表达水平显著降低,差异有统计学意义(P<0.01)。见图2~3。
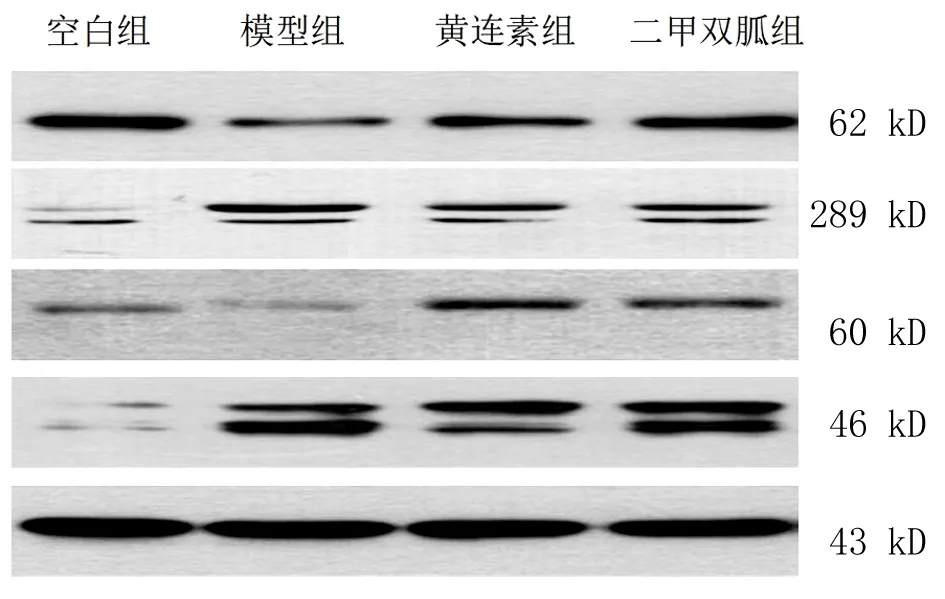
图2 各组卵巢组织靶蛋白表达情况
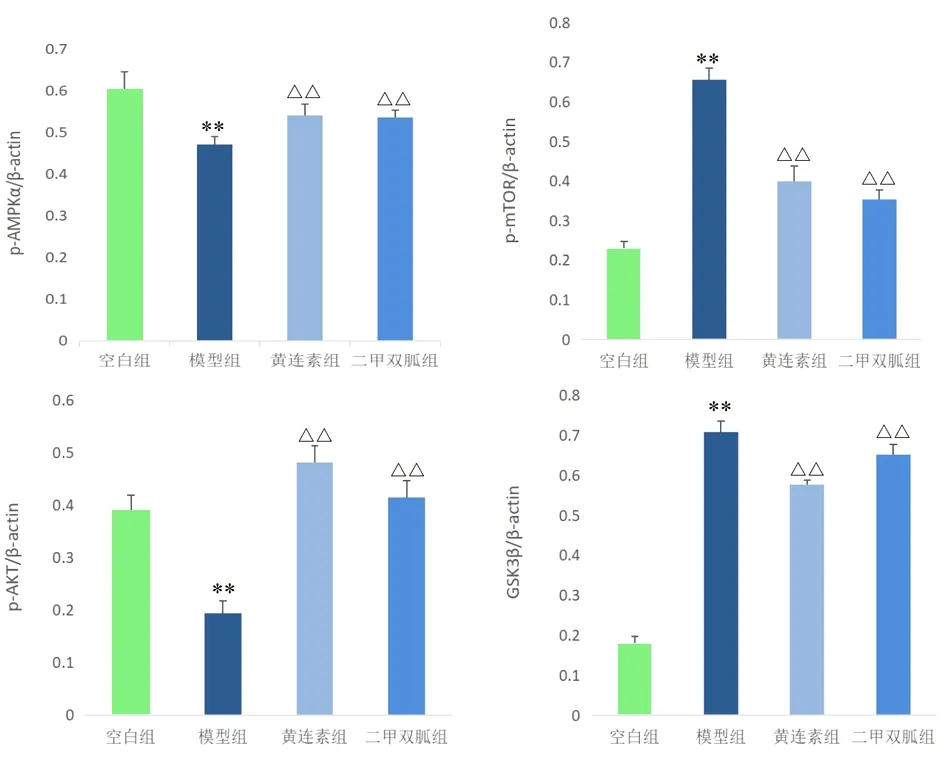
图3 各组大鼠卵巢组织中靶蛋白表达水平比较
2.6 各组大鼠卵巢组织GLUT4 mRNA表达水平比较 与空白组比较,模型组大鼠卵巢组织中GLUT4 mRNA表达水平明显降低,差异有统计学意义(P<0.01);与模型组比较,小檗碱组和二甲双胍组大鼠卵巢组织中GLUT4 mRNA表达水平明显升高,差异均有统计学意义(均P<0.01)。见图4。
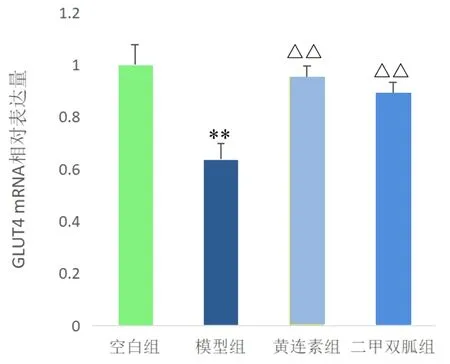
图4 各组大鼠卵巢组织中GLUT4 mRNA表达水平比较
3 讨论
本研究采用了INS联合HCG法成功制备PCOS大鼠模型,与Poretsky等[16]和Yang等[17]的造模结果相似,PCOS组大鼠出现动情周期延长;生殖内分泌紊乱;胰岛素抵抗和高胰岛素血症,糖脂代谢障碍;光镜下观察到卵巢形态结构的改变。而在采用小檗碱或二甲双胍治疗后,上述状态得以纠正。
3.1 小檗碱恢复PCOS大鼠卵巢卵泡形态学发育 本研究中,应用小檗碱治疗后,卵巢正常卵泡发育形态学得到恢复。卵巢组织中各级发育期卵泡复现,囊性扩张卵泡消退,卵泡颗粒细胞厚度明显增厚。卵巢局部的高雄激素及高胰岛素环境可明显干扰卵泡的正常发育。既往研究表明,卵巢局部高雄激素水平可干扰卵泡的生长和发育[18],降低颗粒细胞之间的连接,损害卵泡生长[7]。而胰岛素对卵泡的生长发育同样起重要作用。过量的胰岛素,可导致颗粒细胞分化紊乱,卵泡的发育停止[19]。高胰岛素水平还可导致游离胰岛素样生长因子-1(Insulin-like Growth Factor 1,IGF-1)水平升高[20],高水平的游离IGF-I可下调卵泡液中游离IGF-2的水平[21],从而不能促进颗粒细胞的增殖和FSH诱导雌激素产生[22]。在本研究中,小檗碱调节卵巢局部胰岛素信号通路的转导,改善卵巢局部高胰岛素及高雄激素水平,故而恢复颗粒细胞增殖,促进卵泡发育,恢复了卵巢的正常组织形态。
3.2 小檗碱改善PCOS大鼠生殖内分泌紊乱 本研究结果显示,应用小檗碱治疗后,PCOS大鼠T、ASD和17α-OHP高水平状态有所恢复。这表明,小檗碱具有降雄作用,可能是由于小檗碱改善了胰岛素信号通路转导障碍,从而改善胰岛素敏感性的原因。有研究发现,胰岛素是导致卵巢雄激素分泌增加的原因,胰岛素可协同LH,刺激卵泡膜细胞中17α-羟化酶/17,20裂解酶(17α-hydroxylase/17,20 Lyase,CYP17)的表达,导致卵巢产生过量的雄激素[23]。PCOS患者体内,高水平胰岛素可直接刺激卵巢分泌过量雄激素[24],研究显示采用胰岛素增敏剂二甲双胍治疗后,高胰岛素水平降低的同时,高雄激素水平也得到改善[25]。17α-OHP是合成ASD和T的前体物质[26],较高水平的17α-OHP代表合成更多的ASD以及T,导致更严重的雄激素水平升高[27]。本研究认为,小檗碱降低了PCOS大鼠空腹胰岛素和血清LH水平,因而改善了卵巢局部17α-OHP、ASD以及T的过多生成。另外,应用小檗碱后,PCOS大鼠的血清LH水平下降,这与小檗碱对PCOS女性生殖内分泌和代谢影响的系统评价相一致,研究显示,与安慰剂和不治疗比较,小檗碱与降低LH水平相关,与二甲双胍比较,在降低LH/FSH水平方面有显著优势[8]。我们认为下丘脑胰岛素抵抗与LH的过量分泌有关。位于下丘脑弓状核的吻肽(Kisspeptin,Kp)神经元细胞分泌的Kp多肽类激素,其靶器官是下丘脑的促性腺激素释放激素(Gonadotrophic Releasing Hormone,GnRH)神经细胞,是GnRH和LH脉动释放的关键调节剂[28]。研究显示合并月经稀发的PCOS患者血清Kp浓度及脉冲频率均明显增高[29]。Kp与糖代谢途径息息相关。胰高血糖素样肽-1(GLP-1)显著增加GT1-7 GnRH的神经元和胎鼠脑的原代培养物中Kisspeptin-1 mRNA的表达[30]。健康人静脉注射Kp可促进静脉葡萄糖负荷后胰岛素分泌,并调节血清代谢物。与此相一致,在体外人类胰岛细胞的培养中加入不同浓度的Kp,可剂量依赖地增强胰岛B细胞胰岛素的分泌[31]。我们认为,小檗碱改善血清高胰岛素水平,调节下丘脑胰岛素抵抗状态,故而降低了PCOS大鼠的LH水平。
3.3 小檗碱改善PCOS大鼠糖脂代谢紊乱 采用小檗碱治疗后的PCOS大鼠糖脂代谢紊乱得到纠正。结果显示,小檗碱可明显降低OGTT试验各时段血糖水平和HOMA-IR水平,这可能与小檗碱的作用通路有关。多项研究认为小檗碱以AMPK为作用靶点[13-15]。有研究指出,小檗碱通过AMPK和促分裂原活化的蛋白激酶(Mitogen Activated Protein Kinase,MAPK)通路刺激在大鼠骨骼肌中葡萄糖的摄取,从而降低血糖水平[32]。还有研究已证实AMPK磷酸化后,可以促进糖酵解、抑制糖异生,增加组织细胞对葡萄糖的代谢及胰岛素敏感性[33]。本研究的结果证实,小檗碱通过调节AMPK的活性后,对磷脂酰肌醇-3-激酶(PhosphatidyLinositol-3-kinase,PI3K)蛋白激酶B/蛋白激酶B(AKT)胰岛素信号通路具有调控作用,改善其转导障碍,恢复下游GLUT4的表达,改善糖代谢。
研究显示,PCOS患者血脂异常患病率高达76.1%[34]。当PCOS发生胰岛素抵抗时,脂肪组织中脂肪分解受到抑制[19]。胰岛素可抑制三酰甘油脂肪酶(脂质动员的关键限速酶)的激活,导致脂质动员和三酰甘油合成增加[35]。研究发现小檗碱可通过c-Jun氨基末端激酶(c-jun N-terminal Kinase,JNK)途径,降低血清LDL[36],或激活AMPK[37],抑制人类肝细胞的脂质合成,从而改善脂代谢。本研究中,小檗碱可增强胰岛素敏感性,激活AMPK,改善脂代谢,降低血脂水平。
3.4 小檗碱改善PCOS大鼠卵巢局部胰岛素信号通路的转导 通过小檗碱治疗后,PCOS大鼠卵巢局部胰岛素信号通路转导障碍得到调控,改善局部胰岛素抵抗,有效地促进了葡萄糖代谢。与Zhang等[38]的研究结果有类似之处,该研究通过来曲唑制造PCOS大鼠模型,对卵巢组织中PI3K、AKT和GLTU4蛋白水平进行检测,发现应用小檗碱后,PI3K、AKT和GLTU4蛋白水平显著升高。但小檗碱改善卵巢局部PI3K/AKT转导障碍的机制尚不清楚。我们认为,小檗碱的作用靶点为AMPK基因。有研究表明,AMPK能够通过结节性硬化症复合物肿瘤抑制基因2(Tuberous Sclerosis Complex tumor suppressor gene 2,TSC2)tuberous sclerosis complex 2 tumor suppressor gene(TSC2),从而抑制mTOR的表达[39]。胰岛素抵抗与mTOR活性增加相关[40]。研究发现,饮食诱导的IR动物模型的骨骼肌和肝脏中mTOR呈异常激活状态[41]。mTOR活化后可磷酸化其下游分子核糖体蛋白S6激酶1(Ribosomal-protein S6 Kinase,S6K1),进而可导致胰岛素受体底物(InsulinReceptor Substrates,IRS)-1磷酸化水平升高,抑制下游的PI3K与IRS-1的结合[42-43],减弱AKT蛋白的激活,影响PI3K/AKT信号通路的转导[44]。同样,AKT磷酸化减少,增加GSK3β蛋白的表达,促进糖原合成酶(Glycogen Synthetase,GS)磷酸化而抑制糖原合成[45]。本研究中,应用小檗碱后,卵巢局部AMPK被激活,mTOR活性受到抑制,AKT的Ser473磷酸化水平升高,GSK3β蛋白表达水平下降,GLUT4表达明显增加,说明小檗碱通过AMPK/mTOR途径调控胰岛素信号通路转导。
本研究结果显示,小檗碱恢复PCOS大鼠生殖内分泌状态,改善高胰岛素血症,调节糖脂代谢水平,恢复卵巢正常形态,究其原因,可能与小檗碱作用于AMPK/mTOR靶点,调控了卵巢局部胰岛素信号PI3K/AKT/GLUT4通路的转导障碍有关,故改善卵巢局部胰岛素抵抗,纠正了卵巢局部的卵泡发育障碍及性激素分泌异常。
