藏药波棱瓜子壳总甾醇对四氯化碳诱导的小鼠肝损伤的保护作用及其主要成分的含量测定*
2022-10-15朱民强刘文亚
刘 峰,朱民强,刘文亚**
(1.安徽省滁州市第二人民医院 滁州 239000;2.南京理工大学环境与生物工程学院 南京 210094)
藏药波棱瓜子壳是葫芦科植物波棱瓜(Herpetospermum caudigerumWall.)的干燥成熟果壳,《迪庆藏药》记载波棱瓜果壳味极苦,其功效同波棱瓜子[1]。临床上波棱瓜子常用来治疗多种肝炎、胆囊炎疾病[2],其主要成分总木脂素具有对抗多种化学性肝损伤的作用[3-5]。然而,对于波棱瓜子壳是否有抗肝损伤效果尚未报道。本课题组前期研究发现,波棱瓜子壳中几乎不含木脂素类,而含有丰富的总甾醇(Total Sterols fromHerpetospermum caudigerumWall.Shell,HCSTS)。因此,本研究探究了HCSTS对肝损伤的保护作用。
近年来,研究表明植物甾醇具有明显的抗炎、抗肿瘤作用[6-9],如α-菠甾醇不依赖于肾上腺垂体系统能明显抑制小鼠热烫肿[10],β-谷甾醇有抗炎和解热活性[11],豆甾三烯醇通过抑制NF-κB能减缓受损肝细胞向肝纤维化和肝癌方向发展[12]。此外,颜宁等[13]利用冷冻电镜技术揭示了甾醇类化合物在SREBP途径中的传感机制,而SREBP参与抗炎脂肪酸的生物合成又与TLR4配体激活相关[14]。这些研究表明,不同的甾醇发挥抗炎的机制不同。因此,定量分析HCSTS中的主要成分,对于揭示抗肝损伤机制显得尤为重要。然而,甾醇类极性小、种类多,且紫外吸收较弱,对定性和定量分析都造成了巨大挑战。文献上多记载用GC-MS[15]或柱前衍生[16]的方法进行分析,鲜有用HPLC结合PDA检测器在C18柱上直接定量分析。并且,值得注意的是,由于植物样品复杂的基质干扰,需对所开发方法的专属性进行进一步验证,才能使定量更加准确。
因此,本研究首次对HCSTS抗四氯化碳(CCl4)诱导小鼠肝损伤作用进行了探究,结合病理切片、生化分析、炎症相关指标转录水平检测等,初步探讨了其作用机制。然后,对于HCSTS中的主要甾醇,开发一种无衍生、无皂化、方便快捷的HPLC分析方法,结合灵敏度更高的超高效液相色谱串联质谱(Ultra-high performance liquid chromatography-tandem mass,UHPLC-MS/MS)进一步验证了色谱方法的专属性。此方法重复性好、专属性强,为HCSTS进一步开发利用提供了理论基础。
1 实验材料与仪器
1.1 实验动物
60只SPF级雄性ICR小鼠(体质量20±2 g)购自南京市青龙山繁育场,生产许可证编号SCXK(浙)2019-0002,动物质量合格证编号:No.410000000000001134。将小鼠饲养于不锈钢笼盒中,饲养室环境保持良好通风,室温为25±2℃,相对湿度为50±10%,12 h光照和12 h黑暗循环。动物实验程序均按照南京理工大学动物伦理委员会(ACUC-NJUST-20180409)提供的指南进行。
1.2 仪器与试药
高效液相色谱仪CTO-20AT,配有一个InertSustain C18色谱柱(4.6×250 mm,5 µm)均购于日本岛津公司;Triple TOF 5600+质谱系统(AB SCIEX,USA)配备一个ExionLC(AB SCIEX,USA)超高效液相色 谱 仪 (Ultra High Performance Liquid Chromatography,UPLC)用于HCSTS一级(TOF MS)和二级(TOF MS/MS)质谱数据的采集。电子天平(精度为0.0001 g)型号为AR224CN(奥豪斯仪器);NIKON ECLIPSE Ti2倒置显微镜购于日本尼康公司;7,22,25-豆甾三烯醇和α-菠甾醇为实验室自制,经核磁氢谱、碳谱、高分辨质谱以及文献数据比对鉴定。HCSTS为实验室自制,其植物来源—波棱瓜子壳采自西藏自治区林芝地区。丙氨酸氨基转移酶(Alanine transaminase,ALT)和天冬氨酸氨基转移酶(Aspartate transaminase,AST)试剂盒均购自南京建成生物工程研究所;组织固定液(中性,500 mL)购于武汉赛维尔生物科技有限公司。实时荧光定量PCR(quantitativereal time-reverse transcription,qRT-PCR)型号为ABI 7300 Real Time PCR System,相关引物序列信息如下:β-actin上游引物5-GTGACGTTGACATCCGTAAAGA-3’,下游引物5’-GCCGGACTCATCGTACTCC-3’;IL-1β上游引物5’-GCAACTGTTCCTGAACTCAACT-3’,下 游 引 物5’-ATCTTTTGGGGTCCGTCAACT-3’;IL-6上游引物5’-CTGCAAGAGACTTCCATCCAG-3’,下 游 引 物5’-AGTGGTATAGACAGGTCTGTTGG-3’;IL-10上游引物5’-CTTACTGACTGGCATGAGGATCA-3’,下游引物5’-GCAGCTCTAGGAGCATGTGG-3’;COX-2上游引物5’-TACCCTCCTCACATCCCTGA-3’,下游引物5’-CCTGCTTGAGTATGTCGCAC-3’,引物由南京擎科生物科技有限公司协助合成。Trizol试剂购于上海碧云天生物技术有限公司,逆转录酶购于加拿大abm公司,KAPA SYBR®快速荧光QPCR试剂盒购于Kapa Biosystems Pty(Ltd),RNase Free ddH2O购于北京索莱宝公司。高效液相色谱用甲醇为色谱级,CCl4购于天津科密欧,水飞蓟素(Silymarin,SIL,货号S25549-25g)购于上海源叶生物科技有限公司,无水乙醚购于国药集团,药用级橄榄油购于上海阿拉丁生物科技股份有限公司,其余试剂均为分析纯。
2 实验方法
2.1 动物分组、给药与CCl4诱导肝损伤模型的建立
在实验室环境中适应驯养一周后,60只雄性ICR小鼠被随机分为6组,每组10只。分别是空白组(CON)、肝损伤模型组(MODEL)、水飞蓟素阳性药组(SIL,50 mg·kg-1,bw),HCSTS低剂量组(LD,10 mg·kg-1,bw)、中剂量组(MD,20 mg·kg-1,bw)和高剂量组(HD,50 mg·kg-1,bw),其中SIL组剂量参考文献[17]设置,HCSTS的低、中、高剂量参考文献中α-菠甾醇的量[18]设置。SIL和HCSTS混悬于0.5%的CMC-Na溶液中,在整个实验过程中,所有小鼠均喂食相同的饲料和灭菌饮用水。各组小鼠于每天早上10点连续灌胃给 药7天(灌 胃 体 积 为0.1 mL/10g,bw),CON和MODEL组则在相同的时间点灌以不含药物的CMCNa溶液。第7天给药2 h后,除CON组外的其他组均腹腔注射(10 mL·kg-1,bw)0.3% CCl4-橄榄油(v/v)溶液[19],诱导急性肝损伤,CON组给以等体积的橄榄油。
2.2 血液收集生化分析
造模后,禁止饮食,让其自由饮水。24 h后,用脱脂棉蘸取适量乙醚在封闭的玻璃缸中实施麻醉,麻醉后,以摘眼球取血方式采集每只小鼠约0.5 mL全血于干净的EP管中。将全血于4℃静置2 h后,3000 r·min-1离心20 min,取血清,按照试剂盒中的指导方法,测定血清中ALT和AST的活力水平。
2.3 肝组织采集及病理检查
各组小鼠取完血后,脱颈处死。随机挑选每组3只小鼠,取肝脏小叶部分同一位置,用生理盐水冲洗表面血液。置于组织固定液中24 h,常规石蜡包埋、切片,经苏木精-伊红(H&E)染色后,置于显微镜下观察,采集图像并分析。
2.4 qRT-PCR测定IL-1β、IL-6、IL-10和COX-2转录水平
2.4.1 各组肝组织总RNA提取以及mRNA逆转录成cDNA
根据Trizol试剂盒指导方法提取各组肝组织总RNA,用微量紫外分光光度计对其浓度(OD260)和纯度(OD260和OD280的比值)进行测定。然后对各个样品的RNA(1µg·µL-1)进行逆转反应。具体步骤为:加入逆转录酶2 µL,RNase Free ddH2O 8 µL。逆转录程序:25℃,10 min;42℃,15 min;85℃,5 min;将得到的cDNA置于-20℃保存,以备qRT-PCR用。
2.4.2 qRT-PCR实验
取KAPA SYBR®快速荧光QPCR试剂5 µL,上游引物和下游引物各1 µL,模板(cDNA溶液)2 µL,RNase Free ddH2O 1 µL,反应条件如下:95℃预变性3 min,95℃变性3 s,60℃退火及延伸30 s,共计40个循环,实验中所用引物序列信息见“1.2”项。每个样品三个重复,2-ΔΔCT(Livak)法用于计算被测cDNA的相对表达水平[20],每个目标基因(IL-1β、IL-6、IL-10和COX-2)的相对表达水平是以β-actin为内参来计算。
2.5 甾醇混合对照品与HCSTS溶液的制备
分别精密称取干燥至恒重的7,22,25-豆甾三烯醇和α-菠甾醇各5 mg,适量甲醇溶解后,定容至10 mL,配制成浓度均为0.5 mg·mL-1的混合对照品溶液。精密称取干燥至恒重的HCSTS两份各5 mg,分别置于10 mL和100 mL容量瓶中,加色谱甲醇,制成含HCSTS为0.5 mg·mL-1和0.05 mg·mL-1的供试品溶液分别供HPLC和UPLC-MS/MS检测。
2.6 HPLC色谱条件
色谱柱采用InertSustain C18柱(4.6×250 mm,5µm),洗脱方式为100%甲醇等度洗脱,流速为1 mL·min-1,检测波长205 nm,柱温为35℃,进样量为10µL,色谱分离和色谱图采集时间均为30 min。
2.7 专属性考察
2.7.1 HPLC专属性考察
自动进样器精确地吸取“2.5”项混合对照品溶液和供试溶液各10µL,按照“2.6”项色谱条件进样,并采集色谱图。
2.7.2 UPLC-MS/MS考察色谱方法专属性
在ExionLC系统上进行供试样品(0.05 mg·mL-1的HCSTS)色谱分离,柱子为Phenomenex Kinetex®C18(2.1×100 mm,2.6µm),洗脱方式为100%甲醇等度洗脱,进样量为2µL,流速为0.4 mL·min-1,柱温为40℃。SCIEX TRIPLE TOF 5600+质谱系统用于一级(TOF MS)和二级(TOF MS/MS)质谱数据的采集,离子源为DuoSprayTM,电离方式为大气压化学电离(Atmospheric Pressure Chemical ionization,APCI)正离子模式。对质谱参数[21]进行了优化如下:离子源雾化气(Ion Source Gas1,Gas1)60 psi,离子源辅助气(Ion Source Gas2,Gas2)60 psi,帘气(Curtain gas,CUR)40 psi,离子源温度(source temperature)500℃,离 子 喷 雾 电 压(IonSapary Voltage Floating,ISVF)5500 V;一级母离子m/z范围:100-1000 Da,二级子离子质荷比范围:50-1000 Da,一级质谱采集时间为每张谱图100 ms,二级质谱采集时间为每张谱图50 ms。二级质谱数据为数据依赖性采集(information dependent acquisition,IDA)获得,且采用high sensitivity模式,去簇电压(Declustering potential,DP):140 V,碰撞能(Collision Energy,CE):45±15 V。数据采集软件为Analyst TF(SCIEX,版本1.8.1),SCIEX OS软件用于数据处理。

图1 HCSTS不同剂量组对肝损伤小鼠血清中ALT和AST活力的影响(xˉ±s,n=8)
2.8 线性关系、精密度与稳定性考察
2.8.1 线性关系考察
为了评估方法的线性是否良好,将“2.5”项下混合对照品溶液加色谱甲醇稀释至一系列浓度(0.5、0.4、0.3、0.2和0.1 mg·mL-1),按“2.6”项的色谱条件精确吸取10µL,分别采集色谱图,并记录峰面积。分别以7,22,25-豆甾三烯醇和α-菠甾醇的峰面积(Area)为纵坐标(Y),浓度(mg·mL-1)为横坐标(X),绘制线性回归方程。
2.8.2 精密度与稳定性考察
按“2.6”项下的色谱条件精确吸取“2.5”项混合对照品溶液10 µL,重复进样6次,并记录7,22,25-豆甾三烯醇和α-菠甾醇的峰面积。精密吸取“2.5”项下HCSTS的供试品溶液(0.5 mg·mL-1)10 µL,于0、2、4、8、16、24 h分别进样,记录每个时间点7,22,25-豆甾三烯醇和α-菠甾醇的峰面积。
2.9 重复性与加样回收率试验
取“2.5”项HCSTS(0.5 mg·mL-1)供试品溶液共6份,并按“2.6”项色谱条件测定,进样量均为10µL,记录峰面积。取同一供试品溶液,每份1 mL,共取6份,精确加入混合对照品溶液0.8 mL,按“2.6”项色谱条件进行测定,计算7,22,25-豆甾三烯醇和α-菠甾醇的回收率及相对标准偏差RSD。
2.10 样品的含量测定
取3份“2.5”项中所述的HCSTS溶液(0.5 mg·mL-1),按“2.6”项的色谱条件精密吸取10µL。并采用外标法(external standard)进行测定,记录峰面积,根据工作曲线计算HCSTS中7,22,25-豆甾三烯醇和α-菠甾醇的含量。
2.11 统计学分析方法
数据处理采用软件Graphpad 8.0.1版本,实验数据以“均值±标准差(±s)”表示。肝组织HE染色图中的坏死面积定量采用ImageJ软件(版本为1.53k)。使用单因素方差分析(one-way ANOVA)和t检验(Ttest)进行组间数据比较。以P<0.05表示统计学差异显著,P<0.01表示统计学差异极显著。
3 结果与分析
3.1 小鼠血清中ALT和AST活力测定结果
肝细胞受损后,血清中AST和ALT的升高非常敏感(图1A、图1B),尤其以ALT的升高最为明显。CON组中,ALT和AST的活力约为20 IU·L-1,MODEL组中ALT显著增加,其活力达到了140 IU·L-1。同时,AST活力也升高到了约55 IU·L-1,说明急性肝损伤造模成功。SIL组能显著降低ALT和AST的活力,且对AST活力的降低更为明显。HCSTS给药后,LD组可能由于较低的给药剂量(10 mg·kg-1bw),与MODEL组没有显著差异;MD组中ALT和AST活力分别下降了20 IU·L-1(P<0.01)和15 IU·L-1(P<0.05);与MODEL组 相比,HD组的ALT和AST活力均显著下降,其中ALT下降 了40 IU·L-1(P<0.01),AST下 降 了20 IU·L-1(P<0.01)。HD组中ALT活力和AST活力与SIL组均无显著性差异,表明HCSTS在50 mg·kg-1bw的剂量下显示出了与SIL相当的抗肝损伤效果。
3.2 组织病理学分析
肝组织病理切片相比于血清生化,可以从表观上反映出肝细胞形态改变以及炎性细胞浸润等病理状态。组织切片显示,在空白组中,肝小叶结构和细胞结构形态正常(图2A)。MODEL组的肝组织切片中有明显的肝细胞灶性坏死,肝细胞结构丧失,出现炎细胞浸润,且以中央静脉周围最为严重(MODEL组箭头所指)。炎性细胞浸润多发生于汇管区,表现在细胞核体积缩小,细胞结构丧失,或细胞形态不正常。SIL组中,肝细胞形态和炎性浸润均有一定程度的改善。LD组中,血管周围的炎性细胞浸润较MODEL组有所减少。随着HCSTS的剂量增加(如MD和HD组),炎性细胞浸润、细胞形态有了明显的改善(图2B)。对肝组织坏死面积定量分析结果显示,HCSTS剂量依赖性地减少肝组织坏死面积,与血清生化结果相吻合。其中,HD组相比于MODEL组显著减少了约75%肝组织坏死面积(P<0.01)(图2C)。组织病理切片表明,HCSTS在LD、MD和HD剂量下均能减少细胞坏死和炎症细胞的浸润,其中,HD组(50 mg·kg-1bw)的改善效果最为明显,表现出了显著的抗肝损伤效果。

图2 各组肝脏组织切片HE染色图(A)(HE×200),各组肝脏组织切片HE染色原图的RGB分离图(B),对HE染色图中的坏死面积进行定量(C)(xˉ±s,n=3)
3.3 炎症相关指标基因转录水平测定
从血清生化水平和组织切片探究了HCSTS抗肝损伤的效果之后,又从炎症相关指标的基因表达进行了考察。结果显示:与CON组相比,MODEL组中IL-1β,IL-6以及COX-2的基因表达水平均显著升高,表明造模成功(P<0.05或P<0.01)。与MODEL比较,HCSTS的HD组均能显著降低促炎细胞因子(IL-1β、IL-6)以及炎症通路相关酶COX-2的基因表达(P<0.05),并且,HD能显著升高抑炎细胞因子IL-10的基因表达(P<0.05)(图3)。

图3 肝组织中炎症指标相关基因转录水平(xˉ±s,n=3)
3.4 色谱条件的专属性
HCSTS在组织病理和血清生化水平上能改善CCl4诱导的肝损伤,其主要成分为7,22,25-豆甾三烯醇和α-菠甾醇,对于这两种甾醇进行含量测定,有助于揭示HCSTS中抗肝损伤的物质基础。本研究采用供试品溶液和混合标准品溶液的色谱图,根据其分离度和保留时间评估色谱条件的专属性。结果显示:供试品溶液色谱图4B中的1、2号峰与混合对照品溶液色谱图4A中的1、2号峰保留时间相同,且与其他杂质峰达到基线分离,表明色谱条件专属性良好。

图4 混合对照品(A)和供试品(B)溶液的HPLC图
由于本色谱条件为100%甲醇洗脱,洗脱能力较强,为排除甾醇类是否与其他成分(色素、脂肪酸等)“共流出”而影响定量,本研究利用灵敏度更高的UPLC MS/MS检测了HCSTS样品,根据其总离子流图(图5A、图6A),发现1和2号峰均与其他峰完全分离,根据质荷比(1,2号峰分别为393.3543和395.3560,两者均为[M+H-H2O]+),提取1和2号峰的离子流图(XIC,如图5B和图6B中的红色峰),发现HCSTS中两者的XIC图也能与其临近峰达到基线分离,两个峰的一级质谱图显示单一的质谱峰,几乎没有其他物质的干扰(如图5C和6C)。对1和2峰的二级质谱进行碎片离子解析(图5D、图6D),进一步证明了两者结构的准确性和此洗脱方法在不同类型色谱柱的适用性,主要特征离子碎片见表1。相比于HPLC通过基线是否分离验证专属性,UPLC-MS/MS进一步证明了7,22,25-豆甾三烯醇和α-菠甾醇在100%甲醇等度洗脱的条件下,几乎没有“共流出”峰,说明此洗脱方法对两者分离度好、专属性强。

表1 7,22,25-豆甾三烯醇和α-菠甾醇的主要特征离子碎片

图5 UPLC-MS/MS对7,22,25-豆甾三烯醇专属性考察
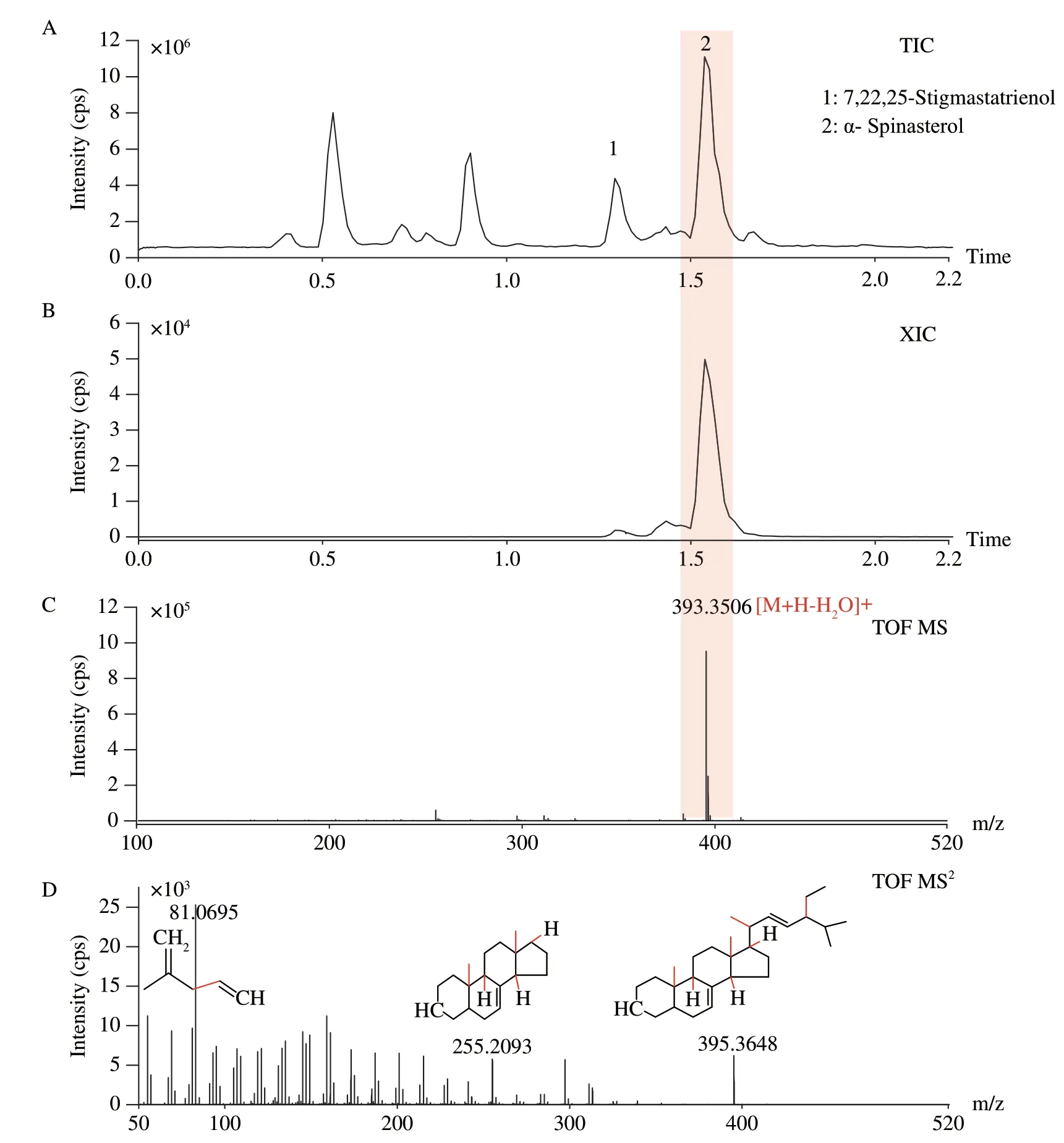
图6 UPLC-MS/MS对α-菠甾醇的专属性考察
3.5 线性关系、精密度和稳定性
在线性关系考察中,7,22,25-豆甾三烯醇和α-菠甾醇的线性回归方程分别为Y1=11280457X1+74950(R2=0.9991);Y2=7597146X2+19443(R2=0.9998)。两者分别在1.33-500和2.54-500 µg·mL-1范围内,浓度与峰面积之间线性关系良好;重复进样6次,进行精密度实验验证,计算得7,22,25-豆甾三烯醇和α-菠甾醇峰面积的相对标准偏差RSD分别为0.16%(n=6)和0.43%(n=6),表明该方法的精密度良好。在稳定性实验考察中,根据两者的峰面积,计算得7,22,25-豆甾三烯醇和α-菠甾醇峰面积的相对标准偏差RSD分别为0.59%(n=3)和0.66%(n=3),表明供试品溶液在24 h内较为稳定。
3.6 重复性和加样回收率
重复性实验中,计算得7,22,25-豆甾三烯醇和α-菠甾醇的平均含量为0.1022和0.2711 mg·mL-1,相对标准偏差RSD分别为1.97%(n=6)和1.62%(n=6),均小于2%,表明该方法重复性良好。加样回收率实验中,7,22,25-豆甾三烯醇和α-菠甾醇的加样回收率结果见表2。

表2 7,22,25-豆甾三烯醇和α-菠甾醇的加样回收率(mg·mL-1,n=6)
3.7 HCSTS中两个主要成分的含量测定
由表3可知,波棱瓜子壳总甾醇(HCSTS)中,α-菠甾醇含量最高,为HCSTS中的主要成分,占54.22%,其次是7,22,25-豆甾三烯醇,含量为20.44%,两者约占HCSTS的75%。

表3 两个主要甾醇样品的含量测定(xˉ±s,n=3)
4 讨论
植物甾醇(phytosterols)是一类具有抗炎、抗癌、降低血清胆固醇等多种生理功能的天然化合物,它们显示出对LPS诱导的小鼠腹膜炎的抗炎作用以及抗结直肠癌活性[22]。这些作用主要是由于它们对STAT3、IKK/NF-κB和PI3K-Akt信号通路相关的酶如环氧辅酶2(COX-2)的抑制而发挥抗炎[23]作用。
本研究中,对HCSTS以LD、MD、HD三个剂量组别进行了抗CCl4诱导的肝损伤试验,并以水飞蓟素作为阳性对照,水飞蓟素作为一种临床上常用的保肝药物,其可以通过抑制STAT3信号通路发挥抗炎作用[24]。本研究结果表明:在肝组织病理切片、肝酶水平,HCSTS呈剂量依赖性地减轻CCl4诱导的肝损伤,HD组能显著的改善肝损伤后的生化指标和组织形态,并能显著降低促炎因子IL-1β,IL-6的基因表达,而IL-6是STAT3的激活因子[25],推测HCSTS能通过抑制STAT3信号通路发挥抗肝损伤作用,与文献[26]相吻合。HD组使STAT3和IKK/NF-κB信号通路相关酶COX-2基因表达水平降低,并能使抑炎因子IL-10显著升高,共同作用减轻CCl4诱导的炎症反应[27]。HCSTS中不同结构的甾醇在抗炎作用方面存在巨大差异[28],因此,对两个主要甾醇进行含量测定,对于后续的“构-效”关系研究尤为重要。
然而,植物甾醇不仅极性小、而且极性也很接近[29],且紫外吸收较弱,分析较为困难,文献多采用衍生后再进行含量测定[30]。柱前衍生法前处理较为复杂,不适合高通量分析。本研究选择了在35℃下用100%甲醇以1 mL·min-1的流速等度洗脱。经优化的HPLC法含量测定,发现HCSTS中主要是7,22,25-豆甾三烯醇(20.4%)和α-菠甾醇(54.2%)。本研究曾尝试乙腈、乙腈-水作为HPLC流动相,发现分离效果不理想。可能是由于乙腈极性大,对甾醇溶解度较低。而甲醇-水(95%、98%甲醇)作为流动相,虽能洗脱下来,但保留时间太长。最终,确定100%甲醇作为流动相。然而,甾醇类与其他类植物成分(如脂肪酸类)都在近紫外端有较弱的紫外吸收,且100%甲醇洗脱系统有着很强的洗脱能力,相应地,选择性就会变弱。为验证甾醇与其他类物质是否“共流出”,本研究采用UPLC-MS/MS考察其专属性。UPLC-MS/MS以其高灵敏度和定性鉴定能力,进一步证明了100%甲醇洗脱系统对HCSTS中两个主峰分离的专属性。本课题组前期对流速和温度进行了考察[31],随着流速的增大,相应的甾醇保留时间越短,但是甾醇的分离度变差,柱压也随着升高。随着温度的升高,保留时间逐渐缩短,然而,对分离度几乎没有影响,考虑到温度过高对柱子的寿命和仪器使用的安全性风险加大,将柱温设置为35℃。
本研究以CCl4诱导的肝损伤为模型,通过组织病理学和血清生化、炎症相关指标等方面考察了HCSTS的抗肝损伤作用,其作用机制可能是:降低IL-1β,IL-6等促炎细胞因子和COX-2的表达,并升高抗炎细胞因子IL-10的表达,从而减轻CCl4诱导的炎症反应。结合RP-HPLC对活性成分的含量测定,揭示了HCSTS中7,22,25-豆甾三烯醇和α-菠甾醇可能是波棱瓜子壳抗肝损伤的物质基础。两个植物甾醇的差别在于侧链所含的双键个数,而这种差异也是甾醇类不同生理活性的先决条件,两者是否协同发挥抗肝损伤作用有待于进一步研究。
