三黄煎剂通过下调Aurora激酶A抑制乳腺癌血管新生*
2022-10-15杨美凤许岩磊
王 聪,杨美凤,姚 昶,许岩磊**
(1.南京中医药大学附属医院 南京 210029;2.江苏省中医院 南京 210029;3.南京市儿童医院 南京 210008)
在全球范围内,乳腺癌是女性最常见的导致死亡的恶性肿瘤。尽管目前的治疗手段及策略取得飞速发展,部分乳腺癌患者疗效提高显著,但乳腺癌本身存在较大的异质性,可根据患者发病年龄,肿瘤组织学分级,雌孕激素受体表达状态,HER-2基因表达状态,Ki-67指数等指标,对乳腺癌的复发风险及治疗反应性进行分级[1-3]。
Aurora激酶A为丝/苏氨酸蛋白激酶家族的重要组成部分,在细胞周期有丝分裂及胞质分裂中发挥重要作用[4]。Aurora激酶A扩增常导致细胞染色体不稳定性增加,DNA复制异倍体增加,细胞周期延迟,中心体异常等一系列细胞功能紊乱[5]。多项研究表明,Aurora激酶A的过度表达与多种恶性肿瘤发生、发展关系密切[6-12]。在乳腺恶性肿瘤中,Aurora激酶A表达异常通常提示肿瘤组织学分级较高,ER、PR表达偏低,Ki-67指数偏高,肿瘤倾向于复发、转移[13-18]。不仅如此,Aurora激酶A高表达与VEGF转录高水平密切相关,可引起肿瘤血管新生异常,最终导致肿瘤复发、转移[19]。
三黄煎剂为江苏省中医院乳腺外科临床治疗乳腺癌患者常用中药煎剂,由江苏省国医名师许芝银教授创立,其中包括黄芪、姜黄、制大黄三味中药,按照剂量3:1:1组合使用。在前期研究中,我们团队已经证实三黄煎剂对于乳腺癌细胞增殖抑制作用及细胞凋亡诱导作用,还能够靶向性下调Aurora激酶A的表达水平,对乳腺癌常用化疗药物表柔比星、内分泌治疗药物他莫昔芬显示出一定增效作用,且三黄煎剂能够显著调节乳腺癌MCF-7细胞氧化应激反应,从而减少细胞VEGF分泌[20-27]。然而三黄煎剂抑制乳腺癌血管新生方面的功效及机制未进行充分探讨,本研究旨在基于下调Aurora激酶A,深入探讨三黄煎剂抑制乳腺癌血管新生的功效及其内在机制。
1 材料与方法
1.1 一般材料
MCF-7细胞、MDA-MB-231细胞,HUVECs均购于南京凯基生物公司;三黄煎剂由江苏省中医院药学部代为煎制,其饮片成分黄芪、制大黄、姜黄,配置剂量分别为30 g、10 g、10 g,煎煮、去渣后,将上清液定容至100 mL,运用PBS配制成所需浓度;高糖DMEM培养基、RPMI-1640培养基、PBS、胎牛血清均购于美国Hyclone公司;Opti-MEM I减血清培养基购于美国Gibco公 司;Lipofectamine 2000购 于 美 国Invitrogen公司。
2.2 细胞培养
MCF-7细胞、HUVECs运用RPMI1640培养液(含10%胎牛血清)进行培养,MDA-MB-231细胞运用高糖DMEM培养液(含10%胎牛血清)进行培养,培养箱设置参数为37℃,5%CO2。
2.3 细胞迁移检测
将Matrigel胶稀释于无血清培养基中,稀释比例为1:4,后在transwell小室的下表面均匀平铺并脱水。HUVECs饥饿过夜,次日收集细胞,以每孔1x104个细胞的密度植入24孔板上的小室上室中。在上室中加入有或没有经Aurora激酶A敲减的乳腺癌细胞上清,作为HUVECs的条件培养基。将细胞置于参数为5%CO237℃的培养箱中培养24 h,然后用棉签刮除膜上表面的细胞,下表面的细胞先用75%乙醇固定,后用结晶紫细胞染色液染色,安装在载玻片上进行观察。显微镜下观察并计算5个随机视野细胞数,并取每组结果的平均值来量化细胞的数量。
2.4 HUVECs管腔形成检测
收集HUVECs,将其以75000个/孔的密度接种在包有250 µL Matrigel基质胶的24孔板中。每个样品在形成毛细血管样小管结构的过程中,定期用显微镜观察。孵育8 h后,对样品进行拍照,从5个独立的显微镜视野观察,评估小管的平均数。
2.5 siNRA沉默Aurora激酶A
配置含8×104个细胞的2ml细胞悬液,接种到6孔板的每个孔中。培养24 h后弃去上清液,将15µL浓度 为500 nmol/L的Aurora A siRNA及5 µL Lipofectamine 2000稀释 于1ml Opti-MEM I减血清 培养基,并加入每孔,培养4-6 h。弃去上清液,加入培养基孵育48 h后收集蛋白,用Western Blot检测此时细胞Aurora激酶A蛋白水平。
2.6 qRT-PCR检测
各组总RNA采用TRIzol试剂分离提取。采用TaKaRa RT试剂盒(中国大连宝生物工程公司)逆转录成cDNA。本研究所用引物序列见表1。使用SYBR Premix Ex TaqTM(中国大连宝生物工程公司)采用ABI 7500Fast qRT-PCR系 统 定 量Aurora激 酶A和GAPDH(内参)mRNA水平,得出Aurora激酶A和GAPDH的周期阈值(Ct)。每组实验3个重复。ΔCt=Ct目标基因-CtGAPDH。ΔΔCt=ΔCt实验组-ΔCt对照组。RQ值为2-ΔΔCt。

表1 qRT-PCR检测所需引物序列
2.7 Western Blot检测
用不同浓度的三黄煎剂干预细胞并获得细胞蛋白,蛋白浓度检测方法为BCA法。将20-30µg蛋白注入各组泳道。电泳方式为运用80 V恒定电压进行前20 min电泳,运用120 V恒定电压进行后60 min电泳,转膜方式为运用250 mA恒定电流进行90 min转膜,封闭方式为运用5%牛血清白蛋白溶液进行1 h封闭,后运用一抗进行整夜孵育,使用的一抗购于CST公司(美国),分别为兔抗人多克隆抗体p-AURKA(1:1000)、AURKA(1:1000)、p-ERK(1:1000)、ERK(1:1000)和β-actin(1:2000)。第二日以TBST溶液对条带进行漂洗,每张条带漂洗3次,每次漂洗5 min,后在室温下运用二抗进行孵育1 h;再次以TBST溶液对条带进行漂洗,每张条带漂洗3次,每次漂洗5 min,后以TBS溶液对条带进行漂洗5 min;以ECL发光剂对条带进行处理,以化学发光成像仪分析条带。
2.8 鸡胚绒毛膜尿囊膜(CAM)检测
CAM检测按照Li-Jing Wang团队设计的方法进行[28]。第9天,用手术刀打开受精卵(中国南京开基生物科技有限公司)的小窗口(10×10 mm2)。然后用无菌镊子打开蛋壳。将细胞悬浮液以1×106个细胞/100µL PBS的密度通过开口直接涂抹在CAM表面。盖好蛋壳开口,将鸡蛋放入37.8℃、60%湿度的培养箱中,旋转48 h。然后用剪刀小心翼翼地剪开蛋壳,形成方形。观察并记录蛋壳开口CAM的血管结构,用相机获取图像,并计算图像中血管的数量。
2.9 统计方法
本研究数据的呈现形式为平均数±标准差,数据统计选用SPSS 16.0软件,统计方法为“one-way ANOVA”,当P<0.05或0.01时,认为对照组和治疗组之间的差异显著。western blot条带的强度分析由Image J软件完成。
2 结果
2.1 三黄煎剂抑制乳腺癌细胞增殖
如图1-图2所示,前期研究结果显示三黄煎剂能够抑制MCF-7、MDA-MB-231细胞增殖,抑制率均呈浓度依赖性增加。在给药后24 h、48 h,三黄煎剂对MCF-7、MDA-MB-231细胞增殖抑制率呈时间依赖性增加。值得注意的是,MCF-7细胞对三黄煎剂的干预较MDA-MB-231细胞更敏感。故在本研究中,我们根据前期研究三黄煎剂对MCF-7、MDA-MB-231细胞IC50值的结果(图3),选取三黄煎剂2 mg·mL-1和4 mg·mL-1浓度作用于MCF-7细胞,4 mg·mL-1和8 mg·mL-1浓度的三黄煎剂作用于MDA-MB-231细胞进一步实验。

图1 三黄煎剂抑制乳腺癌MCF-7细胞增殖
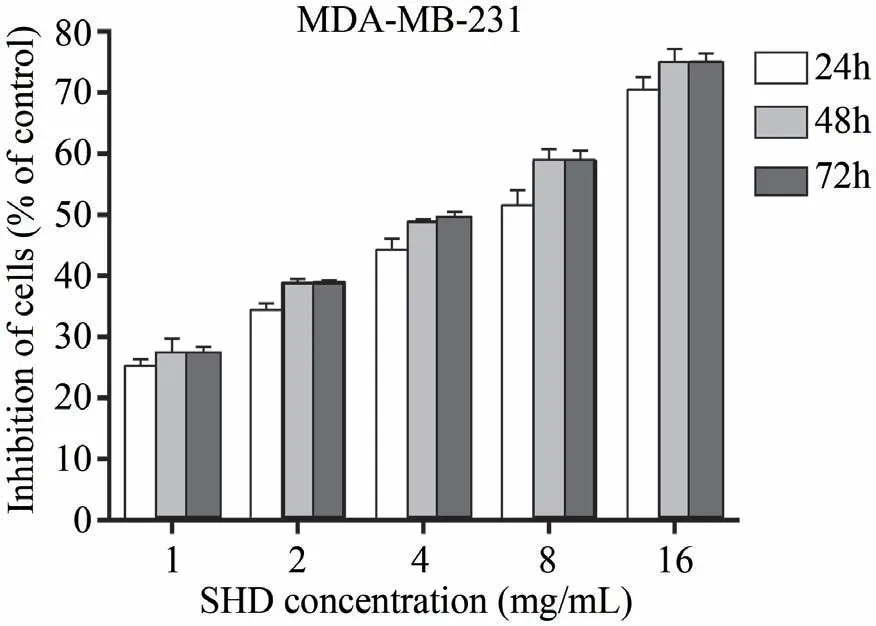
图2 三黄煎剂抑制乳腺癌MDA-MB-231细胞增殖
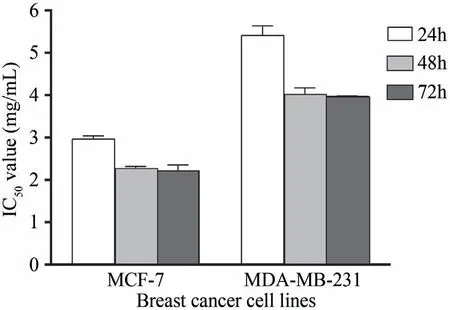
图3 三黄煎剂对乳腺癌MCF-7、MDA-MB-231细胞增殖IC50值
2.2 三黄煎剂抑制乳腺癌细胞Aurora激酶A表达
乳腺癌细胞中Aurora激酶A的表达通常是正常乳腺上皮细胞的20-50倍[29],前期研究已在体外水平初步探讨三黄煎剂对Aurora激酶A的调节作用[22,27],本次研究我们再次检测三黄煎剂对乳腺癌细胞Aurora激酶A表达的影响,并与沉默Aurora激酶A进行比较。如图4所示,不同浓度的三黄煎剂均能够下调乳腺癌细胞中Aurora激酶A蛋白水平,且均与沉默Aurora激酶A药效类似。如图5所示,对western blot检测结果进行半定量分析,三黄煎剂给药组Aurora激酶A蛋白水平显著低于对照组(P<0.01)。进一步的qRT-PCR结果显示,三黄煎剂能够显著抑制MCF-7、MDA-MB-231细胞Aurora激酶A的mRNA表达,且抑制方式与蛋白表达水平相似(图6)。Aurora激酶A蛋白、mRNA的下调与MCF-7、MDA-MB-231细胞增殖抑制具有较强的相关性。结合前期研究结果[23],Aurora激酶A敲减影响了三黄煎剂对乳腺癌细胞的抑制效果,我们认为三黄煎剂对Aurora激酶A具有靶向性抑制作用。

图5 乳腺癌细胞Aurora激酶A蛋白表达半定量分析

图6 三黄煎剂抑制乳腺癌细胞Aurora激酶A的mRNA表达
2.3 三黄煎剂通过下调Aurora激酶A抑制乳腺癌血管新生
Aurora激酶A通过上调肿瘤细胞内VEGF的转录水平,增加其分泌,从而导致其侵袭行为,在促进肿瘤血管生成中起着至关重要的作用[30]。本研究中,我们继续探讨三黄煎剂下调Aurora激酶A是否对抑制新生血管有影响。收集癌细胞上清,用于测定HUVECs的迁移和管腔形成。结果显示,三黄煎剂对HUVECs迁移的抑制作用与Aurora激酶A敲减的抑制作用一样显著(P<0.01)(图7)。此外,三黄煎剂干预后的MCF-7和MDA-MB-231细胞上清液中HUVECs的管腔形成明显减少(P<0.01)。三黄煎剂治疗取得的效果与在Aurora激酶A敲减肿瘤细胞上清中培养HUVECs时观察到的效果相似(图8)。

图7 三黄煎剂抑制乳腺癌细胞诱导下HUVECs迁移

图8 三黄煎剂抑制乳腺癌细胞诱导下HUVECs管腔形成
2.4 三黄煎剂下调Aurora激酶A抑制鸡胚尿囊膜上肿瘤血管新生
在前期研究中,通过qRT-PCR和western blot检测,我们发现MBA-MD-231细胞中的Aurora激酶A表达水平显著高于MCF-7细胞,而作为MDA-MB-231细胞的表型,三阴性乳腺癌较其他分子分型的乳腺癌侵袭性更强,患者复发率更高。故本研究我们以三黄煎剂对于不同细胞系的IC50值为依据,选取了浓度为4 mg·mL-1的三黄煎剂作用于MDA-MB-231细胞建立的鸡胚尿囊膜模型进行体内水平的探索[27]。我们在此基础上验证三黄煎剂能否通过下调Aurora激酶A抑制鸡胚尿囊膜上的乳腺癌血管新生。如图9所示,与对照组相比,MDA-MB-231细胞混悬液显著提高了鸡胚尿囊膜上的血管数量,具有统计学差异(P<0.01)。当运用三黄煎剂干预后,血管数量显著下降(P<0.01),且效果与敲减MDA-MB-231细胞中的Aurora激酶A近似。我们又进一步运用三黄煎剂干预Aurora激酶A沉默的MDA-MB-231细胞混悬液建立的鸡胚尿囊膜模型,我们观察到联合运用Aurora激酶A敲减仅仅小幅提升了三黄煎剂对于肿瘤血管新生的抑制效果(图10)。所以,我们推测三黄煎剂可能是通过抑制了Aurora激酶A的表达,从而抑制了乳腺癌血管新生。

图9 三黄煎剂或/和Aurora激酶A敲减干预鸡胚尿囊膜上乳腺癌血管新生

图10 三黄煎剂或/和Aurora激酶A敲减干预鸡胚尿囊膜血管计数
2.5 三黄煎剂靶向调节Aurora激酶A下调ERK表达
由于Aurora激酶A过表达能够通过异常激活ERK信号通路促进肿瘤血管新生[31],ERK信号通路激活常常通过调节VEGF水平诱导血管新生[32],故本研究我们通过western blot检测,初步探讨三黄煎剂对MCF-7和MDA-MB-231细胞 中ERK蛋 白 表达的 影响。如图11所示,western blot检测结果提示三黄煎剂和Aurora激酶A敲减均能够显著抑制ERK蛋白表达水平。我们对western blot检测结果进行半定量分析发现,三黄煎剂能够显著抑制乳腺癌ERK蛋白表达,且能达到与沉默Aurora激酶A类似的药效(图12)。所以我们推测三黄煎剂抑制了Aurora激酶A表达水平,进而下调了下游ERK信号通路,从而抑制了乳腺癌血管新生。

图11 三黄煎剂抑制乳腺癌细胞ERK蛋白表达

图12 乳腺癌细胞ERK蛋白表达半定量分析
3 讨论
众所周知,根据ER、PR、HER-2、Ki-67表达状态的不同,我们可将乳腺癌分为不同的亚型,以指导针对性的临床实践。如雌激素受体拮抗剂、芳香化酶抑制剂、雌激素受体下调剂、CDK4/6抑制剂等内分泌治疗药物,可用于激素受体阳性的乳腺癌患者,曲妥珠单抗、帕托珠单抗、拉帕提尼、吡咯替尼、T-DM1作为抗HER-2治疗的主要药物,用于治疗HER-2基因扩增的早期及晚期乳腺癌患者[33-35]。在过去的几十年间,由于分子靶向药物的运用,乳腺癌的治疗策略发生革命性的改变,患者的无疾病生存期、总生存期、生活质量都得到了不同程度的改善。不幸的是,由于ER、PR、HER-2表达的缺失,约占乳腺癌患者总数20%的三阴性乳腺癌患者无法从内分泌治疗、靶向治疗中获益,想要治愈此亚型的乳腺癌仍是一项巨大的挑战。不仅如此,由于三阴性乳腺癌机制未明,目前尚缺乏靶向性治疗手段。虽然在免疫治疗方面取得巨大进展,但考虑到以药物可及性为主的诸多因素,手术、化疗、放疗是目前仍是三阴性乳腺癌最主要的治疗手段。如上所属,基于三阴性乳腺癌的侵袭性、治疗手段的局限性,探索针对此亚型乳腺癌的更加有效的治疗手段刻不容缓。
据文献显示,Aurora激酶A在乳腺癌中常常呈高表达状态[12,36],并在乳腺癌的转移过程中起重要作用[14,37]。目前,Aurora激酶A靶向抑制剂已广泛运用于恶行肿瘤的临床前研究及临床实验研究中。作为口服Aurora激酶A靶向抑制剂,MLN8237能够通过调节乳腺癌p38 MAPK、Akt/mTOR信号通路诱导细胞周期停滞、凋亡、自噬[38]。在本研究中,我们基于Aurora激酶A的调节,运用ER、PR表达阳性乳腺癌MCF-7细胞,三阴性乳腺癌MDA-MB-231细胞探索三黄煎剂的功效。Western Blot实验结果显示,与沉默Aurora激酶A效果近似,三黄煎剂能够抑制MCF-7、MDA-MB-231细胞Aurora激酶A蛋白、mRNA的表达水平,且对MCF-7细胞Aurora激酶A蛋白、mRNA水平下调程度相对更为明显。这与Yi Gong主持开展的研究结果类似[29],丹参酮能够通过调节Aurora激酶A蛋白、功能从而抑制乳腺癌细胞增殖、诱导细胞周期停滞、细胞凋亡,同样MCF-7细胞对丹参酮给药比三阴性乳腺癌MDA-MB-231细胞敏感。这些结果说明,三黄煎剂对乳腺癌细胞的抑制率与其表型所对应的乳腺癌自身的侵袭性存在密切联系。
血管新生对于实体恶行肿瘤的发生、维持、进展至关重要。据报道称,VEFG过表达强烈预示乳腺癌恶性程度较大,侵袭性较强,预后不良[39-40]。研究表明,靶向抑制Aurora激酶A能够调节VEGF转录,抑制血管新生[19,30]。此外,一种口服VEFG选择性抑制剂能够降低肿瘤患者血清VEGF水平并已通过I期临床试验[41]。本研究结果显示,与Aurora激酶A沉默作用类似,三黄煎剂能够抑制在乳腺癌细胞条件培养基诱导下的HUVECs迁移、管腔形成。我们建立鸡胚尿囊膜模型,在体内水平探索三黄煎剂的功效及机制。结果表明,三黄煎剂能够抑制鸡胚尿囊膜上的新生血管数,药效与Aurora激酶A敲减近似。然而,当我们联合运用三黄煎剂与沉默AUKRA时,我们发现血管的数量与单用三黄煎剂或沉默AUKRA相比,并没有明显的减少。所以,我们推测三黄煎剂可能是通过靶向调控了Aurora激酶A从而抑制乳腺癌血管新生。
肿瘤发生和发展通常与细胞信号通路中致癌基因和底物之间的串扰密切相关。Aurora激酶A与各种下游肿瘤相关信号通路相互作用,在肿瘤血管生成和进展中发挥关键作用。如Karar等人所述[42],PI3K/AKT/mTOR信号通路的构成性激活会导致血管的异常形成和生长,进而导致肿瘤血管的紊乱,在介导肿瘤血管新生方面起关键作用。此外,据报道称,ERK 1/2的激活促进血管生成和VEGF的上调[43-44]。本研究中,与对照组相比,三黄煎剂治疗和Aurora激酶A沉默导致MCF-7和MDA-MB-231细胞中ERK的表达降低。我们的研究结果表明三黄煎剂可能以Aurora激酶A为靶点,从而介导下游ERK信号通路,进而调控肿瘤血管生成。在调节肿瘤血管新生和VEGF表达中,三黄煎剂对Aurora激酶A和ERK的具体调节机制有待深入探讨。
综上所述,本研究证实了三黄煎剂对Aurora激酶A的调控作用,对乳腺癌血管新生的抑制作用,且与沉默Aurora激酶A疗效相仿。其机制可能是:三黄煎剂靶向性下调了Aurora激酶A,从而调控下游ERK通路,从而抑制乳腺癌肿瘤血管生成。本研究为国家自然科学基金(三黄煎剂基于抑制Aurora激酶A调节NF-κB信号通路影响乳腺癌血管新生的机制研究,负责人:许岩磊)的重要组成部分,在此基础上,我们将继续深入探讨在三黄煎剂抑制乳腺癌血管新生中Aurora激酶A与下游信号通路之间的确切相互作用关系。本研究基于新型癌基因Aurora激酶A的调控,探讨三黄煎剂抑制血管新生的功效,从而防治早期乳腺癌复发转移,契合中医药治未病理论,为中医药防治乳腺癌提供了新的研究思路。由于肿瘤血管新生预示疾病不良预后,我们的研究结果将为患者、临床工作者在决策三阴性乳腺癌治疗方案,特别是晚期三阴性乳腺癌治疗方案时提供更多的理论依据。
