淋巴道转移潜能及ANXA7对肝癌细胞共培养淋巴管内皮细胞的调控作用
2022-10-14王静文钱雪娇章明放唐建武
王静文,钱雪娇,章明放,唐建武
· 论著 ·
淋巴道转移潜能及ANXA7对肝癌细胞共培养淋巴管内皮细胞的调控作用
王静文1,3,钱雪娇2,3,章明放1,3,唐建武4
1 天津市第一中心医院病理科,天津 300192;2 天津市第一中心医院呼吸科;3 南开大学医学院;4 大连医科大学基础医学院病理教研室
探讨淋巴道转移潜能及膜联蛋白A7(ANXA7)对肝癌细胞共培养淋巴管内皮细胞(LEC)的调控作用。将各肝癌细胞及LEC共培养,收集与F细胞(高淋巴道转移潜能)、P细胞(低淋巴道转移潜能)、FA7下调细胞(ANXA7表达下调)、F无关序列细胞、PA7上调细胞(ANXA7表达上调)、P空载体细胞共培养的LEC(L-F共、L-P共、L-FA7下调共、L-F无关序列共、L-PA7上调共、L-P空载体共细胞)以及正常LEC用于实验。分别用实时定量PCR、Western blotting检测共培养LEC内淋巴管内皮相关分子(VEGF-C、VEGF-D、VEGFR-3、NRP-2、PDPN、LYVE-1、SOX18)mRNA与蛋白表达。用细胞免疫荧光法检测共培养LEC内淋巴管内皮相关分子定位,用ELISA法检测细胞上清液VEGF-C、VEGF-D水平,用淋巴管成管实验测算淋巴管成管节点数和分支总长度。VEGF-C、VEGF-D、VEGFR-3、NRP-2、PDPN、LYVE-1、SOX18在mRNA和蛋白水平表达上,L-P共、L-F共细胞高于LEC(均<0.05),L-F共细胞高于L-P共细胞(均<0.05)。与L-F无关序列共、L-P空载体共细胞相比,L-FA7下调共细胞上述分子表达均低(均<0.05),L-PA7上调共细胞上述分子表达均高(均<0.05)。ANXA7调控前后,各细胞中VEGF-C、VEGFR-3、PDPN相对表达量与同类分子(VEGF-D、NRP-2及LYVE-1/SOX18)比较变化更显著(均<0.05)。VEGF-C、VEGF-D主要在细胞质内表达;VEGFR-3/NRP-2主要在细胞膜表达,少量在细胞质表达;PDPN、LYVE-1主要在细胞质表达;SOX18主要在细胞核表达,少量于细胞质表达。ANXA7调控前,细胞上清液中VEGF-C、VEGF-D表达比较,L-F共、L-P共细胞高于LEC,L-F共细胞高于L-P共细胞(均<0.05),且VEGF-C表达均高于VEGF-D表达(均<0.05)。ANXA7调控前后,各细胞上清液中VEGF-C相对表达量与同类分子(VEGF-D)比较变化更显著(均<0.05)。在节点数和分支总长度上,L-F共、L-P共细胞均多于LEC,L-F共细胞多于L-P共细胞(均<0.05);L-FA7下调共细胞少于L-F无关序列共细胞(均<0.05),L-PA7上调共细胞多于L-P空载体共细胞(均<0.05)。高淋巴道转移潜能和ANXA7表达上调,可促进与肝癌细胞共培养的LEC淋巴管内皮相关分子表达,提高淋巴管成管能力。
肝癌细胞;淋巴管内皮细胞;体外共培养;淋巴道转移潜能;膜联蛋白A7;淋巴管内皮相关分子;淋巴管成管
据统计,肝癌淋巴道转移者最高可达肝癌手术切除病例的30%甚或尸检病例的60%[1-2]。F/P细胞是来源于小鼠腹水型肝癌细胞系的2个亚克隆,其中F细胞淋巴结转移率约70%(高淋巴道转移潜能),而P细胞淋巴结转移率约30%(低淋巴道转移潜能)[3-4]。以前认为肿瘤淋巴道转移是一个被动过程,现已明确肿瘤细胞和淋巴管内皮细胞(LEC)之间存在主动联系。在LEC相关分子中,血管内皮生长因子-C/D(VEGF-C/D)是生长因子配体,血管内皮生长因子受体-3(VEGFR-3)/神经纤维蛋白-2(NRP-2)是其结合受体,平足蛋白(PDPN)/淋巴管内皮细胞表面透明质酸受体-1(LYVE-1)和性别决定区Y框18(SOX18)则是LEC特异标记物。本课题组前期研究发现,膜联蛋白A7(ANXA7)作用于肝癌的发生发展及其淋巴道转移过程,是极具潜力的癌症治疗靶点,但其确切的分子调控机制尚未明晰[5-6]。2018年1月—2021年5月,本研究在前期工作基础上进一步研究肝癌细胞高/低淋巴道转移潜能(ANXA7调控前)和下调/上调ANXA7基因(ANXA7调控后)干预,对体外共培养LEC的相关分子表达和淋巴管成管的影响。
1 材料与方法
1.1细胞、试剂及仪器F细胞(高淋巴道转移潜能)、P细胞(低淋巴道转移潜能),FA7下调细胞(ANXA7表达下调)、F无关序列细胞(转染无关序列),PA7上调细胞(ANXA7表达上调)、P空载体细胞(转染空载体),由大连医科大学病理教研室构建。小鼠正常LEC,购自美国Cell Biologic公司。主要实验仪器、试剂及来源如下:CO2培养箱(美国Thermo公司);超净工作台(苏州安泰空气技术有限公司);凝胶成像系统Odyssey、电泳槽、电泳仪、转膜槽、转膜仪(上海伯乐生命医学产品有限公司);高速冷冻离心机(日本Tomy Kogyo公司);超声波破碎仪JY-Ⅱ(中国宁波新芝科技股份有限公司);FTC-2000A Real-time PCR 仪(上海枫岭生物技术有限公司);荧光实时定量PCR仪MX3005P(美国Agilent Technologies公司);荧光倒置显微镜(上海虹渐光电科技有限公司);酶标仪(上海闪谱生物科技有限公司);RPMI1640、DMEM(北京索莱宝科技有限公司);胎牛血清(法国Biowest公司);ECM培养基、FBS(美国Science Cell公司);Matrigel(美国Sigma公司);TRIzol试剂(美国Invitrogen公司);一抗VEGF-C、VEGF-D、VEGFR-3、PDPN、LYVE-1、SOX18(美国Santa Cruz公司)、NRP-2(美国Santa Cruz公司和英国Abcam公司)、GAPDH(北京中杉金桥生物技术有限公司),Western blotting二抗(美国LI-COR公司),细胞免疫荧光二抗(美国Abbkine公司)。
1.2肝癌细胞与LEC共培养将各肝癌细胞(悬浮细胞)及正常LEC(贴壁细胞)各1×106个分别接种于培养皿中共培养,均加入等体积无血清RPIM1640培养基5 mL,37 ℃下5% CO2孵育24 h,收集与F细胞共培养LEC(L-F共)、与P细胞共培养LEC(L-P共),与FA7下调细胞共培养LEC(L-FA7下调共)、与F无关序列细胞共培养LEC(L-F无关序列共)、与PA7上调细胞共培养LEC(L-PA7上调共)、与P空载体共细胞共培养LEC(L-P空载体共)以及正常LEC用于实验。
1.3共培养LEC内淋巴管内皮相关分子mRNA表达检测采用实时定量PCR。收集共培养的LEC转移到EP管,冰上操作,先后加TRIzol、三氯甲烷、异丙醇、DEPC水稀释的75%乙醇,4 ℃离心获取上清液,DEPC水溶解。引物由TaKaRa公司设计,各分子引物序列如下:VEGF-C上游引物序列5'-GTGAGGTGTGTATAGATGTGGGG-3',下游引物序列5'-ACGTCTTGCTGAGGTAACCTG-3';VEGF-D上游引物序列5'-CAGTGCCCGAGTTAGTGCC-3',下游引物序列5'-CCACAGCATGTCAATAGGACAGA-3';VEGFR-3上游引物序列5'-ACAGAAGCTAG-GCCCTACTG-3',下游引物序列5'-ACCCACATCGAGTCCTTCCT-3';NRP-2上游引物序列5'- GACTTCATTGAGATTCGGGATGG-3',下游引物序列5'-AACTTGATGTATAACACGGAGCC-3';PDPN上游引物序列5'-CACCTCAGCAACCTCAGAC-3',下游引物序列5'-ACAGGGCAAGTTGGAAGG-3';LYVE-1上游引物序列5'-TTTCACAGAAGCCAACGAGG-3',下游引物序列5'-AAAGAAGAGGAGAGCCAGCA-3';SOX18上游引物序列5'-CGCGTGTATGTTTGGTTC-3',下游引物序列5'-ATGTAACCCTGGCAACTC-3';GAPDH 上游引物序列5'-AAATGGTGAAGGTCGGTGTGAAC',下游引物序列5'-CAACAATCTCCACTTTGCCACTG-3'。42 ℃温育45 min,85 ℃加热10 min,终止反应,反应液用作PCR模板。反应条件:95 ℃变性3 min;95 ℃ 30 s,62 ℃ 40 s,共40个循环。用2-ΔΔCT计算目的基因相对表达量。
1.4共培养LEC内淋巴管内皮相关分子蛋白表达检测采用Western blotting法。收集共培养24 h的LEC,分别加3倍体积细胞裂解液,冰上操作,超声破碎后4 ℃离心15 min,取上清液,BCA蛋白试剂盒测定各组LEC总蛋白浓度。总蛋白(50 μg)加载于12% SDS-PAGE凝胶,分离转移到PVDF膜,分别加一抗VEGF-C(1∶500)、VEGF-D(1∶500)、VEGFR-3(1∶400)、NRP-2(1∶800)、PDPN(1∶400)、LYVE-1(1∶400)、SOX18(1∶400)、GAPDH(1∶2 000)4 ℃过夜,荧光二抗(1∶15 000)室温1 h。用凝胶分析系统扫描条带,经Image J和GraphPad Prism5软件分析灰度,计算OD均值。
1.5共培养LEC内淋巴管内皮相关分子定位检测采用细胞免疫荧光法。收集共培养24 h的LEC沉淀于EP管中,分别与VEGF-C、VEGF-D、VEGFR-3、NRP-2、PDPN、LYVE-1、SOX18(均1∶75)一抗于4 ℃过夜,荧光二抗(1∶50)37 ℃ 90 min,DAPI染色细胞核,激光共聚焦显微镜(物镜40×目镜10),观察载玻片上的单层细胞,观测各组共培养LEC中VEGF-C、VEGF-D、VEGFR-3、NRP-2、PDPN、LYVE-1、SOX18等表达的位置。
1.6细胞上清液VEGF-C、VEGF-D检测采用ELISA法。取各LEC(1×106个/mL)培养24 h取培养的上清液,在micro-ELISA平板上与预包被VEGF-C或VEGF-D抗体(即用型)结合,取细胞上清液100 mL与100 µL生物素-辣根过氧化物酶标记亲和素工作液(即用型),37 ℃温育1 h,每孔加底物溶液90 μL,37 ℃避光显色30 min,加终止溶液50 μL。用酶标仪检测波长452 nm处OD值,每孔设2个复孔取平均值。用GraphPad Prism5软件计算OD均值。
1.7淋巴管成管节点数和分支总长度测算采用淋巴管成管实验。取各LEC(1×106个/mL)培养24 h,3 000 r/min离心20 min(半径为160 mm),取上清液加入预冷Matrigel基质胶,置于96孔板,每孔60 μL,培养环境5% CO2、37 ℃ 30 min。LEC经胰酶消化、800 r/min离心5 min(半径为100 mm)后,将各类LEC分别取4×104个细胞于200 μL上清液制成混合液,加至Matrigel基质胶中,置于5% CO2、37 ℃ 培养箱培养4 h,倒置显微镜(物镜20×目镜10)下观察细胞淋巴管成管节点数和分支总长度。结果用Image J和GraphPad Prism5软件分析,计算淋巴管成管节点数和分支总长度。

2 结果
2.1ANXA7调控前后共培养LEC中淋巴管内皮相关分子表达比较VEGF-C、VEGF-D、VEGFR-3、NRP-2、PDPN、LYVE-1、SOX18表达mRNA和蛋白比较,L-P共、L-F共细胞高于LEC(均<0.05),L-F共细胞高于L-P共细胞(均<0.05)。与L-F无关序列共、L-P空载体共细胞相比,L-FA7下调共细胞上述分子表达均低(均<0.05),L-PA7上调共细胞上述分子表达均高(均<0.05)。ANXA7调控前后,各细胞中VEGF-C、VEGFR-3、PDPN相对表达量与同类分子(VEGF-D、NRP-2及LYVE-1/SOX18)比较变化更显著(均<0.05)。见表1~4。
表1 ANXA7调控前共培养LEC中淋巴管内皮相关分子mRNA表达(± s)
表2 ANXA7调控前共培养LEC中淋巴管内皮相关分子蛋白表达(± s)
表3 ANXA7调控后共培养LEC中淋巴管内皮相关分子mRNA表达(± s)
表4 ANXA7调控后共培养LEC中淋巴管内皮相关分子蛋白表达(± s)
2.2ANXA7调控前后共培养LEC中淋巴管内皮相关分子的定位VEGF-C、VEGF-D主要在细胞质内表达;VEGFR-3/NRP-2主要在细胞膜表达,少量在细胞质表达;PDPN、LYVE-1主要在细胞质表达;SOX18主要在细胞核表达,少量于细胞质表达。
2.3ANXA7调控前后共培养LEC细胞上清液中VEGF-C、VEGF-D表达比较ANXA7调控前,细胞上清液中VEGF-C、VEGF-D表达比较,L-F共、L-P共高于LEC,L-F共高于L-P共(均<0.05),且VEGF-C表达都高于VEGF-D(均<0.05)。ANXA7调控前后,各细胞VEGF-C相对表达量与同类分子(VEGF-D)比较变化更显著(均<0.05)。见表5。
表5 ANXA7调控前后共培养LEC细胞上清液中VEGF-C、VEGF-D表达(± s)
2.4ANXA7调控前后共培养LEC淋巴管成管能力的变化倒置显微镜下见薄壁网状分支形成多边形空心管腔,腔壁由单层扁平LEC围绕,细胞连接处见点状结节。在节点数和分支总长度上,L-F共、L-P共细胞均多于LEC,L-F共细胞多于L-P共细胞(均<0.05);L-FA7下调共细胞少于L-F无关序列共细胞(均<0.05),L-PA7上调共细胞多于L-P空载体共细胞(均<0.05)。见图1、表6。
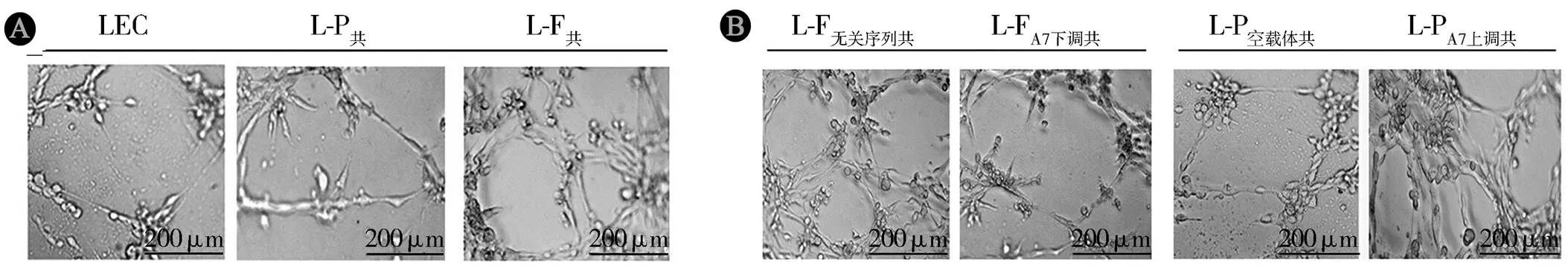
注:A为ANXA7调控前;B为ANXA7调控后。
表6 ANXA7调控前后共培养LEC的淋巴管节点数及分支总长度(± s)
3 讨论
肿瘤细胞和LEC是与肿瘤生长及淋巴道转移密切相关的细胞群体,二者的功能和交互作用变化,在很大程度上决定了肿瘤的发生发展与预后转归。为进一步了解细胞分泌因子、代谢物质或直接接触等因素对与肝癌细胞共培养的LEC的影响,全面解析二者之间复杂的相互作用,我们重点研究了肝癌细胞淋巴道转移潜能及ANXA7基因调控对共培养LEC的VEGF-C、VEGF-D、VEGFR-3、NRP-2、PDPN、LYVE-1、SOX18分子表达和淋巴管成管的作用。本研究首次从分子生物学和细胞行为学两个角度深入探讨。
经过体外细胞共培养,观察与不同淋巴道转移潜能肝癌细胞共培养的LEC中特异相关分子表达、分泌和淋巴管成管变化的特点发现,高淋巴道转移潜能肝癌细胞有效促进了共培养LEC的淋巴管内皮相关分子表达、分泌和淋巴管成管。尤其是各组VEGF-C、VEGFR-3、PDPN、成管节点数等指标的变化,提示VEGF-C、VEGFR-3、PDPN、成管节点对肝癌淋巴道转移潜能和ANXA7的调控都更加敏感。研究表明,高淋巴道转移潜能肿瘤细胞,除了自身表现出强大的迁徙、穿越、损伤淋巴管内皮屏障能力外,还更容易激活LEC的相应生长信号通路分子表达分泌,诱导肿瘤新生LEC生成、分化和淋巴管重构[7-10]。
研究表明,ANXA7参与细胞生长、分化、增殖、运动、分泌和凋亡等生物学行为,是诱导肝癌、胃癌、结直肠癌、肺癌、鼻咽癌、甲状腺癌等增殖侵袭转移的重要基因蛋白[11-14]。其可能机制是通过调控强化肝癌细胞ANXA7的功能,提高细胞内磷脂酰肌醇激酶(PI3K)、蛋白激酶B(AKT)和Ras相关的C3肉毒素底物1(RAC1)信号活性,分泌更多的VEGF-C、VEGF-D,从而进一步诱导激活与之共培养LEC中的VEGF-C/D-VEGFR-3/NRP-2配体受体轴及其下游的核转录因子SOX18和跨膜蛋白PDPN/LYVE-1等,经由丝裂原活化蛋白激酶(MAPK)、蛋白激酶B(PKB)、局部黏着斑激酶(FAK)、肉瘤逆转录病毒起源的蛋白酪氨酸激酶家族(Src)、细胞外调节蛋白激酶(Erk)等通路分子,最终导致LEC细胞增殖、迁徙,并模拟形成淋巴管腔样结构[13,15]。本研究观察到ANXA7可使与肝癌细胞共培养LEC的分子生物学和细胞行为学发生一系列变化,充分体现了肿瘤实质细胞基因调控对肿瘤间质细胞的继发影响。上调肝癌细胞ANXA7基因表达,也能明显促进淋巴管内皮相关分子表达和淋巴管成管能力。
本研究以淋巴管内皮相关分子表达和淋巴管成管现象作为主要观察指标,分别代表了LEC的分子生物学和细胞行为学特性。淋巴管内皮相关分子主要在LEC的细胞膜、细胞质和细胞核中表达,参与LEC的生成、增殖、分化和功能执行过程[16]。此外研究发现,在各组LEC细胞上清液中以VEGF-C分泌为主。这说明VEGF-C、VEGF-D分泌存在差异,且提示VEGF-C可作为淋巴道内皮相关分子的可溶性标记,用于临床外周血样本检测。淋巴管成管现象展示了LEC分裂、增殖、迁移、连接和围管成形能力,模拟了体内肿瘤淋巴管生成时淋巴管增殖、发芽和管腔增大的过程[17]。本研究发现,上述淋巴管内皮相关分子表达和成管现象增多,表明共培养LEC细胞内外信号系统转导、执行、集成等的网络调控发生了变化,最终都会对肿瘤淋巴管生成特别是淋巴道转移产生重大影响。
以LEC为最基本细胞成分构成的淋巴管系统,是肿瘤细胞随淋巴液迁徙运行到达各级淋巴结的唯一通道。需要指出的是,我们所做体外实验的研究对象,是与肝癌细胞共培养的正常LEC细胞株。但实际在体内肿瘤组织中,间质新生LEC可以有三种来源:一是受肿瘤细胞激活而分裂增殖的原有间质正常LEC(肿瘤关联LEC);二是来自随血液淋巴液循环至肿瘤局部的骨髓LEC祖细胞(骨髓源性LEC);三是由肿瘤细胞转分化或基因融合而成的LEC(肿瘤源性LEC)[18-19]。这些肿瘤性LEC与正常LEC相比有不同之处。如生物学特征上体外细胞分离后寿命较短,很难大量培养;细胞形态学上肿瘤性LEC细胞核更大、中心体异常;遗传学上见肿瘤性LEC染色体畸变、缺失、非整倍体增加;标记基因蛋白高表达,如上池蛋白(Suprabasin)、双糖链蛋白多糖(Biglycan)、转胶蛋白2(TAGLN2)、锌指蛋白转录因子5(KLF5)、信号传导转录激活因子1(STAT1)和信号传导转录激活因子2(STAT2)等[19-20]。此外有必要强调,肿瘤细胞与LEC共培养时,两种细胞间的作用是双向的,共培养LEC也会促进黑色素瘤、髓母细胞瘤、结直肠癌、卵巢癌等肿瘤细胞的侵袭生长和淋巴道转移[21-22]。因此,肿瘤细胞与LEC之间的相互作用机制可能极为复杂,有必要进一步研究。
本研究结果表明,高淋巴道转移潜能和ANXA7表达上调,可促进与肝癌细胞共培养的LEC淋巴管内皮相关分子表达及淋巴管成管。
[1] MA J, ZHANG L, BIAN H R, et al. A noninvasive prediction nomogram for lymph node metastasis of hepatocellular carcinoma based on serum long noncoding RNAs[J]. Biomed Res Int, 2019,2019:1710670.
[2] WATANABE J, NAKASHIMA O, KOJIRO M. Clinicopathologic study on lymph node metastasis of hepatocellular carcinoma: a retrospective study of 660 consecutive autopsy cases[J]. Jpn J Clin Oncol, 1994,24(1):37-41.
[3] LING M Y. Establishment and biological characteristics of mouse hepatoma cell line H22-F25/L[J]. Chin J Oncol, 1991,13:13-15.
[4] JIN Y L, WANG Z Q, QU H, et al. Annexin A7 gene is an important factor in the lymphatic metastasis of tumors[J]. Biomed Pharmacother, 2013,67(4):251-259.
[5] SONG L, MAO J, ZHANG J, et al. Annexin A7 and its binding protein galectin-3 influence mouse hepatocellular carcinoma cell line in vitro[J]. Biomed Pharmacother, 2014,68(3):377-384.
[6] GUO C, LIU S, GREENWAY F, et al. Potential role of annexin A7 in cancers[J]. Clin Chim Acta, 2013,423:83-89.
[7] MA Q, DIETERICH L C, DETMAR M. Multiple roles of lymphatic vessels in tumor progression[J]. Curr Opin Immunol, 2018,53:7-12.
[8] WANG J, HUANG Y, ZHANG J, et al. High co-expression of the SDF1/CXCR4 axis in hepatocarcinoma cells is regulated by AnnexinA7 in vitro and in vivo[J]. Cell Commun Signal, 2018,16(1):22.
[9] COMMERFORD C D, DIETERICH L C, HE Y, et al. Mechanisms of tumor-induced lymphovascular niche formation in draining lymph nodes[J]. Cell Rep, 2018,25(13):3554-3563,e4.
[10] ROY S, KUMARAVEL S, BANERJEE P, et al. Tumor lymphatic interactions induce CXCR2-CXCL5 axis and alter cellular metabolism and lymphangiogenic pathways to promote cholangiocarcinoma[J]. Cells, 2021,10(11):3093.
[11] YE W, LI Y, FAN L, et al. Effect of annexin A7 suppression on the apoptosis of gastric cancer cells[J]. Mol Cell Biochem, 2017,429(1-2):33-43.
[12] GUI S J, DING R L, WAN Y P, et al. Knockdown of annexin Ⅶ enhances nasopharyngeal carcinoma cell radiosensitivity in vivo and in vitro[J]. Cancer Biomark, 2020,28(2):129-139.
[13] LEIGHTON X, EIDELMAN O, JOZWIK C, et al. ANXA7-GTPase as tumor suppressor: mechanisms and therapeutic opportunities[J]. Methods Mol Biol, 2017,1513:23-35.
[14] WANG Y. Circ-ANXA7 facilitates lung adenocarcinoma progression via miR-331/LAD1 axis[J]. Cancer Cell Int, 2021,21(1):85.
[15] ZHAO Y, YANG Q, WANG X, et al. AnnexinA7 down-regulation might suppress the proliferation and metastasis of human hepatocellular carcinoma cells via MAPK/ERK pathway[J]. Cancer Biomark, 2018,23(4):527-537.
[16] CHEN J M, LUO B, MA R, et al. Lymphatic endothelial markers and tumor lymphangiogenesis assessment in human breast cancer[J]. Diagnostics (Basel), 2021,12(1):4.
[17] ZHOU H, LEI P J, PADERA T P. Progression of metastasis through lymphatic system[J]. Cells, 2021,10(3):627.
[18] HE M, HE Q, CAI X, et al. Role of lymphatic endothelial cells in the tumor microenvironment-a narrative review of recent advances[J]. Transl Lung Cancer Res, 2021,10(5):2252-2277.
[19] LIN P P. Aneuploid circulating tumor-derived endothelial cell (CTEC): a novel versatile player in tumor neovascularization and cancer metastasis[J]. Cells, 2020,9(6):1539.
[20] WEI J C, YANG J, LIN D, et al. Tumor-associated lymphatic endothelial cells promote lymphatic metastasis by highly expressing and secreting SEMA4C[J]. Clin Cancer Res, 2017,23(1):214-224.
[21] SILVESTRI V L, HENRIET E, LINVILLE R M, et al. A tissue-engineered 3D micro-vessel model reveals the dynamics of mosaic vessel formation in breast cancer[J]. Cancer Res, 2020,80(19): 4288-4301.
[22] FRENKEL N, POGHOSYAN S, ALARCóN C R, et al. Long-lived human lymphatic endothelial cells to study lymphatic biology and lymphatic vessel/tumor coculture in a 3D microfluidic model[J]. ACS Biomater Sci Eng, 2021,7(7):3030-3042.
·作者·编者·读者·
《山东医药》杂志诚邀审稿专家
《山东医药》是山东省卫生健康委员会主管、山东省立医院主办的综合性医学学术期刊,1957年创刊,旬刊,ISSN 1002-266X,CN 37-1156/R,邮发代号24-8。现为中国科技核心期刊、中国生物医学核心期刊、RCCSE 中国核心学术期刊、《中国学术期刊影响因子年报》统计源期刊等,连续多次入选《中文核心期刊要目总览》,2020 期刊影响力指数(CI)1014.395、排序4/212,位于Q1 区,期刊即年影响因子1.136。
随着我国医学科研水平不断提升,医学论文的科研设计、统计分析愈加复杂,《山东医药》的自然投稿量持续增加,导致目前在库审稿专家的审稿工作量越来越大。为了严格执行同行评议制度,保证期刊学术质量,规范学者学术行为,进一步充实审稿专家队伍,现面向全国公开招聘审稿专家,诚邀您的加入。
Regulatory effects of lymphatic metastasis potential and ANXA7 on lymphatic endothelial cells co-cultured with hepatocarcinoma cells
1,,,
1,,300192,
To investigate the regulatory effects of lymphatic metastasis potential and Annexin A7 (ANXA7) on lymphatic endothelial cells (LECs) co-cultured with hepatocellular carcinoma cells.The liver cancer cells and LEC were co-cultured. The LECs (L-F, L-P, L-FA7DOWN, L-FSHUS, L-PA7UP, L-PNCEV) co-cultured with F cells (high lymphatic metastasis potential), P cells (low lymphatic metastasis potential), FA7DOWNcells (F ANXA7 down-regulated cells), FSHUScells (F-unrelated sequence cells), PA7UPcells (P ANXA7 up-regulated cells), and PNCEVcells (P empty vector cells), and normal LECs were collected and used in the experiment. Real-time quantitative PCR and Western blotting were used to detect the mRNA and protein expression levels of lymphatic endothelium-related molecules VEGF-C, VEGF-D, VEGFR-3, NRP-2, PDPN, LYVE-1 and SOX18 in co-cultured LECs. The lymphatic endothelium-related molecular localizations in co-cultured LECs were detected by cell immunofluorescence method, and the levels of VEGF-C and VEGF-D in cell supernatant were detected by ELISA. The lymphatic tube formation test was used to measure the number of lymphangiogenesis nodes and the total length of lymphangiogenesis branches.The expression levels of VEGF-C, VEGF-D, VEGFR-3, NRP-2, PDPN, LYVE-1, and SOX18 at mRNA and protein levels were higher in L-P and L-F than in LECs (all<0.05), and those were higher in L-F than in L-P (all<0.05). Compared with L-FSHUSand L-PNCEV, the expression of the above molecules was lower in L-FA7 DOWN(<0.05), and was higher in L-PA7UP(<0.05). After ANXA7 regulation, the relative expression levels of VEGF-C, VEGFR-3, and PDPN in each co-cultured LEC group were significantly higher than those of similar molecules (VEGF-D, NRP-2, and LYVE-1/SOX18)(all<0.05). VEGF-C and VEGF-D were mainly expressed in the cytoplasm. VEGFR-3/NRP-2 was mainly expressed in cell membrane and a little in cytoplasm. PDPN and LYVE-1 were mainly expressed in cytoplasm. SOX18 was mainly expressed in the nucleus and a little in the cytoplasm. Before ANXA7 regulation, in the secretion of VEGF-C and VEGF-D in cell supernatant, L-F and L-P was higher than LECs, L-F was higher than L-P (all<0.05), and meanwhile, the expression of VEGF-C was higher than the expression of VEGF-D (all<0.05). Before and after ANXA7 regulation, the relative expression change of VEGF-C in each cell supernatant was more significantly than that of the same molecule (VEGF-D)(<0.05). L-F and L-P had larger node number and longer total branch length than LEC, while L-F had larger node number and longer total branch length than L-P (all<0.05); L-FA7DOWNhad smaller node number and shorter total branch length than L-FSHUS(<0.05), and L-PA7UPhad larger node number and longer total branch length than L-PNCEV(all<0.05).High lymphatic metastasis potential and up-regulation of ANXA7 can promote the expression of lymphatic endothelial related molecules and increase lymphangiogenesis ability of LECs co-cultured with hepatocellular carcinoma cells.
hepatocarcinoma cells; lymphatic endothelial cells; co-culture in vitro; lymphatic metastasis potential; Annexin A7; lymphatic endothelium-related molecules; lymphatic tube formation
10.3969/j.issn.1002-266X.2022.28.001

R735.7
A
1002-266X(2022)28-0001-06
国家自然科学基金资助项目(81071725)。
王静文(1983-),女,博士,主要研究方向为病理学、肝癌淋巴道转移。E-mail: 5020200866@nankai.edu.cn
唐建武(1953-),男,硕士,教授,主要研究方向为病理学、肝癌淋巴道转移。E-mail: jianwutang@163.com
(2022-04-20)
