TGF-β1对大鼠支气管成纤维细胞IL-6、IL-8及CCL20表达的影响
2022-10-14温冬梅顾延会余思源芮奎欧阳瑶
温冬梅,顾延会,余思源,芮奎,欧阳瑶
TGF-β1对大鼠支气管成纤维细胞IL-6、IL-8及CCL20表达的影响
温冬梅,顾延会,余思源,芮奎,欧阳瑶
遵义医科大学附属医院PCCM呼吸一病区,贵州遵义 563000
探讨转化生长因子-β1(TGF-β1)对大鼠支气管成纤维细胞IL-6、IL-8及CC亚族趋化因子配体20(CCL20)表达的影响。体外分离培养正常大鼠支气管成纤维细胞,随机分为空白对照组及TGF-β1干预1、2、3组。空白对照组中加入DMEM培养基3 mL,TGF-β1干预1、2、3组分别加入已配好的TGF-β1浓度为5、10、20 ng/mL的含血清DMEM培养基3 mL,分别放入CO2细胞培养箱继续孵育2、12、24、48 h,收集细胞培养物上清,采用ELISA法检测各组支气管成纤维细胞上清中IL-6、IL-8及CCL20。TGF-β1干预1组干预2 h时,大鼠支气管成纤维细胞上清中IL-6水平高于空白对照组(<0.05),其余时段低于空白对照组(均<0.05);TGF-β1干预1组干预24 h时,大鼠支气管成纤维细胞上清中IL-8水平高于空白对照组(<0.05),其余时段低于空白对照组(均<0.05);TGF-β1干预1组干预12、24、48 h时CCL20水平均低于空白对照组(均<0.05)。TGF-β1干预2组在各时段大鼠支气管成纤维细胞上清中IL-6、IL-8及CCL20水平均低于TGF-β1干预1组(均<0.05)。TGF-β1干预3组干预2、12 h时支气管成纤维细胞上清中IL-8水平高于TGF-β1干预2组(均<0.05),之后低于TGF-β1干预2组(均<0.05);TGF-β1干预3组干预2 h时支气管成纤维细胞上清中IL-6水平高于TGF-β1干预2组(<0.05),之后12、24 h低于TGF-β1干预2组(均<0.05),48 h时高于TGF-β1干预2组(<0.05);TGF-β1干预3组在各时段大鼠支气管成纤维细胞上清中CCL20水平均低于TGF-β1干预2组(均<0.05)。TGF-β1对IL-6及IL-8的释放有诱导作用亦有抑制作用,总体以抑制作用为主,呈时间和浓度依赖性。TGF-β1以浓度和时间依赖的方式抑制大鼠支气管成纤维细胞CCL20表达。
转化生长因子-β1;支气管成纤维细胞;白细胞介素;大鼠
慢性阻塞性肺疾病(慢阻肺)是可防治的以持续性气流受限为主要特征的慢性肺部疾病,症状表现为咳嗽、咳痰、气促等[1-2],在其多种发病机制中炎症仍是核心机制。近年研究发现,转化生长因子-β1(TGF-β1)可参与、介导多种炎症和气道重塑,TGF-β1可能在慢阻肺的发生、发展中有一定的作用。TGF-β1在呼吸系统组织内广泛存在,是一种重要的致纤维化生长因子及炎性介质,参与调控细胞增殖、凋亡、分化,调节机体的免疫功能及炎症反应等[3]。研究表明,TGF-β1与多种成纤维细胞作用密切相关,TGF-β1作用的主要靶细胞为成纤维细胞[4]。当前支气管成纤维细胞已成为研究热点。既往研究认为,支气管成纤维细胞主要作为结构细胞在气道重塑中发挥重要作用,而在气道重塑过程中支气管成纤维细胞可否作为炎症细胞参与气道炎症仍不明确。目前,TGF-β1对成纤维细胞在促纤维化方面已有较多研究,但TGF-β1对成纤维细胞在炎症方面的研究甚少。为进一步探索支气管成纤维细胞产生炎症细胞因子是否受TGF-β1的影响,2019年10月—2021年8月通过体外实验探讨TGF-β1在不同浓度、不同时间对支气管成纤维细胞产生炎症细胞因子的影响。
1 材料与方法
1.1材料SPF级SD大鼠,雄性,体质量110~160 g,(大鼠许可证号 00024737,购自第三军医大学大坪医院实验动物中心)。牛血清白蛋白、Ⅰ型胶原酶、木瓜蛋白酶均由Sigma公司提供;胰蛋白酶(Gibco公司),山羊血清(Solarbio公司),DMEM培养基、胎牛血清均由Gibco公司提供;DAPI溶液、双抗(青霉素和链霉素)、PBS粉剂、DMSO、CCK8、4%多聚甲醛溶液、4,6-联脒-2-苯基吲哚(DAPI)均由Solarbio 公司提供;FITC标记的羊抗小鼠二抗、波形蛋白免疫荧光一抗均由BOSTER公司提供;转化生长因子-β1(TGF-β1)由Proteintech公司提供,离心管、T25细胞培养瓶、培养皿(NEST产品);大鼠白细胞介素-8(IL-8)ELISA kit(北京诚林生物),大鼠白细胞介素-6(IL-6)ELISA kit、大鼠CC亚族趋化因子配体20(CCL20)ELISA kit均由上海江莱生物科技有限公司提供。
1.2大鼠支气管成纤维细胞提取和培养取健康SD大鼠,颈椎脱臼法处死,在超净工作台内取出连带心肺的气管组织,于含有双抗的 PBS玻璃皿中洗涤3~5次。用眼科弯镊取得支气管组织,用眼科剪剪成小组织块,加入胶原酶联合消化液置于37 ℃、5%CO2的细胞培养箱中消化30~40 min,850 r/min离心6 min,吸弃上清液。再加入高糖DMEM培养液,将培养瓶置于CO2细胞培养箱中,37 ℃、5%CO2饱和湿度条件下静置培养。当细胞生长至75%~85%时进行传代,取第3代细胞进行实验。
1.3大鼠支气管成纤维细胞纯度鉴定取第3代大鼠支气管成纤维细胞,接种到6孔板中,置于37 ℃、5%CO2的细胞培养箱中直至细胞贴壁。予以4%多聚甲醛1 mL加入到6孔板中,室温下固定20 min,再予以1 mL 0.3% Triton - X100于室温下透化破膜10 min;室温下将山羊血清封闭30 min,弃去血清并滴加稀释比为1∶100的一抗波形蛋白500 µL置于4 ℃冰箱并过夜。放置18~24 h后从4 ℃冰箱中取出六孔板进行复温20~30 min后弃一抗,避光条件下加入羊抗小鼠抗体,予以FITC 标记,稀释比为1∶100,室温及避光条件静置70~80 min后丢弃二抗,再加入DAPI复染核10 min,以上操作每步均用PBS漂洗3次,每次3 min。洗去DAPI后荧光显微镜下拍照。经Vimentin 免疫荧光细胞化学染色后结果示,anti-α-SMA 染色呈阴性,而波形蛋白呈阳性表达Vimentin表达为阳性,培养的第3代大鼠支气管成纤细胞阳性率较高,达95%以上,细胞纯度高,可用于后续实验。
1.4大鼠支气管成纤维细胞增殖测定取第3代大鼠支气管成纤维细胞,于96孔板中每孔加入100 μL,以5×104/mL的密度计数细胞悬液进行接种,置于37 ℃、5%CO2培养箱中直至细胞生长贴壁后,加入无血清DMEM 培养液同步化24 h,隔天再以10 μL/孔加入CCK-8试剂,于37 ℃、5%CO2培养箱中孵育1 h,用CCK-8法通过酶标仪测定450 nm波长OD值,连续检测7 d,将细胞培养天数作为横坐标,OD值平均值作为纵坐标,绘制生长曲线。
1.5细胞上清中IL-6、IL-8及CCL20检测采用ELISA法。取生长状态良好的第3代大鼠支气管成纤维细胞,在T25组织培养瓶中将DMEM培养基(20%胎牛血清)调整细胞密度为1×105/mL进行接种;直至细胞生长贴壁后,随机分为空白对照组及TGF-β1干预1、2、3组。弃去原培养基,于空白对照组中加入DMEM培养基3 mL,TGF-β1干预1、2、3组分别加入已配好的TGF-β1浓度为5、10、20 ng/mL的含血清DMEM培养基3 mL,分别放入CO2细胞培养箱继续孵育2、12、24、48 h后,吸取培养液进行配平,2 500 r/min、4 ℃离心机(离心半径8.2 cm)离心20 min,吸取上清液保存于-20 ℃冰箱。收集细胞上清,ELISA法检测上清中IL-6、IL-8及CCL20,加入待测样品、温育、洗涤、酶标试剂、洗涤、显示、终止、450 nm波长测OD值。
2 结果
2.1大鼠支气管成纤维细胞体外培养结果传代24 h后观察到细胞黏附于培养瓶,形态为近似梭形或三角形。第3天,大部分细胞变成梭形,偶有多边形细胞。第5天,细胞单层融合,胞质伸展,胞质丰富,细胞形态呈长梭形,三角形,多边形,有突起,可见多数核分裂像,并聚集成团生长。第7天,随着成纤维细胞的融合,细胞快速生长,胞体变得细长并呈线性、放射状或栅栏状起伏,部分区域可堆叠成多层生长。
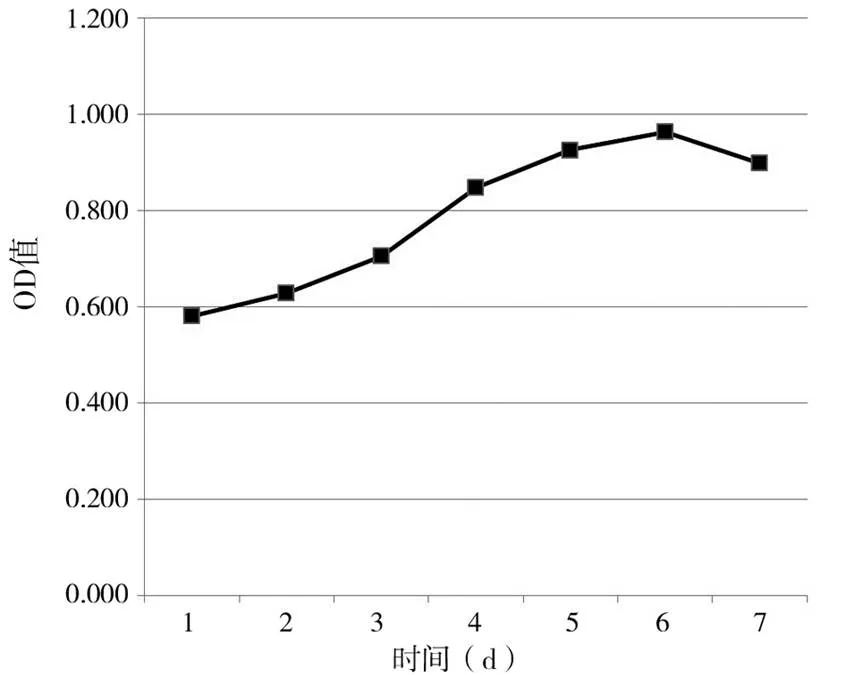
图1 大鼠支气管成纤维细胞生长曲线
2.2大鼠支气管成纤维细胞生长曲线第1~2天为细胞适应期,生长相对较慢;第3~6天是细胞对数生长期且生长相对较快;第6天生长达到高峰;第7天细胞进入生长平台期,细胞增殖减慢,活性下降。生长曲线近似于“ S ”形。见图1。
2.3四组不同时点大鼠支气管成纤维细胞培养上清IL-8水平比较见表1。
表1 四组不同时点大鼠支气管成纤维细胞培养上清IL-8水平比较(ng/L,± s)
注:与空白对照组比较,*<0.05;与TGF-β1干预1组比较,#<0.05;与TGF-β1干预2组比较,△<0.05。
2.4四组不同时点大鼠支气管成纤维细胞培养上清IL-6水平比较见表2。
表2 四组不同时点大鼠支气管成纤维细胞培养上清IL-6水平比较(ng/L,± s)
注:与空白对照组比较,*<0.05;与TGF-β1干预1组比较,#<0.05;与TGF-β1干预2组比较,△<0.05。
2.5四组不同时点大鼠支气管成纤维细胞培养上清CCL20水平比较见表3。
表3 四组不同时点大鼠支气管成纤维细胞培养上清CCL20水平比较(ng/L,± s)
注:与空白对照组比较,*<0.05;与TGF-β1干预1组比较,#<0.05;与TGF-β1干预2组比较,△<0.05。
3 讨论
本课题组前期研究发现,TGF-β1属于Treg相关抗炎因子,主要作为炎症抑制剂参与炎症反应,但仍存在争议,因为TGF-β1在炎症方面具有抗炎和促炎双重作用而参与炎症反应与免疫应答。当前TGF-β1与成纤维细胞的关系在多种纤维化疾病中有大量研究,但在炎症方面的研究较少。
研究发现,IL-6在慢阻肺患者血清中会显著升高,慢阻肺患者血清IL-6与第一秒用力呼气量占用力肺活量的百分比呈负相关,并且与长期慢性炎症反应有关。而在急性加重期升高更明显,IL-6是炎症急性期合成的重要介质,与慢阻肺的进展有关。慢阻肺患者炎症状态下可引起炎性细胞活化,释放IL-6,可破坏肺结构并促进中性粒细胞的炎症反应[5]。IL-8是趋化因子家族成员,与慢阻肺的中性粒细胞型炎症密切关联,主要参与急性炎症反应的发生发展。研究发现,在慢阻肺急性加重期患者中IL-8表达显著高于慢阻肺稳定期者及健康对照者[6-7]。本研究通过设立TGF-β1对支气管成纤维细胞作用的浓度梯度及时间梯度,应用ELISA方法检测,结果发现空白对照组支气管成纤维细胞中有IL-6、IL-8表达。这与既往研究结果一致[8]。支气管成纤维细胞可分泌IL-6、IL-8,在TGF-β1浓度为5 ng/mL及作用2 h 时可上调IL-6分泌,在TGF-β1浓度为5 ng/mL及作用24 h 时可上调IL-8分泌,其余各组下调IL-6、IL-8的分泌,总体上各实验组中IL-6、IL-8水平与TGF-β1存在浓度和时间依赖性,本研究结果有异于其他学者。GOULET等[9]发现,在体外TGF-β1浓度为2.5 ng/mL干预人肺成纤维细胞24 h后上调IL-6、IL-8的分泌。而GE等[10]发现,在体外TGF-β1浓度为0.1~5 ng/mL干预人支气管上皮细胞72 h后上调IL-6、下调IL-8分泌,与TGF-β1呈剂量依赖性。对于在体外予以TGF-β1干预不同细胞后对IL-6、IL-8产生的差异。可能与TGF-β1干预浓度、持续时间不同以及选择不同细胞类型相关。TGF-β1对IL-6、IL-8的作用可能是细胞类型特异性的,凸显了支气管成纤维细胞与其他细胞类型之间具有炎症方面的差异。TGF-β1对炎性因子具有促进和抑制作用,但以抑制作用为主,TGF-β1一定程度上可作为支气管成纤维细胞的抑炎因子,或可抑制慢阻肺炎症反应,有待进一步探索。
CCL20被称为巨噬细胞炎性蛋白3α,是一种趋化性极强的细胞因子,其唯一的受体是趋化因子受体6(CCR6),DCs在气道周围的积聚与慢阻肺严重程度密切相关,CCL20可通过CCR6 趋化树突状细胞(DCs)迁移至气道参与炎症反应[11-12]。本研究发现,TGF-β1可下调CCL20的分泌,TGF-β1对CCL20的分泌存在时间及浓度依赖性。CCL20的分泌降低可减少DCs的聚集和活化,TGF-β1对支气管成纤维细胞中CCL20的分泌减少可能有助于纠正DCs造成的气道免疫微环境紊乱。
综上所述,支气管成纤维细胞或可作为炎症细胞参与气道炎症反应,TGF-β1对IL-6及IL-8的释放有诱导作用亦有抑制作用,总体以抑制作用为主,呈时间和浓度依赖性,TGF-β1对L-6及IL-8分泌的减少可能有助于减轻炎症反应。TGF-β1以浓度和时间依赖的方式抑制大鼠支气管成纤维细胞CCL20表达,TGF-β1对支气管成纤维细胞CCL20的抑制作用可能会参与慢阻肺DCs介导的炎症微环境改变。
[1] TENGVALL S,OHLSSON C,BYGDELL M , et al. Pubertal-onset overweight and COPD in men: a cohort study[J]. ERJ Open Research, 2020,6(1):00326-2019.
[2] 李春达,陶学芳.慢性阻塞性肺疾病伴肺结核患者炎症因子变化及其与结核病变的关系[J].国际流行病学传染病学杂志,2019,46(2):122-125.
[3] 康玉华,杨宇,王宝家,等.小承气汤对烟熏法诱导慢性支气管炎模型大鼠 TGF-β1/Smad3 信号通路的影响[J].中华中医药杂志,2015,30(10):3644.
[4] SCHAAFSMA D, MCNEILL K D, MUTAWE M M, et al. Simvastatin inhibits TGFβ1-induced fibronectin in human airway fibroblasts[J]. Respir Res, 2011,12(1):113.
[5] 郭义娟,朱晖,韩永生,等.慢性阻塞性肺疾病稳定期患者血清PCT、IL-6、hs-CRP、PSP/Reg水平变化对病情的预测价值[J].解放军预防医学杂志,2018,36(4):4.
[6] ZHANG J, BAI C. The Significance of Serum Interleukin-8 in Acute Exacerbations of Chronic Obstructive Pulmonary Disease[J]. Tanaffos, 2018,17(1):13-21.
[7] WALANA W, YE Y , LI M , et al. IL-8 antagonist, CXCL8(3-72)K11R/G31P coupled with probiotic exhibit variably enhanced therapeutic potential in ameliorating ulcerative colitis[J]. Biomed Pharmacother, 2018,103:253.
[8] KSENIJA B, LEET J P ,STEPHANE E, et al. Eosinophil degranulation products drive a pro-inflammatory fibroblast phenotype[J]. J Allergy Clin Immunol, 2018,142(4):1360-1363.e3.
[9] GOULET S,BIHL M P, GAMBAZZI F, et al. Opposite effect of corticosteroids and long-acting beta(2)-agonists on serum- and TGF-beta(1)-induced extracellular matrix deposition by primary human lung fibroblasts[J]. J Cell Physiol, 2007,210(1):167-176.
[10] GE Q, MOIR L M, BLACK J L, et al. TGF-β1induces IL-6 and inhibits IL-8 release in human bronchial epithelial cells: the role of Smad2/3[J]. J Cell Physiol, 2010, 225(3):846-854.
[11] BRAND O J, SOMANATH S, MDERMANS C, et al. Transforming Growth Factor-β and Interleukin-1β Signaling Pathways Converge on the Chemokine CCL20 Promoter[J]. J Biol Chem, 2015,290(23):14717-14728.
[12] LEE A Y, PHAN T K , HULETT M D, et al. The relationship between CCR6 and its binding partners: does the CCR6-CCL20 axis have to be extended[J]. Cytokine, 2015,72(1):97-101.
Effect of TGF-β1on expression of IL-6, IL-8, and CCL20 in rat bronchial fibroblasts
,,,,
,,563000,
To investigate the effects of transforming growth factor-β1(TGF-β1) on the expression levels of interlukin (IL)-6, IL-8 and CC chemokine ligand-20 (CCL20) in rat bronchial fibroblasts.Normal rat bronchial fibroblasts were isolated and cultured in vitro, and randomly divided into blank control group and TGF-β1intervention groups 1, 2 and 3. In the blank control group, 3 mL of DMEM medium was added; in the TGF-β1intervention groups 1, 2 and 3, serum-containing DMEM medium with 5, 10 and 20 ng/mL TGF-β1(3 mL in each) were added, respectively, and they were incubated in a CO2cell incubator for 2, 12, 24, and 48 h. The supernatants of the cell cultures were collected and measured by ELISA. IL-6, IL-8 and CCL20 in the supernatants of bronchial fibroblasts were detected by ELISA.The level of IL-6 in the supernatant of rat bronchial fibroblasts was higher than that of the blank control group at 2 h of TGF-β1intervention (<0.05) and was lower than that of the blank control group at the rest of the time (all<0.05). The level of IL-8 in the supernatant of rat bronchial fibroblasts was higher than that of the blank control group at 24 h of TGF-β1intervention (<0.05) and was lower than that of the blank control group at the rest of the time (all<0.05). The level of CCL20 in TGF-β1intervention group 1 was lower than that in blank control group at 12, 24, and 48 h. The levels of IL-6, IL-8 and CCL20 in rat bronchial fibroblast supernatants were lower in TGF-β1intervention group 2 than in TGF-β1 intervention group 1 at 12, 24 and 48 h (all<0.05). The level of IL-8 in bronchial fibroblast supernatant was higher in the TGF-β1intervention group 3 than in the TGF-β1intervention group 2 at 2 and 12 h (both<0.05), and it was lower than that in the TGF-β1intervention group 2 afterwards (<0.05); the level of IL-6 in bronchial fibroblast supernatant was higher in the TGF-β1intervention group 3 than in the TGF-β1intervention group 2 at 2 h (<0.05), and it was lower than that in the TGF-β1intervention group 2 afterwards (<0.05), and was higher than that in the TGF-β1intervention group 2 (<0.05). The level of CCL20 in the supernatant of bronchial fibroblasts of rats in the TGF-β1intervention group 3 was lower than that in the TGF-β1intervention group 2 at all times (<0.05).TGF-β1can induce and inhibit the release of IL-6 and IL-8, and the inhibitory effect is the main one, with a time- and concentration-dependent manner. TGF-β1inhibits CCL20 expression in rat bronchial fibroblasts in a concentration- and time-dependent manner.
transforming growth factor-β1; bronchial fibroblasts; interleukin; rats
10.3969/j.issn.1002-266X.2022.28.005
R563
A
1002-266X(2022)28-0020-04
(2022-06-05)
国家自然科学基金资助项目(82060005);遵义市科学技术局课题[遵市科合社字(2018)-74]。
温冬梅(1994-),女,硕士,主要研究方向为COPD的发病机制。E-mail: 1325593215@qq.com
欧阳瑶(1965-),女,硕士,主任医师,主要研究方向为COPD的发病机制。E-mail: ouyangyao116@sohu.com
