结直肠癌伴巨大卵巢转移报告1例并文献复习
2022-10-14吴晓涵杨晓倩陈绍水
张 坤 韩 霞 吴晓涵 杨晓倩 陈绍水
滨州医学院附属医院肿瘤科,山东滨州 256600
结直肠癌(colorectal cancer,CRC)是世界上第三大最常见的癌症,也是癌症相关死亡的第二大原因[1]。在诊断时,大约有20%的大肠癌患者已发展成转移性疾病,肝、肺、骨和脑是受影响最大的器官[2-3]。CRC中卵巢转移(ovarian metastases,OM)的全球患病率为2.7%,其中孤立性卵巢转移患者不超半数。结直肠癌卵巢转移患者无一存活超过5年[4]。15%~20%的卵巢恶性肿瘤为转移性,最常见的原发肿瘤部位为大肠、乳腺、子宫体、子宫颈和胃[5]。卵巢转移在大多数情况下无特定的临床表现,通常在后续的影像学检查中被发现[5]。本文报道1例结直肠癌术后6个月余因“腹胀”就诊的卵巢转移患者病例并文献复习。
1 病例资料
患者女,49岁,因“大便习惯改变3个月”于2020年10月10日就诊于当地医院,行肠镜检查示:距肛门10 cm处见不规则隆起及溃疡,肠腔狭窄,肠镜活检病理示:(结肠)腺癌,排除禁忌于2020年10月14日行腹会阴联合结直肠癌切除术+乙状结肠造瘘术,术中见:肿瘤上缘达腹膜折返以上,大小约10 cm×8 cm×5 cm,质硬,侵出浆膜层,与侧腹膜及子宫后壁少许浸润。术后恢复良好,于2020年10月24日出院。出院后患者未行抗肿瘤治疗,后因“腹胀伴轻度喘憋”于当地医院行腹部电子计算机断层扫描(computer tomography,CT)示:结直肠癌术后,肝内低密度,考虑转移瘤,附件区囊性病灶,盆腔囊性占位。建议转上级医院治疗,遂于2021年5月5日就诊我科,行腹腔穿刺引流,腹腔积液病理示:涂片及沉渣内查见糖类抗原199(carbohydrate antigen 19-9,CA199)(+)细 胞,支持恶性,腺癌,消化道发生,MC-,CR-,Vimentin-,CK7- ,CK20-,CA199+, Villin-,CDX-2-,PAX-8-。完善基因检测提示RAS/BRAF均为野生型。后请胃肠外科及妇科会诊提示暂不宜行手术治疗,因患者拒绝应用西妥昔单抗,遂给予贝伐珠单抗+FOLFOX方案治疗7周期,末次治疗结束于2021年8月28日出院。2021年9月8日再次入我科,因拟行手术治疗,给予停用贝伐珠单抗,行FOLFOX方案继续化疗3周期,末次化疗结束于2021年10月22日出院。化疗期间定期复查CT提示肝脏及盆腔占位明显缩小(图1)。2021年11月9日就诊妇科,排除手术禁忌行经腹全子宫+双侧附件切除术,术中见:盆腹腔无明显积液,盆腹腔巨大肿物,直径约15 cm,与子宫后壁、左侧盆腔、后腹膜片状致密粘连使左侧宫旁组织、左侧骶韧带增厚、结节感,钝、锐分离粘连后见肿物来源于右侧卵巢并与左侧卵巢浸润性粘连,囊实性,内含黄绿色混浊液体,右侧输卵管匍匐其上,左侧卵巢轮廓不清,表面结节感。切除全子宫+双侧附件(图2),术后病理(图3):(附件肿物)腺癌,免疫组化结果:CK7-,CK20+,CA199+ ,Villin+,CDX-2+,Ki-67约60%。患者术后继续行FOLFOX+贝伐珠单抗治疗2周期,后续给予卡培他滨+贝伐珠单抗维持治疗,针对肝脏病变拟行微波消融治疗。
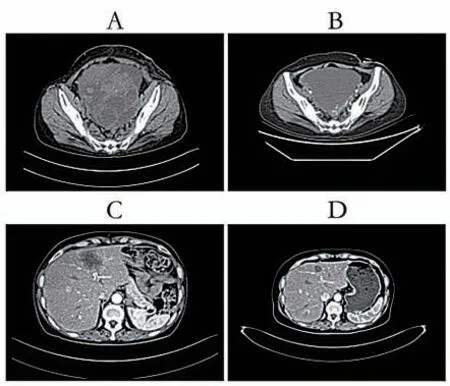
图1 治疗前后盆腔及肝脏CT
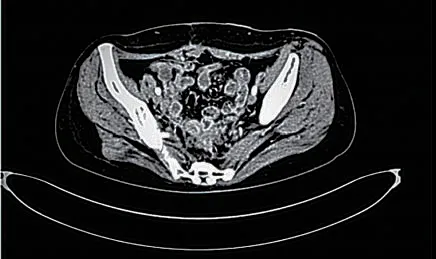
图2 术后盆腔CT

图3 术后病理
2 讨论
本报告是一例罕见的结直肠癌术后6个月余发生的异时性巨大双侧卵巢并肝脏转移患者,经由手术标本行病理检查确诊,确诊年龄49岁,患者术前行FOLFOX+/-贝伐珠单抗行新辅助治疗,治疗期间主要通过CT评估治疗效果,患者治疗期间CT评估盆腔及肝脏占位缩小,且癌胚抗原(carcinoembryonic antigen,CEA)总体呈下降趋势,证明术前治疗有效,同时进一步为卵巢肿块来源于结直肠提供证据。Zhou R等[6]研究发现绝经前(<50岁)和结肠癌患者更容易发生OM,且双侧卵巢受累和合并卵巢外转移更为常见。徐婷等[7]认为,OM-CRC患者的不良预后与肿瘤双侧卵巢转移、腹腔脱落细胞学检查阳性或腹膜种植转移、合并其他部位转移相关,而与年龄和月经状态、肿瘤大小、同/异时性转移、 病理类型、肿瘤标志物水平的关系尚无确切定论。
2.1 OM-CRC转移途径
OM-CRC的转移途径可能包含以下四种常见方式:种植转移、血行转移、淋巴转移、直接蔓延。多数卵巢转移患者同时合并腹膜转移,并且约50%腹膜转移患者同时有卵巢转移,因此病理学家们推测OM-CRC的常见机制为种植转移。卵巢表面无腹膜,当原发结直肠癌突破浆膜层,可借由重力、坏死脱落等种植于卵巢,此外,绝经前妇女卵巢血运丰富,伴随着周期性排卵,使之成为癌细胞生存良好的场所。卵巢转移多为双侧,女性大肠癌卵巢转移多发生于中青年、绝经前[8],OM肿瘤大多生长在卵巢的深层,不在表面[9],以上发现支持血行转移的观点。卵巢本身富有淋巴管,双侧卵巢之间以及卵巢和结直肠之间存在淋巴管连接,阻断腹膜后淋巴管后,可观察到肿瘤细胞的逆向流动[10],这几点说明肿瘤细胞很可能通过淋巴道转移到卵巢。毋庸置疑,解剖位置越靠近卵巢,越容易发生大肠癌的卵巢转移。赵晓明[8]研究也表明,腹膜返折以上卵巢转移率明显高于腹膜返折以下。本报道病例手术时见肿瘤上缘达腹膜折返以上,且已突破浆膜,不除外肿瘤直接侵犯卵巢的可能。然而结直肠癌发生卵巢转移的确切机制目前尚不明确,多种转移方式同时存在不能除外。
2.2 OM-CRC临床表现
OM-CRC患者早期大多无特异症状,本报道病例直肠癌术后首先以“腹胀”就诊,并无特异表现。多数研究报道,OM-CRC患者可能出现的临床表现为:尿频、腹胀腹痛、便血、阴道流血、消瘦贫血、大便习惯改变等,上述表现除外原发灶病变多可归因于卵巢肿块增大产生的压迫及刺激症状、卵巢转移灶直接侵犯邻近组织、癌性腹腔积液、恶病质等。OM-CRC患者出现腹腔积液需同时警惕腹膜转移的可能,有学者认为腹膜转移与OM-CRC本质相同,可认为腹膜转移是卵巢转移的延续,然而本例报道病例虽有腹水,却未发现确切腹膜转移迹象。
2.3 OM-CRC影像学表现
影像学上,OM-CRC与原发性卵巢癌不易区分。有学者[11]在一项研究中将OM-CRC患者卵巢肿物CT/MRI表现和术后大体表现分为以下四种类型:1型(椭圆形,均质实体);2型(非均质实体,尺寸小,表面多结节);3型(囊实性,实性为主,超过2/3的肿块为实性);4型(囊实性,囊性为主,超过2/3的肿块为囊性,多房性)。1型模仿库肯勃瘤,2型模仿乳腺癌卵巢转移,3型模仿原发性卵巢子宫内膜样癌,4型模仿原发性卵巢黏液癌,具有“彩色玻璃外观”。同样,原发性上皮性卵巢癌也分为四个亚型:浆液性、透明细胞性、子宫内膜样和黏液性。浆液性癌通常为双侧小肿瘤(肿瘤大小<8 cm)[12];1型和2型肿瘤需要与该亚型区分开来。当对原发性卵巢浆液性癌进行鉴别诊断时,CT上砂粒状钙化以及CA125高度升高是对原发性诊断有帮助的提示[13-14]。其他三种亚型表现为单侧大肿瘤[12]。透明细胞癌表现为巨大的单眼囊性肿块伴偏心壁结节[15-16];源于结直肠癌的卵巢转移不具备这种表现形式。子宫内膜样癌由不同比例的实性和囊性成分组成。如果肿瘤主要为实性,并伴有少量囊性成分,则很难将其与3型肿瘤区分开来[12]。黏液癌是一种多房囊性肿块,信号各异[17],不易与4型肿瘤区分。在影像学特征难以鉴别诊断的情况下,建议测量CEA水平。大多数OM-CRC患者的CEA水平升高(>5 ng/ml),有研究显示92%的OM-CRC患者的CEA升高,而之前的一项报告只有4.8%~17.5%的原发性卵巢癌的CEA水平升高[18]。因此,如果卵巢肿瘤患者CEA水平升高,并且从形态学上被分为上述四种类型之一,则应怀疑OM-CRC。
2.4 OM-CRC病理诊断
OM-CRC患者的病理诊断多需借助免疫组化。OM-CRC常 表 现 为CK7(-)/CK20(+),原发性卵巢癌则以CK7(+)/CK20(-)多见[19-21],联合CK7/CK20有助于鉴别原发性卵巢癌与OM-CRC,但因其存在重叠表达现象,降低了CK7/CK20在鉴别诊断中的应用价值。CDX-2在几乎所有OM-CRC和原发性结直肠腺癌组织中呈弥漫强阳性表达,而在原发性卵巢癌中仅少数呈弱阳性表达,提示CDX-2可以作为鉴别原发性卵巢癌及OM-CRC的有效标志物[20-21]。本报道病例术后病理结果支持OM-CRC的诊断。此外,有专家推荐对于 CA125 明显增高,尤其是CA125/CEA>25者,需要警惕卵巢原发肿瘤的诊断[22]。
2.5 OM-CRC治疗及预后
原发灶切除是OM-CRC患者治疗中不可或缺的一部分,多数异时性卵巢转移患者在发现卵巢转移前已行结直肠癌根治术[7],本例患者亦是如此。标准的原发灶根治性切除术能大大提升OM-CRC患者的生存获益。对于无法行根治术的患者,肿瘤细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注 化 疗(hyperthermic intraperitoneal chemotherapy,HIPEC)也是可行的选择。
CRS-HIPEC的临床效益毋庸置疑。对OM患者行CRS具有以下优点:①明显改善患者的临床症状;②结直肠肿瘤的组织病理形态及分期与卵巢病灶不太相符时,可鉴别卵巢病灶为原发或转移;③可改善患者预后,即便是无法根治性切除的患者,切除卵巢转移瘤也可以有效地减少肿瘤负荷,为后续化疗创造良好的条件[23]。Bakkers C等[24]的研究发现接受CRS-HIPEC患者的总生存期(overall survival,OS)明显长于仅接受原发灶切除的患者[(中位OS 34.1个 月vs 17.5个月,校正HR 0.44(0.33~0.66)]。接受CRS-HIPEC治疗的患者的五年生存率为28.5%,接受原发肿瘤切除的患者为11.0%,接受姑息治疗的患者为1.2%,未接受治疗的患者为0。
预防性卵巢切除在OM-CRC患者中的应用暂无统一定论。预防性卵巢切除可避免异时性卵巢转移的发生,但与之相伴随的卵巢分泌相关激素的减少必定给患者带来新的忧虑。有学者建议,对于高危卵巢转移患者[卵巢转移危险因素[25]:血清CEA>5 ng/ml,附件肿块>5 cm,双侧附件肿块和腹膜癌指数(peritoneal cancer index,PCI)评分>7分)],可向患者及家属说明预防性卵巢切除术的优缺点,结合患者及其家属意见,通过综合考量确定是否实施预防性卵巢切除术。Sianesi等[26]建议对年龄在60~70岁的绝经后左半结肠癌或直肠癌患者进行预防性卵巢切除术,在这些患者中,异时性OM的风险增加,与之相关联的OS降低。
相对于原发灶或其他转移灶,多数学者报道卵巢转移灶对化疗药物反应性差,然而术前及术后化疗在本报道病例中却都体现了一定疗效。Al-Busaidi等[27]的研究表明,OM-CRC患者中位生存率的提高与术后辅助化疗相关;在多变量分析中,辅助化疗是唯一与预后改善相关的独立因素(P=0.01)。Hamasaki等[28]的研究同样表明术后化疗可有效改善患者的预后。Goéré等[29]发现术前化疗可控制可测量的卵巢外转移,但却未观察到卵巢转移灶对化疗的客观反映,只有13%的患者病情稳定,其余患者都出现了进展或新的卵巢转移(P=0.0005)。
基因层面,Ganesh等[30]发现KRAS、SMAD4和NTRK1突变在OM-CRC病例中比在无OM的CRC病 例 中 更 频 繁。SMAD4和KMT2D突 变 与OS降低具有相关性。SMAD4的功能丧失改变是OM-CRC患者生存率降低的常见预测因素。对于OM-CRC患者基因层面的研究相对较少,未来需要加大对此方面的研究,进而为OM-CRC患者提供更优质、更精确的基因靶向治疗服务。
综上,OM-CRC及其患者具有以下临床特点:发病率低、恶性度高、诊断困难、治疗尚缺乏统一标准、临床预后差等。对于OM-CRC,虽有多数学者前赴后继对其临床特征进行探索,但所得结论多需进一步验证。关于OM-CRC目前尚缺乏大样本、多中心的临床研究。对于OM-CRC未明确诊断者,本文通过病例报道及文献复习提供了一些有助于进一步明确诊断的方法;对于OM-CRC明确诊断者,个体化治疗方案应由肿瘤内科、胃肠外科、妇科医师行多学科会诊(multiple disciplinary team,MDT)制订,治疗上目前仍以手术(根治术、CRS-HIPEC)为主,并辅以术前、术后化疗。预防性卵巢切除术的应用要遵循个体化原则,综合考量。对于更深层次基因方面的研究,有待进一步探索。
