基于NF-κB/STAT信号通路探究朱砂根治疗大鼠急性咽炎的作用机制
2022-10-14何倩倩党兆岩刘雄利
权 伟,刘 畅,周 英,何倩倩,石 洋,党兆岩,刘雄利, 2*
基于NF-κB/STAT信号通路探究朱砂根治疗大鼠急性咽炎的作用机制
权 伟1,刘 畅1,周 英1,何倩倩1,石 洋1,党兆岩1,刘雄利1, 2*
1. 贵州中医药大学药学院 药食两用资源应用与开发研究中心,贵州 贵阳 550025 2. 贵州大学 西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025
建立大鼠急性咽炎模型并结合网络药理学,基于核因子-κB(nuclear factor-κB,NF-κB)/信号传导及转录激活因子(signal transducer and activator of transcription,STAT)信号通路探讨朱砂根干预大鼠急性咽炎的作用机制。通过网络药理学方法预测朱砂根干预急性咽炎的靶点,构建活性成分-靶点、靶点-通路网络。构建急性咽炎大鼠模型,检测大鼠血清中白细胞介素-6(interleukin-6,IL-6)、前列腺素E2(prostaglandin E2,PEG2)和IL-10水平;采用qRT-PCR检测大鼠咽部组织中半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,)、、、蛋白酪氨酸性磷酸非受体型11(protein tyrosine phosphatase nonreceptor 11,)、蛋白激酶B1(protein kinase B1,)和Janus激酶2(Janus kinase 2,)mRNA表达;采用Western blotting检测大鼠咽部组织中AKT1、JAK2和Caspase-8蛋白表达。网络药理学研究显示,朱砂根主要活性成分与急性咽炎有168个交集靶点,主要作用于NF-κB/STAT信号通路。与模型组比较,朱砂根组大鼠血清中IL-6和PEG2水平明显降低(<0.01),IL-10水平显著升高(<0.05、0.01);咽部组织、、、、和mRNA表达水平均显著降低(<0.05、0.01),Caspase-8、AKT1和JAK2蛋白表达水平均显著降低(<0.05、0.01)。朱砂根中的活性成分可能通过调控NF-κB/STAT信号通路,干预炎症反应并加速巨噬细胞分化、凋亡,从而治疗急性咽炎。
朱砂根;网络药理学;核因子-κB/信号传导及转录激活因子信号通路;急性咽炎;巨噬细胞
急性咽炎在中医中常称作“急喉痹”,表现为咽黏膜及黏膜下组织的突发性炎症,常累及咽部淋巴组织。根据炎症的情况,急性咽炎可分为急性单纯性咽炎、急性坏死性咽炎以及急性水肿性咽炎3类[1-4]。清热解毒类药物是治疗急性咽炎的首选药物[5-6]。中医自古就有“咽喉口腔诸病皆属于火”之说,风寒外袭说是对急性咽炎病因病机的经典认识,以疏风解表、清热解毒为最佳治疗方式,金银花、朱砂根等清热解毒类中药或其有效成分对咽炎具有抑制作用[7]。朱砂根为紫金牛科植物朱砂根Sims的干燥根,《贵州草药》有记载,称其辛微苦涩、平,能清热、利咽化瘀,对咽炎有良好的治疗作用,有喉科良药的美誉[8-10]。朱砂根的化学成分主要为朱砂根皂苷、岩白菜素等,研究发现朱砂根中岩白菜素具有明显的消炎作用[11];朱思[12]通过二甲苯致小鼠耳肿胀和醋酸扭体药理模型发现朱砂根具有显著的抗炎、镇痛活性;现代药理学研究表明朱砂根具有抗菌、抗炎、抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)等作用[13-15]。本课题组前期研究发现,朱砂根中黄酮类、香豆素类成分为其主要活性成分,且含量较为丰富[16]。但目前对朱砂根含有的主要药效成分和其对急性咽炎的作用机制尚不清楚。
核因子-κB(nuclear factor-κB,NF-κB)/信号传导及转录激活因子(signal transducer and activator of transcription,STAT)信号通路是调控炎症因子、刺激巨噬细胞活化的主要通路[17-18]。在炎症反应过程中,STAT和NF-κB通路间存在一定的交互作用,炎性细胞因子产生可能与NF-κB通路激活相关,并减少STAT磷酸化[19]。巨噬细胞是机体内最主要的炎症效应细胞。推测朱砂根可能通过调节通路中某些基因的表达从而调控炎症因子影响巨噬细胞的抗炎能力。因此,本研究基于网络药理学方法[20]预测朱砂根活性成分与急性咽炎之间的关键靶点,筛选得到相关炎症信号通路;建立大鼠急性咽炎模型,检测大鼠血清中白细胞介素-6(interleukin-6,IL-6)、前列腺素E2(prostaglandin E2,PEG2)和IL-10水平,利用qRT-PCR检测大鼠咽部组织中半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,)、、、蛋白酪氨酸性磷酸非受体型11(protein tyrosine phosphatase nonreceptor 11,)、蛋白激酶B1(protein kinase B1,)、Janus激酶2(Janus kinase 2,)mRNA表达,并通过Western blotting检测大鼠咽部组织中Caspase-8、AKT1和JAK2蛋白表达,通过mRNA与蛋白表达水平的变化,探索调控炎症因子关键靶点,讨论朱砂根治疗急性咽炎的药效物质基础,阐明朱砂根干预炎症分子、治疗急性咽炎的作用机制,为其在急性咽炎的临床治疗提供实验依据,为紫金牛属植物的研究提供思路。
1 材料
1.1 动物
SPF级SD大鼠98只,体质量(200±10)g,雌雄各半,由西南医科大学实验动物中心提供,生产许可证号SCXK(川)2018-17。动物于西南医科大学实验动物中心常规饲养3 d。动物实验符合贵州中医药大学实验动物伦理委员会审查批准要求(批准号20210047)。
1.2 药材
实验所用朱砂根选自贵州情人谷,经贵州中医药大学魏升华教授鉴定为紫金牛属植物朱砂根Sims的干燥根。
1.3 药品与试剂
阿莫西林胶囊(批号18112101)购自北京新领先医药科技发展有限公司;IL-6检测试剂盒(批号E02I0006)、PEG2检测试剂盒(批号EK-R38790)、IL-10检测试剂盒(批号1529285272)购自上海茁彩生物科技有限公司;总RNA提取试剂盒(批号U9124)购自北京天根生化科技有限公司;反转录试剂盒(批号00780166)、荧光定量试剂盒(批号00850445)购自美国Thermo Fisher Scientific公司;水合氯醛(批号Q/12HB4218-2017)购自天津市科密欧化学试剂有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号SC-365062)、Caspase-8抗体(批号SC-81656)购自圣克鲁斯生物技术公司;AKT1抗体(批号BS2987)、JAK2抗体(批号BS5769)购自南京巴傲得生物科技有限公司;m-IG Fc BP-HRP二抗购自圣克鲁斯生物技术公司;HRP标记的山羊抗兔IgG抗体购自南京巴傲得生物科技有限公司。
1.4 仪器
Multlskan Mk3型酶标仪、Sorvall Legend Micro 17R型高速冷冻离心机(美国Thermo Fisher Scientific公司);数码三目摄像显微镜(麦克奥迪实业集团);N60系列超微量分光光度计(德国IMPLEN公司);CFX96 Touch型qRT-PCR仪、ChemDoc型凝胶成像仪(美国Bio-Rad公司)。
2 方法
2.1 朱砂根干预大鼠急性咽炎的网络药理学研究
2.1.1 朱砂根活性成分的筛选 由于TCMSP数据库(https://www.tcmsp-e.com)中未收录朱砂根,因此查找朱砂根相关文献,搜集朱砂根化学成分。通过ChemDraw软件画出结构,保存为sdf格式,将文件导入SwissADME数据库(http://www. swissadme.ch/)[21-23],根据胃肠道吸收度作为条件筛选朱砂根的活性成分。
2.1.2 朱砂根活性成分作用靶点的预测和急性咽炎靶点的筛选 将筛选出的朱砂根活性成分Canonical SMILES格式文件导入Swiss Target Prediction平台,将其属性设置为“homo sapiens”,预测活性成分作用的潜在靶点。通过GeneCards数据库(https://www.genecards.org/)、DrugBank数据库(https://go.drugbank.com/)、OMIM数据库(https://omim.org/),以“acute pharyngitis”等关键词检索与急性咽炎相关的基因,再与Uniprot数据库(http://beta.uniprot.org/)进行比对,得到格式完全一致的Gene symbol,删除重复靶点基因,与化合物作用的靶点进行比对,得到二者的交集靶点,即为朱砂根作用于急性咽炎的靶点。
2.1.3 “活性成分-靶点”网络的构建 利用Cytoscape 3.9.0软件构建朱砂根“活性成分-靶点”网络。成分对应靶点的个数用度值来表示,度值越大,成分与靶点直接连线越密集,说明该成分作用于靶点越多,通过大小、明暗、密集程度筛选朱砂根干预急性咽炎的关键成分。
2.1.4 核心靶点之间相互作用网络的构建和通路富集分析 通过String数据库(https://www.string-db.org/)输入交集靶点信息,选择综合得分在0.9以上的靶点,利用Cytoscape 3.9.0软件绘制朱砂根作用于急性咽炎的关键靶点互作网络图,并通过计算度值获得蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,利用Metascape数据库(https://metascape.org/)对关键靶点进行京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,筛选得到有关炎症的通路,通过Cytoscape 3.9.0软件绘制“关键成分-靶点-通路”网络图。
2.2 朱砂根干预大鼠急性咽炎的作用机制
2.2.1 朱砂根水提液的制备 称取200 g朱砂根,加入10倍量水,加热回流提取2次,每次2 h,合并2次滤液,加热浓缩至1 g/mL(以生药量计),于−20 ℃保存备用。
2.2.2 朱砂根水提液的质量控制 参考《中国药典》2020年版对朱砂根水提液进行定性定量检测,色谱条件、对照品制备与药典保持一致,供试品制备方法如下:取20 g朱砂根加10倍量水煎煮2 h,提取2次,合并煎煮液,转移至500 mL量瓶中,加水至刻度,摇匀、滤过,取1 mL滤液至10 mL量瓶中,加水至刻度,摇匀,即得。记录对照品与供试品的HPLC图(图1),二者均在波长275 nm检测到岩白菜素,且保留时间基本完全对应,说明实验所用药材朱砂根为真品;且朱砂根水提液中岩白菜素的质量分数为1.19%,《中国药典》2020年版规定朱砂根中岩白菜素的质量分数为1%,符合药典标准。
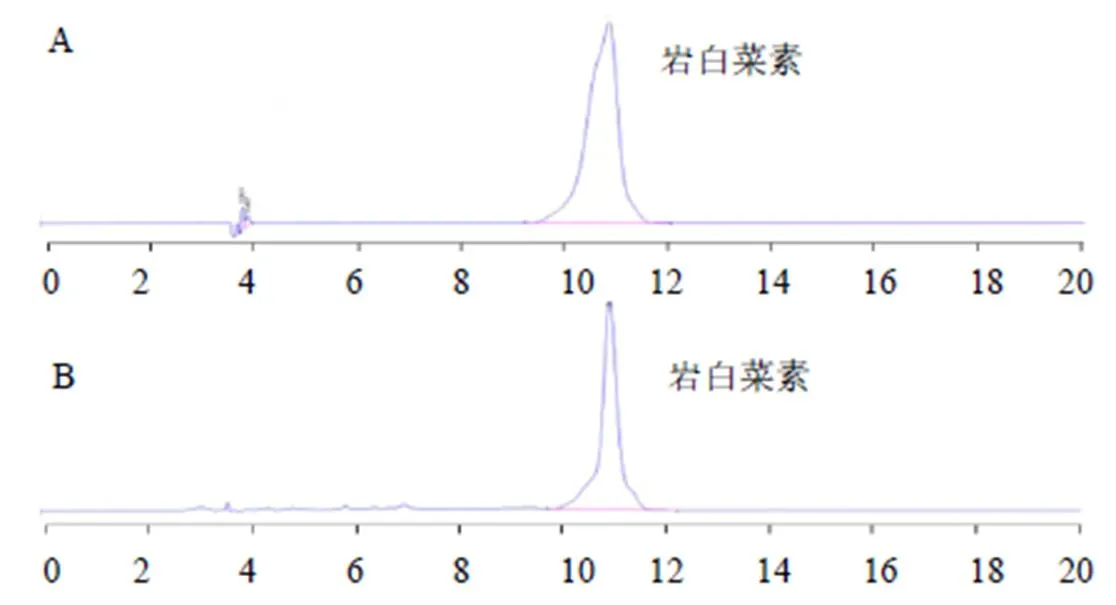
图1 对照品溶液 (A)与朱砂根水提液 (B) 的HPLC图
2.2.3 造模依据与实验剂量确定 根据《中药药效方法学》中氨水致急性咽炎模型方法摸索出合适氨水条件建立大鼠急性咽炎模型。依据《中国药典》2020年版朱砂根的法定剂量上限6~9 g/(人·d),根据人与大鼠的体表面积折算的等效剂量比值0.018,按成人6 g/(人·d)计算得到大鼠的给药剂量为0.54 g/kg(以生药量计)。50只SD大鼠随机分成5组,每组10只,设置5个剂量梯度,分别为4、8、16、32、64倍剂量(2.16、4.32、8.64、17.28、34.65 g/kg),大鼠一次性ig药物进行半数致死量实验,发现64倍剂量组ig药物24 h死亡5只大鼠,其余大鼠均出现抽搐、呆滞等表现;32倍剂量组大鼠状态不佳,出现精神不振、食欲不佳等状况。根据以上实验结果,以4、8、16倍剂量(2.16、4.32、8.64 g/kg)作为给药剂量。
2.2.4 建模与分组 选用48只SD大鼠适应性喂养3 d后,随机分为对照组、模型组、阿莫西林(0.36 g/kg)组和朱砂根低、中、高剂量(2.16、4.32、8.64 g/kg)组。除对照组外,各组大鼠用喷雾器喷一下10%氨水,2次/d,连续3 d,建立急性咽炎模型。造模成功后,各给药组ig相应药物,1次/d,连续7 d,对照组和模型组ig等体积的蒸馏水,记录各组大鼠的体质量,每天根据大鼠的毛发发黄程度、脱毛严重程度、咽部红肿程度观察并记录造模后各组大鼠的一般状态。给药结束后,大鼠禁食12 h,ip 10%水合氯醛(3 mL/kg)麻醉,取大鼠血清和咽部组织,于低温下保存备用。
2.2.5 血清炎症因子指标检测 各组大鼠腹腔主动脉取血5 mL,4 ℃静置1 h,4 ℃、3500 r/min离心15 min,吸取血清,按照试剂盒说明书检测血清中IL-6、PEG2和IL-10水平。
2.2.6 咽部组织病理变化 取各组大鼠咽部组织,用10%多聚甲醛固定,包埋于石蜡中,切片,进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.2.7 qRT-PCR检测咽部组织NF-κB/STAT通路关键基因的表达 根据网络药理学结果选取NF-κB/STAT通路中关键基因,利用qRT-PCR检测其mRNA表达。通过primer3在线软件平台(https://bioinfo.ut.ee/primer3-0.4.0/)设计、、、、、、引物(表1);按照试剂盒说明书提取各组大鼠咽部组织总RNA并合成cDNA,进行qRT-PCR分析。
表1 引物序列
Table 1 Primer sequences
基因引物序列 (5’-3’) Caspase-3F: GCAAAAGGAGCAGTTTTGTGTGTG R: GGCAGGCCTGAATGATGAAGAG Caspase-7F: GCTGAGCCACGGAGAAGAGAAT R: TAGCAGGGTTTTGCATCGGTCT Caspase-8F: AACATGCGGGACAGAAAAGGAA R: TTGCTGTGCAATCACTGAAGGA PTPN11F: CGAGGAGTCGATGGCAGTTTCT R: TTTCCCCGCCATAGAGGTCATA AKT1F: GACCACCGCCATTCAGACTGT R: CACCTCCATCTCCTCAGCACCT JAK2F: TTTCTGATGTTCAGCTCTCACCAA R: CGTGCAGCTGACCATAATCTCC GAPDHF: GGGCTCTCTGCTCCTCCCTGT R: ACGGCCAAATCCGTTCACC
2.2.8 Western blotting检测咽部组织NF-κB/STAT信号通路相关蛋白的表达 根据qRT-PCR结果检测咽部组织Caspase-8、AKT1和JAK2蛋白表达。取对照组、模型组和朱砂根高剂量组大鼠咽部组织,加入含PMSF、蛋白酶抑制剂的RIPA裂解液提取蛋白,加入蛋白缓冲液,于100 ℃恒温水浴10 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭1 h,分别加入AKT1、JAK2、Caspase-8、GAPDH抗体(1∶1000),4 ℃孵育过夜;TBST洗涤3次后,加入二抗(1∶10 000),室温避光孵育1 h;TBST洗涤3次后,使用凝胶成像系统显影,利用Image J软件分析条带灰度值。
3 结果
3.1 朱砂根主要活性成分的获得
在相关文献中搜寻“朱砂根”相关化学成分,得到朱砂根化学成分62种,根据胃肠道吸收度作为筛选条件,5项中有2项及以上为yes筛选条件,共筛选出朱砂根的主要活性成分18种。岩白菜素尚未达到筛选条件,胃肠道吸收度略低,但是在朱砂根的活性成分中起着关键作用,因此,将岩白菜素也列入分析对象中,共筛选得到19个朱砂根的活性成分(表2)。
表2 朱砂根的活性成分
Table 2 Active ingredients of A. crenata
编号化合物 ZSG1美替来托 ZSG2岩白菜素 ZSG3[(7-羟基-4-甲基-2-氧代-2H-色烯-6-基)氧基]乙酸 ZSG4杨梅素 ZSG5墨沙酮 ZSG6七叶内酯 ZSG7槲皮素 ZSG8秦皮素 ZSG94-甲基伞形葡萄糖醛酸 ZSG10二十烷酮 ZSG11紫金牛醌 ZSG12无羁萜 ZSG13β-谷甾醇 ZSG143β,16α-二羟基-30-甲氧基-28,30环氧-齐墩果-12烯 ZSG152,4,6三羟基苯甲酸 ZSG16葛根皂醇 ZSG172α-羟基乌苏酸 ZSG183-羟基-5-甲氧基-苯甲酸 ZSG19正壬酸
3.2 朱砂根活性成分作用靶点的预测及疾病靶点的获得
在SwissTarget Prediction数据库(http://www. swisstargetprediction.ch/)中输入19个朱砂根有效成分,共得到310个有效靶点。通过GeneCards数据库平台,输入“acute pharyngitis”等关键词,搜索与其相关的基因,下载文档处理得到2029个靶基因。利用Venny 2.1.0在线平台绘制疾病靶点与朱砂根活性成分靶点韦恩图,筛选得到朱砂根作用于急性咽炎的靶点168个。
3.3 “活性成分-靶点”网络的构建与分析
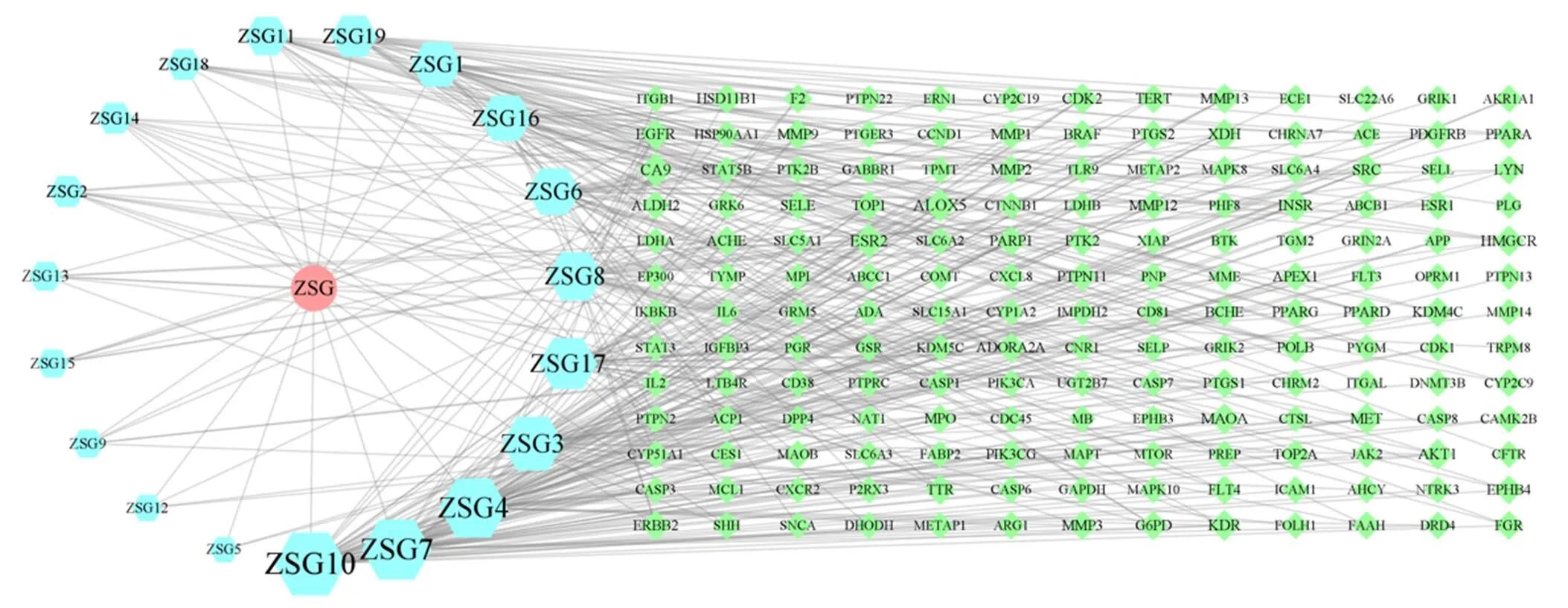
在Cytoscape 3.9.0软件中将朱砂根19个活性成分和朱砂根作用于急性咽炎的168个靶点输入,构建得到“活性成分-靶点”网络(图2)。图中六边形表示朱砂根19个活性成分,菱形表示168个靶点,六边形与菱形大小与明暗程度表示了活性成分、靶点本身的重要程度以及活性成分与靶点间关系的密切程度,中药多成分、多靶点间相互作用的特点在图中得以体现。
3.4 PPI网络的构建与分析
将朱砂根与急性咽炎相互作用的168个潜在靶点导入String数据库中,得到各靶点间的关系信息,将最高置信度(0.900)以上的靶点导入到Cytoscape 3.9.0软件,绘制PPI网络(图3)。进行拓扑分析可知,该网络有169个节点,419条边,平均节点度4.96,平均局部聚类系数0.438,依据连接度、介度、紧密度大小,从图中可以得到表皮生长因子受体(epidermal growth factor receptor,EGFR)、AKT1、v-erb-b2成红细胞白血病病毒癌基因同源物2(v-erb-b2 erythroblastic leukemia viral oncogene homolog 2,ERBB2)、周期蛋白D1(cyclin D1,CCND1)、白细胞介素-2(interleukin-2,IL-2)、IL-6、E1A结合蛋白p300(E1A binding protein p300,EP300)、整联蛋白β1(integrin beta 1,ITGB1)等核心靶点。上述靶点是重要节点,连接大量其他节点蛋白。节点分别代表潜在作用靶点,节点大小与明暗透明度代表靶点的度值,节点越大、颜色越深,表明靶点在网络体系中的度值越大;节点间连线表示靶点间存在潜在的相互作用关系。
圆形节点为药物,六边形节点为活性成分,菱形节点为靶点

图3 PPI网络
3.5 KEGG通路富集与重要信号通路基因筛选
在Matescape数据库中输入168个潜在靶点,进行KEGG通路富集,结果表明168个靶点主要通过120条KEGG通路发挥作用(<0.05),包括NF-κB信号通路、JAK-STAT信号通路、Toll样受体信号通路、NOD样受体信号通路、FoxO信号通路、MAPK信号通路等。其中,ZSG3、ZSG4、ZSG5、ZSG6、ZSG7、ZSG8、ZSG9、ZSG10、ZSG12、ZSG14、ZSG15、ZSG16、ZSG17、ZSG18、ZSG19共15个朱砂根关键活性成分作用于JAK-STAT信号通路13个靶点,包括、、、等。进一步构建“关键成分-靶点-通路”网络(图4)。
3.6 朱砂根对急性咽炎大鼠血清中IL-6、PEG2和IL-10水平的影响
造模3 d后,大鼠体质量下降,食欲不振,毛发暗淡变黄,且咽部有红肿出现,即造模成功;给予药物干预7 d后,与模型组比较,各给药组大鼠咽部红肿程度好转,说明朱砂根对急性咽炎有较好的治疗效果。如表3所示,与对照组比较,模型组大鼠血清中IL-6、PEG2水平显著升高(<0.01),IL-10水平明显降低(<0.01);与模型组比较,各给药组大鼠血清中PEG2水平显著降低(<0.01),阿莫西林组和朱砂根高剂量组大鼠血清中IL-6水平显著降低(<0.01),阿莫西林组和朱砂根中、高剂量组大鼠血清中IL-10水平显著升高(<0.05、0.01)。

八边形节点代表信号通路,菱形节点为靶点,圆形节点为活性成分
表3 朱砂根水提物对急性咽炎大鼠血清中IL-6、PEG2和IL-10水平的影响(, n = 8)
Table 3 Effect of water extract of A. crenata on levels of IL-6, PEG2 and IL-10 in serum of rats with acute pharyngitis (, n = 8)
组别剂量/(g·kg−1)IL-6/(ng·L−1)PEG2/(ng·L−1)IL-10/(ng·L−1) 对照—76.90±15.94298.02±31.2342.55±5.35 模型—138.40±13.51**522.62±37.08**21.28±5.92** 阿莫西林0.3685.39±16.91##338.70±46.37##39.68±6.21## 朱砂根8.64101.28±16.52##373.19±47.50##35.23±8.57## 4.32116.66±14.14375.29±27.11##29.80±6.68# 2.16126.45±13.91421.37±48.40##26.02±5.19
与对照组比较:**<0.01;与模型组比较:#<0.05##<0.01
**< 0.01control group;#< 0.05##< 0.01model group
3.7 朱砂根对急性咽炎大鼠咽部组织病理变化的影响
如图5所示,对照组大鼠咽部组织黏膜鳞状上皮无增生,固有层小血管无充血,固有层与黏膜腺无炎性细胞浸润;模型组大鼠咽部组织黏膜鳞状上皮明显增生,黏液腺肥大、损坏,固有层内小血管充血明显,固有层与黏膜腺有大量炎性细胞浸润;阿莫西林组咽部组织黏膜上皮偶见增生,固有层与黏膜腺偶见炎性细胞浸润;朱砂根高剂量组咽部组织黏膜鳞状上皮基本无增生,固有层内小血管无明显充血,固有层与黏膜腺无炎性细胞浸润;朱砂根中剂量组咽部组织黏膜鳞状上皮部分增生,黏膜腺略有肥大,固有层及黏膜腺有少量炎性细胞浸润;朱砂根低剂量组咽部组织黏膜鳞状上皮明显增生,固有层内小血管大量充血,但固有层炎性基本无细胞浸润。
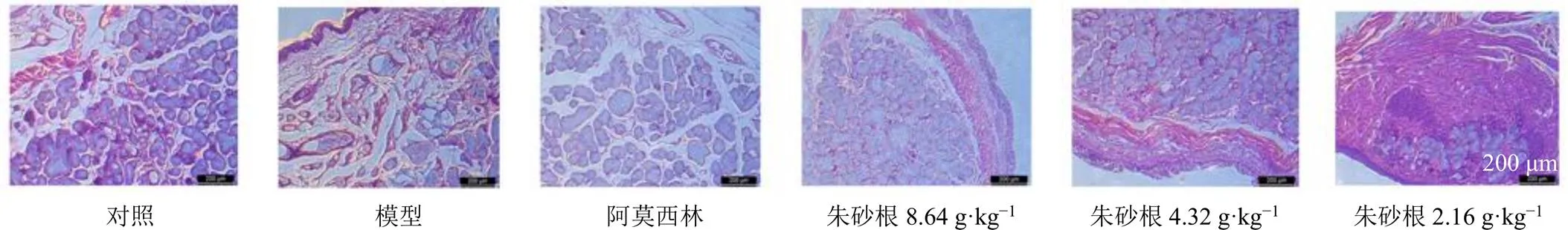
图5 朱砂根对急性咽炎大鼠咽部组织病理变化的影响(HE, ×200)
3.8 朱砂根对急性咽炎大鼠咽部组织Caspase-3、Caspase-7、Caspase-8、PTPN11、AKT1和JAK2 mRNA表达的影响
如图6所示,与对照组比较,模型组咽部组织中、、、和mRNA表达水平均显著升高(<0.05、0.01);与模型组比较,阿莫西林组咽部组织中、、、和mRNA表达水平均显著降低(<0.05、0.01);朱砂根高剂量组、、、和mRNA表达水平均显著降低(<0.05、0.01);朱砂根中剂量组和mRNA表达水平均显著降低(<0.05、0.01);朱砂根低剂量组、、、和mRNA表达水平均显著降低(<0.05、0.01)。
3.9 朱砂根对急性咽炎大鼠咽部组织Caspase-8、AKT1和JAK2蛋白表达的影响
如图7所示,与对照组比较,模型组大鼠咽部组织中Caspase-8和JAK2蛋白表达水平显著升高(<0.01);与模型组相比,朱砂根高剂量组Caspase-8、AKT1和JAK2蛋白表达水平均显著降低(<0.05、0.01)。
4 讨论
中医认为,火热为咽喉疾病的一个重要病因, 其表现多为火热上炎症状,通常以疏风解表、清热解毒的药物治疗为主[24]。西医认为当咽部受到细菌、病毒等外来刺激时,炎症细胞释放出肿瘤坏死因子-α、IL-1β和IL-6等促炎因子,促炎因子的增加使吞噬细胞加速活化、聚集并释放炎症介质,引起咽部发热、疼痛、红肿,即造成急性咽炎[25]。
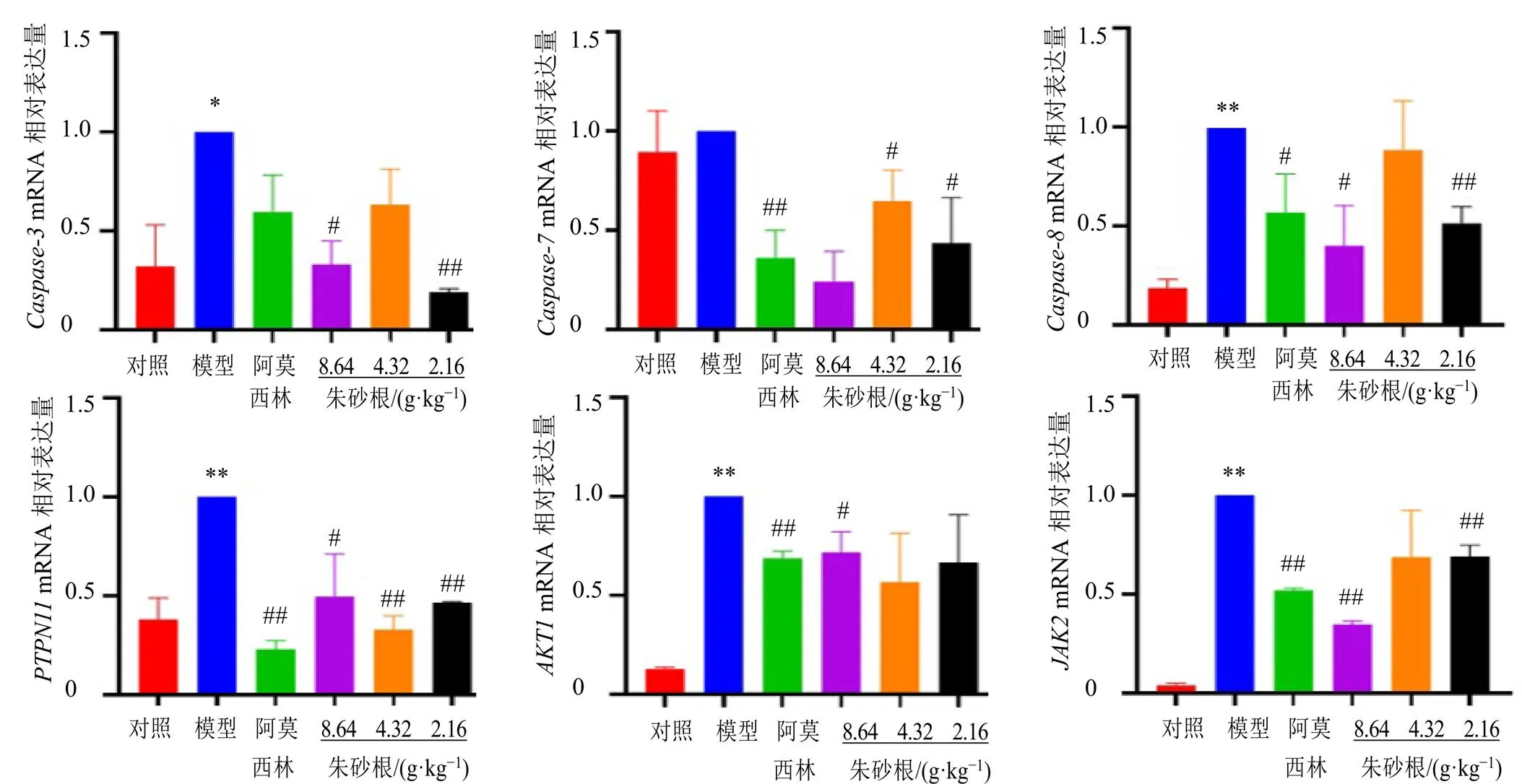
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,图7同
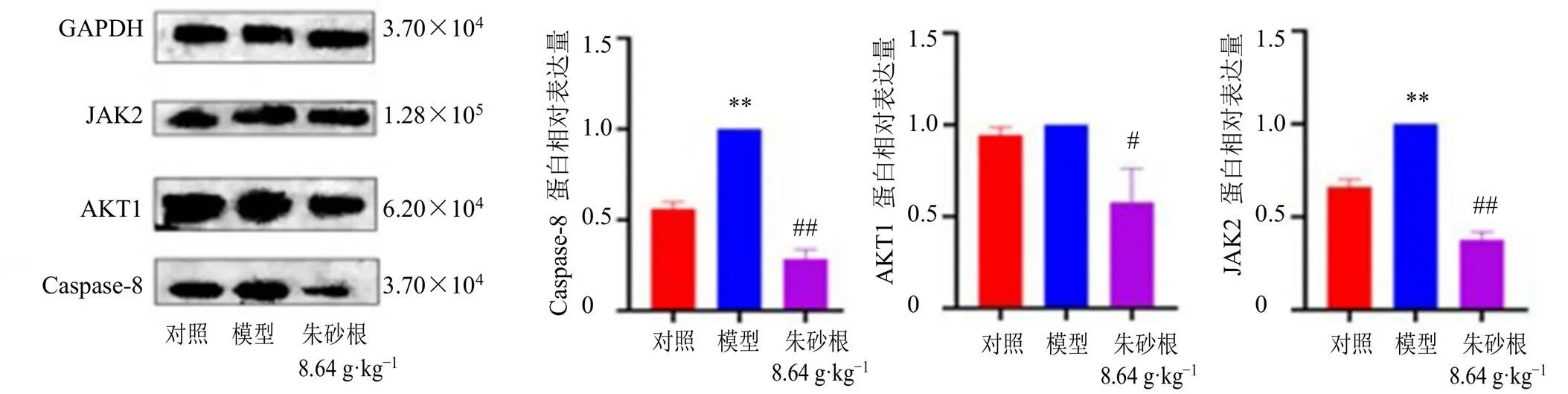
图7 朱砂根对急性咽炎大鼠咽部组织Caspase-8、AKT1和JAK2蛋白表达的影响(, n = 3)
朱砂根具有解毒消肿、活血止痛、祛风除湿之功效,在治疗急性咽炎方面有着独特的优势。在临床应用中,朱砂根是开喉剑喷雾剂的主要组成中药之一。开喉剑喷雾剂是治疗小儿咽炎、扁桃体炎的常用药物,该药为液体喷雾制剂,可直接作用于口腔黏膜,在病变局部形成药液膜,具有直接吸收、起效快、疗效高、疗程短等特点,临床应用广泛[26-27]。另有研究表明[28-30],开喉剑喷雾剂与更昔洛韦、头孢曲松、蒲地蓝消炎口服液等药物联用,在治疗小儿疱疹性口腔炎、急性化脓性扁桃体炎、手足口病等疾病时临床效果更好,可加快患者症状缓解速度,提升患者体液免疫功能,且安全性高。因此研究朱砂根治疗急性咽炎的作用机制具有十分重要的意义。
为了探究朱砂根治疗急性咽炎的作用机制,本研究建立大鼠急性咽炎模型,考察朱砂根对大鼠血清中IL-6、PEG2、IL-10水平的影响。IL-6是机体内最重要的促炎因子之一,在急性咽炎等疾病中扮演着十分重要的角色[31]。在形成急性咽炎的整体过程中,吞噬细胞等炎性细胞产生的炎症因子可以间接促使PEG2的合成[32]。IL-10是目前公认的炎症与免疫抑制因子,能够抑制巨噬细胞在受到促炎性刺激后诱导发生代谢程序的改变[33]。结果显示,朱砂根可能通过降低IL-6等促炎因子水平,升高IL-10等抑炎因子水平,从而促进巨噬细胞等炎症因子凋亡,达到对急性炎症的治疗作用。
网络药理学预测结果表明,岩白菜素、杨梅素、槲皮素等朱砂根中19种关键活性成分通过45个关键靶点作用于9个与炎症、细胞调亡有关的信号通路上。研究发现,岩白菜素通过抑制NF-κB及MAPK信号通路从而减少促炎因子[34];杨梅素能够抑制NF-κB信号通路从而抑制炎症反应,降低炎症因子表达[35]。因此,朱砂根中关键活性成分在治疗急性咽炎时起到重要作用。NF-κB、STAT信号通路是参与细胞因子信号调节、影响炎症因子的主要通路。JAK/STAT信号通路一定程度上可以激活NF-κB信号通路,并存在一定交互作用,在JAK/STAT信号通路中,JAK可以响应细胞因子或生长因子的刺激使STAT3磷酸化,诱导促炎细胞因子的表达,同时促炎细胞因子可激活NF-κB信号通路并通过调控MCP-1和COX-2蛋白的表达募集趋化更多炎症细胞,引发炎症损伤[36-39]。另有研究表明[40],吞噬细胞向M1极化的重要信号通路为NF-κB信号通路,下调炎症因子的表达和抑制其向M1的极化,具有显著的炎症负向调控作用。
本研究结果表明,朱砂根水提液显著抑制急性咽炎大鼠咽部组织、、、、、基因表达及Caspase-8、AKT1、JAK2蛋白表达。Caspases[41]是近年来发现的一组半胱氨酸蛋白酶,可导致DNA裂解促进细胞凋亡。Caspase-7作为细胞凋亡的执行者之一,其表达量降低可以抑制NF-κB信号通路从而有效干预炎症反应的发生。、、作为JAK/STAT信号通路的重要组成基因之一,在调节吞噬细胞生长、分化、凋亡方面起着至关重要的作用[42]。AKT1信号通路调控细胞增殖和生长,参与包括细胞凋亡和葡萄糖代谢在内的细胞过程。JAK家族成员属于非受体酪氨酸激酶,基因参与由多种细胞因子影响的信号通路[43],编码的蛋白质在大多数组织中广泛表达,并在各种细胞信号事件中起调节作用。综上,朱砂根通过作用于NF-κB/STAT通路,刺激巨噬细胞的凋亡并抑制炎症反应的发生,对急性咽炎起到治疗作用。
本研究以朱砂根作为研究对象,通过网络药理学方法寻找到朱砂根活性成分治疗急性咽炎的关键通路上的关键靶点,并根据预测得到的关键靶点筛选到NF-κB/STAT信号通路,同时建立了急性咽炎大鼠模型,考察了朱砂根水提液治疗急性咽炎的作用机制。结果显示,给予朱砂根水提液后,模型大鼠血清中促炎因子IL-6、PEG2水平降低,抗炎因子IL-10水平升高,说明朱砂根能够有效治疗急性咽炎。qRT-PCR与Western blotting结果佐证,朱砂根水提液能够通过降低模型大鼠咽部组织、、、、、基因表达,进而降低Caspase-8、AKT1、JAK2蛋白表达,抑制NF-κB信号通路,干预炎症反应的发生,同时刺激STAT信号通路从而促进吞噬细胞分化、凋亡,起到治疗急性咽炎的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 张霞, 谢雁鸣, 李光熙, 等. 中医药治疗急性咽炎的优势与问题探讨 [J]. 中国中药杂志, 2017, 42(19): 3819-3825.
[2] 王文萍, 赵克明, 高京京, 等. 急性咽炎的病因病机理论再探讨 [J]. 辽宁中医杂志, 2009, 36(7): 1086-1088.
[3] Shaikh N, Leonard E, Martin J M. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: A meta-analysis [J]., 2010, 126(3): e557-e564.
[4] Cots J M, Alós J I, Bárcena M,. Recommendations for management of acute pharyngitis in adults [J]., 2016, 34(9): 585-594.
[5] Harris A M, Hicks L A, Qaseem A,. Appropriate antibiotic use for acute respiratory tract infection in adults: Advice for high-value care from the American college of physicians and the centers for disease control and prevention [J]., 2016, 164(6): 425-434.
[6] Hicks L A, Taylor T H Jr, Hunkler R J. U. S. outpatient antibiotic prescribing, 2010 [J]., 2013, 368(15): 1461-1462.
[7] 林慧, 梅全喜. 中药制剂治疗急性咽炎的研究进展 [J]. 时珍国医国药, 2007, 18(10): 2448-2450.
[8] 蔡佳仲. 朱砂根和树豆叶的化学成分及抗肿瘤作用研究 [D]. 广州: 广州中医药大学, 2012.
[9] 宋冬雪. 朱砂根药理作用研究进展 [J]. 黑龙江医药, 2014, 27(4): 887-888.
[10] 叶晴, 陈金鹏, 凌悦, 等. 朱砂根化学成分和药理作用的研究进展[J]. 中草药, 2022, 53(9): 2851-2860.
[11] 余成龙, 宋良科, 吴蜀星, 等. 朱砂根药用资源分布及研究进展 [J]. 安徽农业科学, 2012, 40(28): 13793-13794.
[12] 朱思. 朱砂根品质评价及其相关药效学研究 [D]. 福州: 福建中医药大学, 2016.
[13] 王长彬, 周永强, 俸婷婷, 等. 基于HPLC图谱探究苗药八爪金龙3个基原不同药用部位的差异 [J]. 化学工程师, 2020, 34(12): 23-27.
[14] 田振华, 何燕, 骆红梅, 等. 朱砂根抗炎抗菌作用研究 [J]. 西北药学杂志, 1998, 13(3): 109-110.
[15] 靳志娟. 紫金牛属植物化学成分和药理作用的研究进展 [J]. 实用医技杂志, 2008, 15(25): 3432-3436.
[16] 李晓, 石慧, 丁晶鑫, 等. 不同基原八爪金龙药材中黄酮、香豆素类化学成分分析 [J]. 中国药房, 2021, 32(4): 443-452.
[17] 谭海鹏. 巨噬细胞对凋亡细胞的清除及炎症调控作用 [J]. 复旦学报: 医学版, 2020, 47(6): 911-916.
[18] 赵九洲, 姜晓旭, 李宏伟, 等. JAK-STAT信号通路与巨噬细胞炎症调控的研究进展 [J]. 癌变·畸变·突变, 2020, 32(5): 402-404.
[19] Alawdi S H, El-Denshary E S, Safar M M,. Neuroprotective effect of nanodiamond in Alzheimer’s disease rat model: A pivotal role for modulating NF-κB and STAT3 signaling [J]., 2017, 54(3): 1906-1918.
[20] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[21] Daina A, Michielin O, Zoete V. SwissADME: A free web tool to evaluate pharmacokinetics, drug-likeness and medicinal chemistry friendliness of small molecules [J]., 2017, 7: 42717.
[22] Daina A, Michielin O, Zoete V. iLOGP: A simple, robust, and efficient description of n-octanol/water partition coefficient for drug design using the GB/SA approach [J]., 2014, 54(12): 3284-3301.
[23] Daina A, Zoete V. A BOILED-egg to predict gastrointestinal absorption and brain penetration of small molecules [J]., 2016, 11(11): 1117-1121.
[24] 李岩, 陶荆华, 汪婧怡, 等. 中医外治法治疗急性咽炎的研究进展 [J]. 中国中医急症, 2021, 30(11): 2065-2068.
[25] 刘岩, 刘志洋. 罗汉果水提液对于急性咽炎模型大鼠的治疗作用 [J]. 中国实验方剂学杂志, 2014, 20(19): 159-162.
[26] 谢莉. 开喉剑喷雾剂治疗儿童急性咽喉炎的临床研究 [J]. 临床军医杂志, 2015, 43(6): 610-612.
[27] 关晓娟, 李劭鹏. 开喉剑喷雾剂联合克感利咽口服液治疗儿童急性扁桃体炎临床分析 [J]. 新中医, 2016, 48(3): 158-160.
[28] 张琛玮, 谢豪, 陈龙, 等. 开喉剑喷雾剂联合更昔洛韦辅助治疗小儿疱疹性口腔炎的临床效果 [J]. 临床合理用药杂志, 2021, 14(28): 130-132.
[29] 李旦阳. 开喉剑喷雾剂联合头孢曲松治疗急性化脓性扁桃体炎患儿临床研究 [J]. 新中医, 2022, 54(8): 129-132.
[30] 武亮花, 任洁颖. 开喉剑喷雾剂联合蒲地蓝消炎口服液治疗手足口病患儿临床疗效分析 [J]. 临床医药实践, 2021, 30(12): 910-911.
[31] Yao X, Huang J Q, Zhong H H,. Targeting interleukin-6 in inflammatory autoimmune diseases and cancers [J]., 2014, 141(2): 125-139.
[32] Yang D L, Xu J W, Zhu J G,. Role of GPR30 in estrogen-induced prostate epithelial apoptosis and benign prostatic hyperplasia [J]., 2017, 487(3): 517-524.
[33] Ip W K E, Hoshi N, Shouval D S,. Anti-inflammatory effect of IL-10 mediated by metabolic reprogramming of macrophages [J]., 2017, 356(6337): 513-519.
[34] Gao X J, Guo M Y, Zhang Z C,. Bergenin plays an anti-inflammatory role via the modulation of MAPK and NF-κB signaling pathways in a mouse model of LPS-induced mastitis [J]., 2015, 38(3): 1142-1150.
[35] 张帆, 彭密军, 邓百川. 二氢杨梅素抗炎作用研究进展 [J]. 饲料研究, 2021, 44(18): 117-121.
[36] 廖静秋. JAK-STAT/NF-κB通路介导高糖引起的人脐静脉内皮细胞的损伤与炎症反应 [D]. 广州: 南方医科大学, 2016.
[37] 徐敏. 咽喉清复方对急性咽炎p38/Erk/NF-κB/COX-2信号通路调控的影响 [D]. 贵州: 遵义医科大学, 2020.
[38] 吴峰淼, 叶凯丽, 刘曦. 黄芩苷对大鼠胶原诱导性关节炎JAK/STAT3信号通路及Th17/Treg免疫平衡的影响 [J]. 中国药师, 2020, 23(2): 246-251.
[39] 许话, 严红梅, 陈斓. 仙茅苷对溃疡性结肠炎大鼠JAK/STAT/NF-κB信号通路的影响 [J]. 中国药师, 2022, 25(3): 406-413.
[40] 贾瑞, 惠毅, 闫曙光, 等. 巨噬细胞M1/M2型极化与免疫炎症性疾病关系的研究进展 [J]. 中国免疫学杂志, 2021, 37(22): 2791-2797.
[41] Zhu M M, Wang L, Yang D,. Wedelolactone alleviates doxorubicin-induced inflammation and oxidative stress damage of podocytes by IκK/IκB/NF-κB pathway [J]., 2019, 117: 109088.
[42] 王学川, 李霄, 梁承远. 基于JAK-STAT信号通路的药物研究进展 [J]. 陕西科技大学学报, 2019, 37(6): 79-86.
[43] Casanova J L, Holland S M, Notarangelo L D. Inborn errors of human JAKs and STATs [J]., 2012, 36(4): 515-528.
Mechanism ofon rats with acute pharyngitis based on NF-κB/ STAT signaling pathway
QUAN Wei1, LIU Chang1, ZHOU Ying1, HE Qian-qian1, SHI Yang1, DANG Zhao-yan1, LIU Xiong-li1, 2
1. Research Center for Application and Development of Medicine and Food Dual-use Resources, School of Pharmacy, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China 2. National and Local Joint Engineering Research Center of Southwest Medicinal and Edible Resources Development and Utilization Technology, Guizhou University, Guiyang 550025, China
To explore the mechanism ofon rats with acute pharyngitis based on nuclear factor kappa-B (NF-κB)/signal transducer and activator of transcription (STAT) signaling pathway by establishing acute pharyngitis rats model combined with network pharmacology,.The target ofintervention in acute pharyngitis was predicted by network pharmacology, and networks of active ingredient-target and target-pathway were constructed; Rat model of acute pharyngitis was constructed, levels of interleukin-6 (IL-6), prostaglandin E2(PEG2) and IL-10 in serum of rats were detected; qRT-PCR was used to detect cystein-asparate protease-3 (),,, protein tyrosine phosphatase nonreceptor 11 (),protein kinase B1) andJanus kinase 2 () mRNA expressions in pharyngeal tissue of rats; Western blotting was used to detect AKT1, JAK2 and Caspase-8 protein expression in pharyngeal tissue of rats.The network pharmacology showed that main active components ofhad 168 intersecting targets with acute pharyngitis, mainly acting on NF-κB/STAT signaling pathway. Compared with model group, levels of IL-6 and PEG2in serum of rats ingroup were significantly decreased (< 0.01), and IL-10 level was significantly increased (< 0.05, 0.01), mRNA expression levels of,,,,andwere significantly decreased (< 0.05, 0.01), protein expressions of Caspase-8, AKT1 and JAK2 were significantly decreased (< 0.05, 0.01).The active components inmay regulate NF-κB/STAT signaling pathway, intervene in inflammatory response and accelerate the differentiation and apoptosis of macrophages, thereby treating acute pharyngitis.
Sims; network pharmacology; nuclear factor-κB/signal transducer and activator of transcription signaling pathway; acute pharyngitis; macrophage
R285.5
A
0253 - 2670(2022)19 - 6083 - 10
10.7501/j.issn.0253-2670.2022.19.014
2022-04-20
国家重点研发计划项目(2018YFC1708100);贵州省中医药管理局中医药、民族医药科学技术研究课题(QZYY-2021-098);贵州中医药大学2021年度科研创新和探索专项(2018YFC170810201,2018YFC170810204);贵州中医药大学本科教学工程建设项目(贵中医教学工程合字[2021]12号)
权 伟(1998—),男,在读硕士研究生,研究方向为中药及民族药化学及中药新药研究。E-mail: 529197111@qq.com
刘雄利(1983—),男,教授,从事基于药物优势骨架的高效构建和药食功能因子研究。E-mail: 15286024587@163.com
[责任编辑 李亚楠]
