氨氮胁迫对金鱼抗氧化功能和消化功能的影响
2022-10-13杨金艳李宇洁洪慧青张红霞蔡巧巧刘成荣23
杨金艳 李宇洁 洪慧青 张红霞 蔡巧巧 刘成荣23
(1.莆田学院环境与生物工程学院,福建 莆田 351100)
(2.福建省新型污染物生态毒理效应与控制重点实验室,福建 莆田 351100)(3.生态环境与信息图谱福建省教育厅重点实验室,福建 莆田 351100)
鱼类的新陈代谢活动主要通过呼吸和排泄来进行,通过鱼的新陈代谢活动我们可以了解到鱼类的能量需求、抗氧化功能及消化功能等情况。抗氧化酶超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛普遍存在于生物体的各个器官,它们可以通过氧化还原作用体内的过氧化物转化为无毒或者毒性较低的物质抑制氧自由基的生成保持体内代谢的平衡;消化酶蛋白酶、淀粉酶、脂肪酶就是将食物分解成人体可以吸收的小分子物质,它的主要作用就是分解食物。研究不同氨氮浓度对金鱼抗氧化功能和消化功能的影响。因此研究鱼类的呼吸和排泄,对于了解鱼类代谢生理特点和开展鱼类养殖均有重要意义。氨氮是鱼类蛋白质代谢的最终产物,约占鱼类氮代谢的60%-80%(Salin et al,1991)。
陈坚、夏苏东等人研究表明,在鱼类养殖水体中,氨氮会大量消耗水体溶氧,影响鱼类鳃的氧传递和正常的呼吸代谢,延缓鱼类生长,对鱼体生理活动等造成严重影响甚至导致死亡。水体中氨氮一般以非离子氨(NH3)和离子氨(NH4+)形式存在(Zhang YL,2017),其中NH3会对鱼类产生毒害作用,能引起鱼类食欲降低、组织变形及消化功能下降等现象。
金鱼是世界上重要的观赏用水生经济动物,随着市场的需求,鱼类养殖已形成高密度工厂化养殖。然而金鱼的养殖对环境要求极为严苛,温度、水的酸碱度及硬度和水溶氧对金鱼的生存都有着极大的影响。
金鱼对氨氮的毒性非常敏感,当金鱼长时间在氨氮胁迫下,且若氨氮浓度过高,会对鱼类正常的摄食、呼吸、运动、新陈代谢等基本生理生化活动产生消极影响,对鱼类产生毒害作用,致其患病甚至死亡,从而影响鱼类正常生长发育(郑洪武,2020)。但目前尚未见到有关氨氮胁迫对金鱼的抗氧化功能和消化功能影响的报道,因此本实验初次浅探氨氮胁迫对金鱼部分功能影响,为其健康养殖提供科学依据。
1.材料与方法
1.1 材料
材 料:金鱼,体长13.91±0.2(cm),体质量37.41±0.2(g)。
试剂:PBS缓冲液、Met、NBT、EDTA-Na2、核黄素、生理盐水、LB培养基、蒸馏水、DNS、NaOH、硫代巴比妥酸、三氯乙酸、酪素、碳酸钠、福林试剂、L-酪氨酸、双氧水、淀粉、麦芽糖、考马斯亮蓝、90%乙醇、70%乙醇、85%磷酸、牛血清白蛋白、琼脂、脂肪酶(LPS)测定试剂盒(南京建成生物工程研究所)、胃蛋白酶测试盒(南京建成生物工程研究所)。
1.2 方法
取100L自来水放于多个水箱中,并将水箱放置在通风处静置2天后。将金鱼放入水中暂养2天,无病害发生则开始实验。做1个对照组和5个实验组,分别配置成氨氮浓度为0mg/L、17.25mg/L、20.36mg/L、24.02mg/L、28.34mg/L、33.44mg/L的溶液,将金鱼分装到不同浓度的NH4Cl溶液中进行胁迫。胁迫48h后,分别取出金鱼1g的肝胰脏和肌肉放入研钵;加入生理盐水,研磨成浆液,滴加PBS缓冲液,放于离心机中离心,取其上层清液制成酶液。测定各处理组金鱼抗氧化酶(SOD、CAT)的活性和MDA含量。继续胁迫72小时后,取出金鱼肠道,将内容物取出后,把肠道按比例加生理盐水研磨匀浆并在离心机中离心,取上清液制成酶液。测定金鱼消化酶(蛋白酶、淀粉酶、脂肪酶)的活性;将内容物稀释后接种到培养基上,培养24h观察大肠杆菌、芽孢杆菌、乳酸杆菌菌落数量情况。
1.2.1 氨氮胁迫后金鱼抗氧化酶活性和丙二醛含量的测定
金鱼的超氧化物歧化酶活性采用氮蓝四唑法测定;过氧化氢酶活性的测定方法参照李军等的方法并稍作改进;丙二醛含量采用硫代巴比妥酸法测定。
1.2.2 氨氮胁迫后金鱼消化道相关酶活性的测定
金鱼脂肪酶活性采用脂肪酶测定试剂盒测定;蛋白酶活性采用蛋白酶试剂盒测定;淀粉酶活性采用DNS比色法测定。
2.结果与分析
2.1 氨氮胁迫对金鱼超氧化物歧化酶(SOD)活性的影响
2.1.1 氨氮胁迫对金鱼肝胰脏中的超氧化物歧化酶的影响
如图1所示,氨氮浓度为20.36mg/L时,肝脏组织中的酶活力最低,为20.23±19.72(U/g),差异不显著(P>0.05)。氨氮浓度为17.25 mg/L时,肝脏组织中的酶活力最高,为53.97±10.22(U/g),差异不显著(P>0.05)。
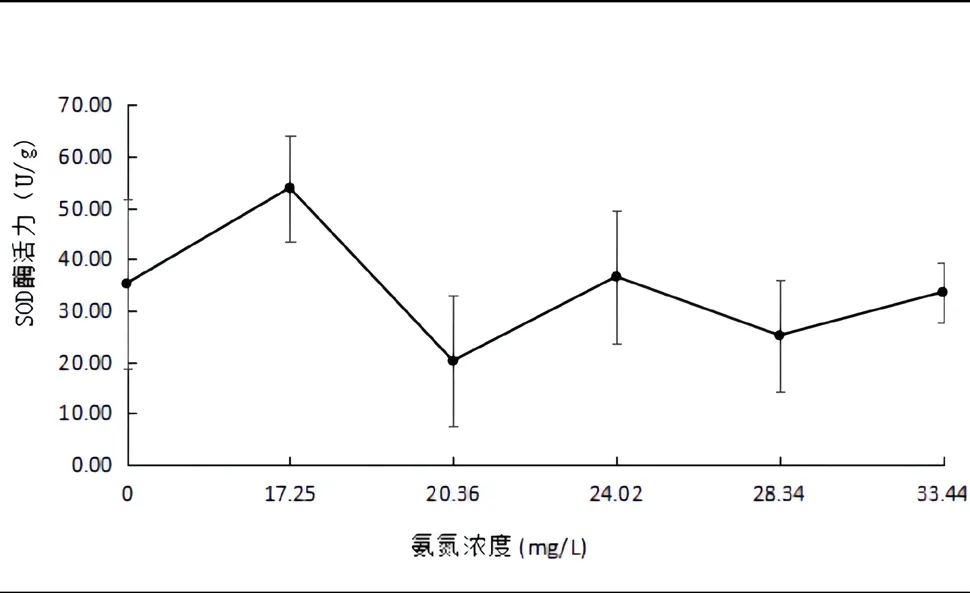
图1 氨氮胁迫对金鱼肝胰脏中SOD活力的影响
2.1.2 氨氮胁迫对金鱼肌肉组织中的超氧化物歧化酶的影响
如图2所示,当氨氮浓度为17.25 mg/L时,肌肉组织的酶活力最低,为3.78±11.72(U/g),差异不显著(P>0.05)。当氨氮浓度为28.34 mg/L时,肌肉组织的酶活力最高,为40.03±12.84(U/g),差异不显著(P>0.05)。
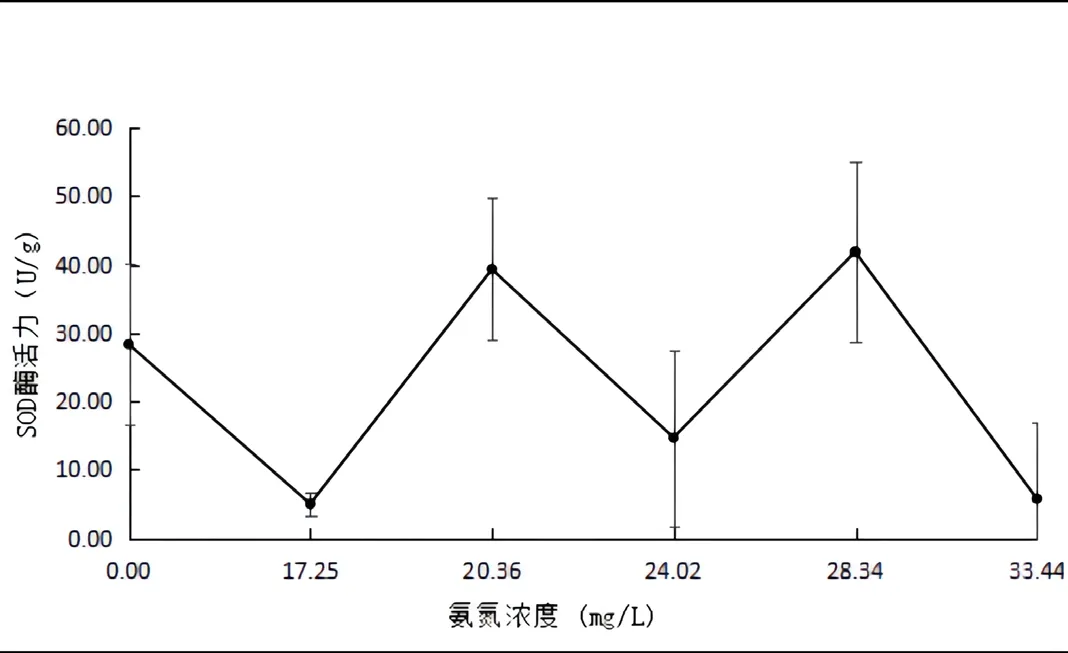
图2 氨氮胁迫对金鱼肌肉组织中SOD活力的影响
2.2 氨氮胁迫对金鱼肝胰脏组织中的过氧化氢酶(CAT)活力的影响
2.2.1 氨氮胁迫对金鱼肝胰脏组织中的过氧化氢酶的影响
由图3所示,金鱼在浓度为20.36 mg/L的NH4Cl溶液中,差异极其显著(P<0.01),CAT活力最低,为1.50±0.08(U/g/min)。在NH4Cl浓度为20.36 mg/L之后,随着氨氮浓度的不断升高,金鱼肝胰脏组织中的CAT的活力逐渐升高,在NH4Cl浓度为33.44 mg/L时,CAT活力达到最高,为9.61±0.48(U/g/min),差异不显著(P>0.05)。

图3 氨氮胁迫对金鱼肝胰脏中CAT活力的影响
2.2.2 氨氮胁迫对金鱼肌肉组织中过氧化氢酶活力的影响
由图4可看出,当氨氮浓度为33.44 mg/L时,CAT活力达到最低,为0.50±0.03(U/g/min),差异显著(P<0.05)。可知金鱼在高氨氮浓度下,其肌肉中的CAT活力逐渐降低,在NH4Cl溶度为0.00 mg/L时,CAT活力达到最高,为2.25±0.11(U/g/min)差异显著(P<0.05)。

图4 氨氮胁迫对金鱼肌肉组织中CAT活力的影响
2.3 氨氮胁迫对金鱼丙二醛(MDA)含量的影响
2.3.1 氨氮胁迫对金鱼肝胰脏组织中丙二醛含量的影响
由图5所示,金鱼在浓度为24.02 mg/L的NH4Cl溶液中,丙二醛含量最高,为7.43±0.17(μmol/g×FW),显著高于其他组(P<0.05);在浓度为33.44 mg/L的NH4Cl溶液中,丙二醛含量最低,为2.30±0.35(μmol/g×FW),差异极显著(P<0.01)。可见,水中氨氮含量过高,金鱼体内肝胰脏组织中的丙二醛分泌受到抑制。

图5 氨氮胁迫对金鱼肝胰脏中丙二醛含量的影响
2.3.2 氨氮胁迫对金鱼肌肉组织中丙二醛含量的影响
由图6所示,对照组内,金鱼肌肉组织的MDA含量为1.04±0.15(μmol/g×FW),显著高于其他组(P<0.05)。其中,在浓度为33.44mg/L的NH4Cl溶液中,金鱼肌肉组织中的丙二醛含量最低,为0.03±0.14(μmol/g×FW),显著高于其他组(P<0.05)。因此,水溶液中的过高氨氮含量会严重抑制金鱼肌肉组织中丙二醛的分泌。
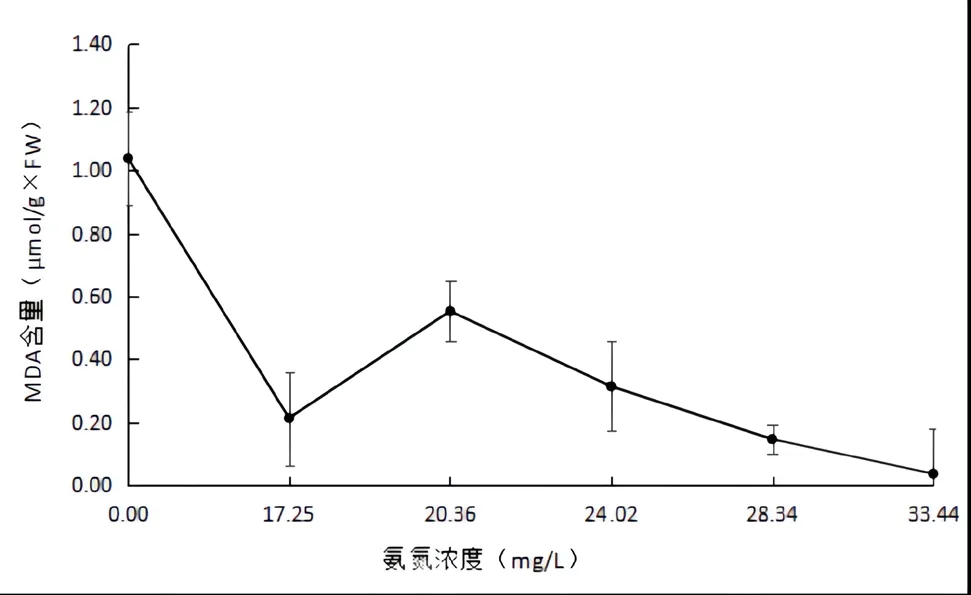
图6 氨氮胁迫对金鱼肌肉组织中丙二醛含量的影响
2.4 氨氮胁迫对金鱼消化道内淀粉酶活性的影响
如图7所示。氨氮浓度为0.00mg/L时,金鱼淀粉酶活力最高,为0.43±0.01(U/mL);显著高于其他组(P<0.05);随着NH4Cl溶液浓度的升高,金鱼淀粉酶活性不断降低。可见,未受氨氮影响的金鱼消化道淀粉酶活性最高;而水中的氨氮则会抑制金鱼消化道内淀粉酶的活性。
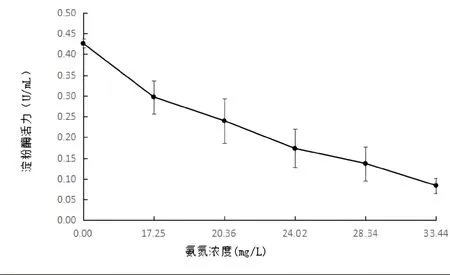
图7 氨氮胁迫对金鱼消化道内淀粉酶活性的影响
2.5 氨氮胁迫对金鱼消化道内蛋白酶活性的影响
如图8所示。NH4Cl溶液浓度为17.25mg/L时,金鱼蛋白酶活力最高,为18.94±1.42(U/mgprot),显著高于其他组(P<0.05);当NH4Cl溶液浓度高于17.25mg/L时,金鱼蛋白酶活力不断下降;可见,适量的氨氮影响可以提高金鱼蛋白酶活力;但氨氮浓度超过一定范围则会抑制消化道内蛋白酶的活性。
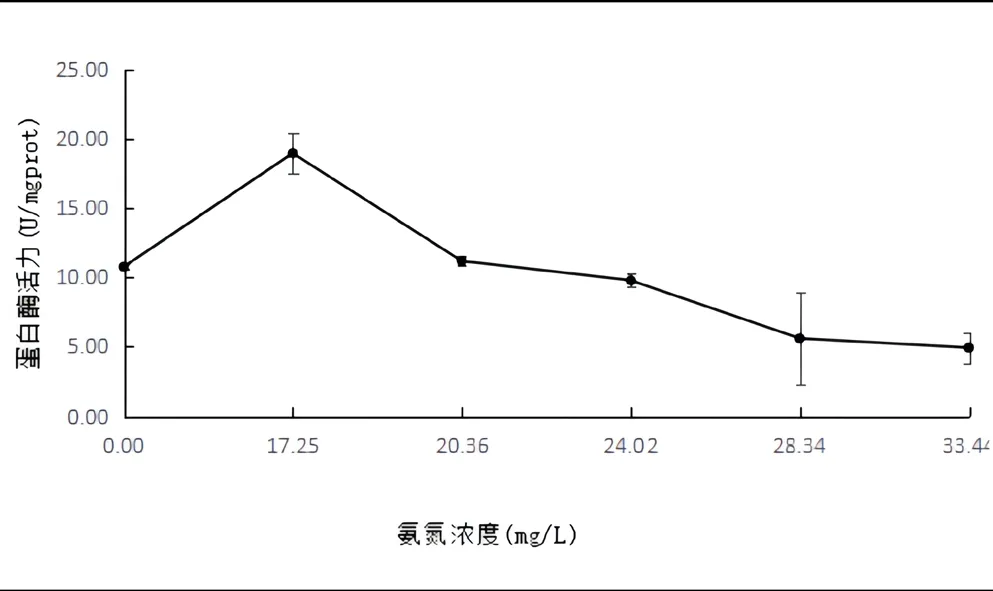
图8 氨氮胁迫对金鱼消化道内蛋白酶活性的影响
2.6 氨氮胁迫对金鱼消化道内脂肪酶活性的影响
如图9所示。在氨氮浓度为20.36mg/L时脂肪酶活性达到最大,为214.64±15.33(U/gprot),差异不显著(P>0.05)。在氨氮浓度为0.00mg/L时,脂肪酶活性最低,为58.66±25.14(U/gprot),差异不显著(P>0.05)。由此可见,在一定浓度范围内,氨氮胁迫可增强金鱼消化道内的脂肪酶活性。
2.7 氨氮胁迫对金鱼消化道菌群的影响
如图10所示。氨氮胁迫五天后,消化道内的芽孢杆菌数在33.44mg/L时达到最大,差异不显著(P>0.05);大肠杆菌的数目在33.44mg/L时达到最大,差异不显著(P>0.05);而乳酸杆菌数目在17.25mg/L时达到最大,差异不显著(P>0.05)。由此说明,氨氮胁迫能提高芽孢杆菌数目,而适量的氨氮浓度也能增加大肠杆菌和乳酸杆菌的数目。
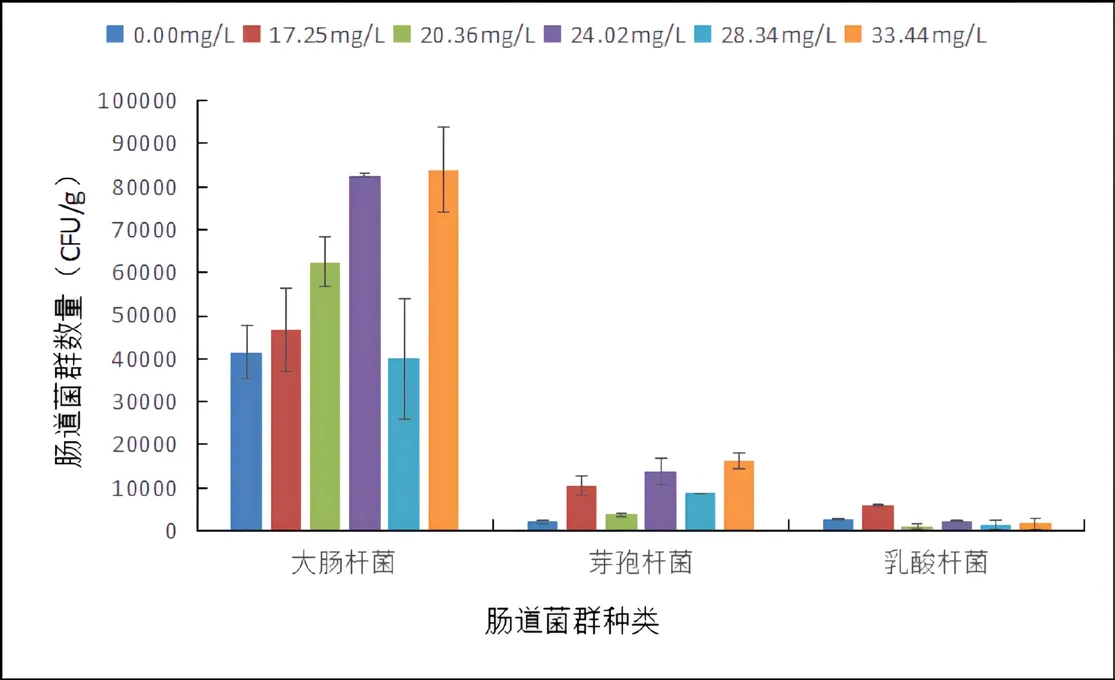
图10 氨氮胁迫对金鱼消化道内脂肪酶活性的影响
3.结论
金鱼是我国特有的一种观赏鱼,因其雍容华贵的体态、优美轻盈的舞姿和鲜艳秀丽的色彩,被誉为“东方圣鱼”“水中芭蕾”,因此金鱼在我国从古至今深受人们的喜爱。如今,金鱼已是许多家庭和公共场所人们喜闻乐见的观赏鱼类。人们将金鱼放养于装饰精美、水质明澈的鱼缸或水族箱,不仅获得了绝佳的观赏效果,也为居室和工作环境平添了几分情趣,给人以闲雅恬适的感觉。但是,在水产动物养殖过程中,由于残余的饵料和水产动物的排泄物使得金鱼等硬骨鱼类受到严重的伤害。使金鱼等水产动物在抗氧化酶、超氧化物歧化酶、过氧化氢酶活性等和丙二醛含量出现了明显的变化,也使金鱼等水产动物消化道蛋白酶、淀粉酶、脂肪酶活性发生了明显变化。为了金鱼等水产动物的健康养殖,避免氨氮胁迫对金鱼养殖的影响,我们进行了相关实验。
根据实验中对照组和实验组数据的对比,金鱼体内酶活性随着氨氮浓度的增加呈现不同的变化。金鱼体内肝胰脏中的SOD活性、CAT活性、MDA含量分别在氨氮浓度为17.25mg/L、33.44mg/L、24.02mg/L时达到最高;其肌肉中的SOD活性、CAT活性、MDA含量分别在氨氮浓度为28.34mg/L、0.00mg/L、20.36mg/L时达到最大值;而金鱼体内的消化酶淀粉酶、蛋白酶、脂肪酶活性在氨氮浓度为0.00mg/L、17.25mg/L、20.36mg/L时酶活性达到最大。金鱼肠道内的大肠杆菌数目和乳酸杆菌的数目在低氨氮浓度的胁迫下均得到提升,而芽孢杆菌在氨氮浓度较大的时候其数目得到提升。综合上述实验,建议在金鱼等水产动物的养殖中应该在保持适当氨氮浓度下,每隔2-3d进行换水;防止由于金鱼的排泄物等因素引起水中氨氮浓度过高,使金鱼体内的酶活性发生改变,从而影响金鱼的健康。
