表没食子儿茶素没食子酸酯和茶黄素对秀丽隐杆线虫耐温性的影响
2022-10-13张梦婷李斌田静
张梦婷,李斌,田静
华中农业大学食品科学技术学院/环境食品学教育部重点实验室,武汉430070
流行病学研究表明,饮茶具有多种健康益处,日常生活中长期习惯性饮茶与高血压发病率和认知障碍风险呈负相关[1-2]。绿茶中含量最多的茶多酚是儿茶素类物质,而儿茶素中又以表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)含量最高,约占总量的50%~75%[3]。作为儿茶素中最有效的活性成分,EGCG具有抗氧化、抗菌、抗炎等作用[4]。茶黄素类物质(theaflavins,TFs)主要是由儿茶素及其衍生物在多酚氧化酶等酶的催化作用下氧化缩合而成的具有苯骈卓酚酮结构的一类化合物的总称[5],在红茶中的含量约为0.5%~3%,是决定红茶品质的关键成分,影响红茶口感的醇厚度与鲜爽度[6]。目前发现并鉴定的TFs 有28 种,其中含量最多的是茶黄素(theaflavin,TF1)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF2a)、茶黄素-3′-没食子酸酯(theaflavin-3′-gallate,TF2b)和茶黄素双没食子酸酯(theaflavin-3,3′-digallate,TF3)4 种单体[7]。众多研究表明,TFs 具有抗氧化[8]、预防神经退行性疾病[9]、调节血糖[10]等多种生物学活性。
秀丽隐杆线虫(Caenorhabditis elegans)是一种发育迅速、生命周期短的非寄生线虫[11]。20 世纪70年代,Brenner[12]首次将秀丽隐杆线虫作为一种神经科学模型引入研究,使其成为第一个拥有完整基因组测序的多细胞生物。秀丽隐杆线虫有60%~80%的基因与人类基因同源,42%的人类疾病基因在秀丽隐杆线虫基因组中存在清晰的同源物[13],因此使得秀丽隐杆线虫作为模式生物在研究药物筛选和人类疾病机制等方面成为可能。目前将EGCG 和TFs应用于秀丽隐杆线虫的研究主要集中在抗衰老[14]、抗氧化应激[15]、抗渗透应激和紫外应激[16]等方面。已有研究表明,EGCG 和富含茶黄素的组分可增加能量消耗、促进生热[17-18]。在低温条件下秀丽隐杆线虫通过TRP 通道延长寿命,高温条件下通过上调应激相关基因的表达来提供较强的应激保护,进而延长寿命。但是将二者应用于秀丽隐杆线虫进行冷、热应激考察和机制研究未见报道。基于此,本研究以秀丽隐杆线虫为生物模型,体外模拟冷、热环境温度,探究绿茶和红茶中的代表性组分——EGCG和TF1 对秀丽隐杆线虫冷、热应激下存活率的影响,进一步测定EGCG 和TF1对不同温度条件下秀丽隐杆线虫体内脂肪含量和线粒体膜电位水平的影响,对EGCG 和TF1在不同温度下发挥保护作用的机制进行了初探,以期为茶多酚生热研究和秀丽隐杆线虫耐温性研究提供新思路。
1 材料与方法
1.1 材料与试剂
N2野生型秀丽隐杆线虫、大肠杆菌OP50(E.coliOP50),Caenorhabditis Genetics Center(CGC);表没食子儿茶素没食子酸酯(EGCG,≥95%)、牛血清白蛋白(BSA)、TritonTMX-100、胆固醇、蛋白胨、甘油,美国Sigma-Aldrich 公司;茶黄素(TF1,98%),成都普瑞法科技开发有限公司;四甲基罗丹明乙酯(TMRE)、羰基氰基-4-(三氟甲氧基)苯腙(FCCP),上海源叶生物科技有限公司;ⅬB 培养基,美国英杰生命技术有限公司;琼脂(BR 组培级),北京兰杰柯科技有限公司;二甲基亚砜(DMSO),AppliChem 公司;BCA 蛋白测定试剂盒,Thermo Fisher Scientific公司;甘油三酯(TG)测定测试盒,南京建成生物工程研究所;盐酸、氯化钠、磷酸二氢钾、磷酸氢二钾、氯化钙、硫酸镁、氢氧化钾,国药集团化学试剂有限公司;S-basal 缓冲液(1.47 g K2HPO4、5.93 g KH2PO4、5.85 g NaCl 溶于1 Ⅼ超纯水,121 ℃灭菌20 min)。
1.2 秀丽隐杆线虫的培养
提前制备涂布有E.coliOP50 菌液的线虫生长培养基(nematode growth medium,NGM)平板,每5 d 将成年线虫转移到平板上,每次挑取4~5 条,置于20 ℃生化培养箱中进行恒温培养。
1.3 热、冷应激试验
将同步化64 h 后的秀丽隐杆线虫分别转移到含有EGCG 和TF1 的NGM 平板上,于20 ℃下孵育5 d,每天使用S-basal 缓冲液收集秀丽隐杆线虫后转移至新的NGM 平板中以避免产卵带来的干扰。热、冷应激试验以DMSO 为空白对照,每组3 个平行,每个平行挑取约20 条线虫分别置于35、4 ℃温度条件下培养。热应激试验每小时计数1 次线虫的死亡情况,直至所有线虫死亡,试验温度设置参考Wilson等[19]。冷应激试验每天计数线虫的死亡情况,直至所有线虫死亡,试验温度设置参考Ⅼiu等[20]。
1.4 脂肪含量测定
将同步化64 h 后的秀丽隐杆线虫分别转移到含有EGCG 和TF1 的NGM 平板上,于不同温度(4、20、30 ℃)条件下分别孵育1、5和7 d。用提前冰浴的S-basal 缓冲液收集线虫,洗涤3 次以除去残留的菌液,随后将线虫转移至2 mⅬ离心管并置于液氮中速冻成颗粒。将线虫颗粒在液氮预冷的研钵中与200 μⅬ5%TritonTMX-100 一起研磨,收集虫体粉末后置于冰上保存。以30%振幅超声10 min,随后在4 ℃条件以12 300 r/min 离心15 min。收集离心后的上清液,使用甘油三酯(TG)测试盒测定不同温度条件下秀丽隐杆线虫体内的脂肪含量。同时,使用BCA 蛋白测试盒测定秀丽隐杆线虫体内的蛋白质含量。试验结果以蛋白质含量做归一化处理。
1.5 线粒体膜电位测定
线粒体膜电位(mitochondrial membrane potential,MMP)水平使用线粒体特异性染料四甲基罗丹明乙酯(tetramethylrhodamine ethyl ester,TMRE)检测。试验以1 μmol/ⅬFCCP 为阳性对照,100 μmol/ⅬTMRE 为荧光染料。试验时将同步化64 h 后的秀丽隐杆线虫分别转移到含有EGCG 和TF1 的NGM 平板上,于不同温度(4、20、30 ℃)条件下孵育1 h、2 h、12 h、24 h、5 d 和7 d。提前制备热灭活的E.coliOP50 菌液,与100 μⅬ浓度为100 μmol/Ⅼ的TMRE检测液混合后涂布于NGM 平板上,避光吹干。用S-basal缓冲液分别收集孵育1、2、12、24 h及5 d和7 d的线虫,转移至含有TMRE 染料的平板上,于20 ℃下孵育2 h。孵育结束后,用S-basal 缓冲液收集线虫,转移至含有热灭活E.coliOP50 菌液的NGM平板上使其自由爬行1 h。最后收集线虫,以100 μⅬ/孔将线虫悬浮液加至黑色96 孔酶标板中。荧光强度测定条件为激发波长540 nm、发射波长595 nm。测定完毕后,使用0.01% TritonTMX-100 回收96 孔板中的线虫,同本文“1.4”步骤中超声破碎、离心,使用BCA法测定蛋白质含量。试验结果以蛋白质含量做归一化处理。
1.6 蛋白质含量测定
使用BCA蛋白测定试剂盒测定秀丽隐杆线虫体内的蛋白质含量。取超声破碎、离心后的线虫上清液,按照BCA蛋白测定试剂盒的操作说明加样,37 ℃条件下孵育30 min后于波长562 nm处测定吸光值。
1.7 数据处理
试验数据以“平均值±标准差”表示。使用GraphpadPrism 7.0 中Survival 进行生存分析,分析时采用Ⅼog-rank(Mantel-Cox)检验数据的显著性。使用Origin 2018 软件作图,采用IBM SPSS Statistics 25 软件进行ANOVA 单因素方差分析,并采用Duncan’s法检验数据的显著性。“*”表示P<0.05,“**”表示P<0.01,“***”表示P<0.001。
2 结果与分析
2.1 EGCG 和TF1 对热应激秀丽隐杆线虫存活率的影响
由图1可知,经EGCG和TF1孵育后,25 μmol/ⅬEGCG处理可显著提高秀丽隐杆线虫在35 ℃条件下的存活率。各个浓度的TF1 对秀丽隐杆线虫在热应激下的存活率无显著影响(P>0.05)。由表1 可知,在35 ℃条件下,经25 μmol/ⅬEGCG 孵育后秀丽隐杆线虫的最大寿命和中位寿命分别为20.44、11.24 h。与对照组相比,25 μmol/ⅬEGCG 将秀丽隐杆线虫的最大寿命和中位寿命分别提高了8.15%、22.44%。而经TF1 孵育后秀丽隐杆线虫的最大寿命和中位寿命并未增加。表明热应激条件下相同浓度的EGCG对秀丽隐杆线虫的保护作用强于TF1,特别是当孵育浓度为25 μmol/Ⅼ时,EGCG 对秀丽隐杆线虫的保护作用最显著。
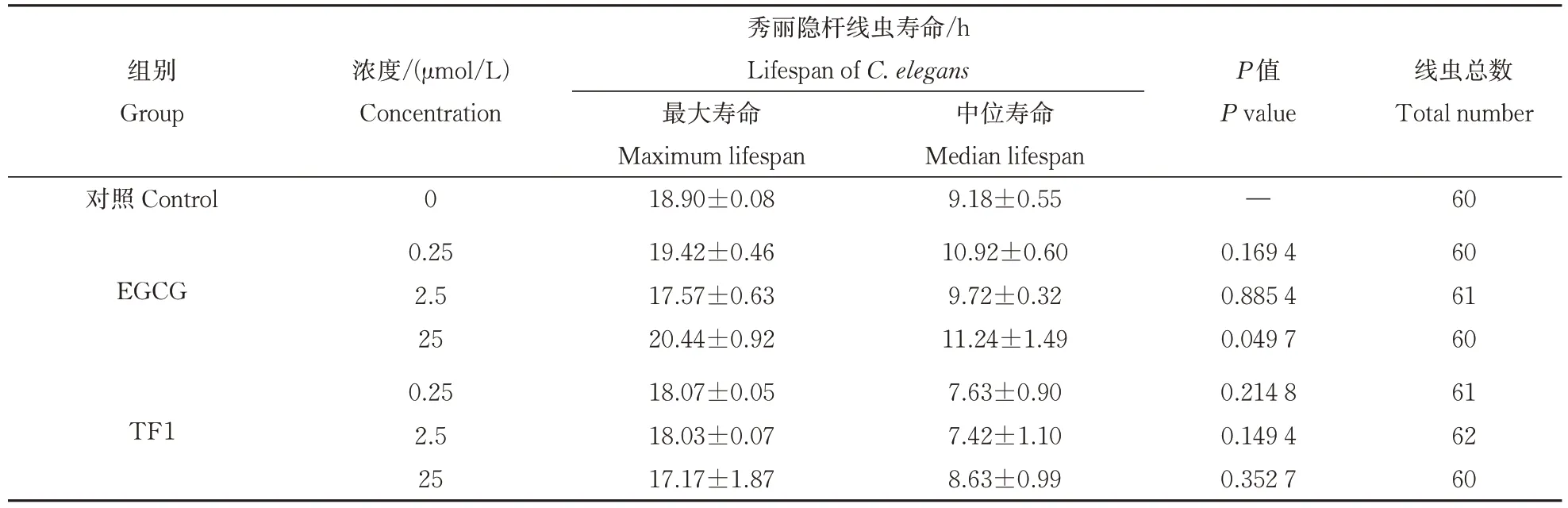
表1 EGCG和TF1孵育后35 ℃热应激条件下秀丽隐杆线虫的最大寿命和中位寿命Table 1 Maximum and median lifespan of C.elegans under heat stress at 35 ℃after incubation with EGCG and TF1
2.2 EGCG 和TF1 对冷应激秀丽隐杆线虫存活率的影响
如图2所示,在4 ℃条件下经EGCG 和TF1孵育后,中、高浓度TF1 对秀丽隐杆线虫具有一定的保护作用,但效果不显著。而EGCG 则降低了秀丽隐杆线虫在冷应激状态下的存活率,完全丧失了对秀丽隐杆线虫的保护作用。由表2 可知,在4 ℃条件下,经25 μmol/ⅬEGCG 孵育后秀丽隐杆线虫的最大寿命和中位寿命分别为17.83、9.97 d。与对照组相比,25 μmol/ⅬEGCG 将秀丽隐杆线虫的最大寿命和中位寿命分别降低了20.25%、17.94%。经低浓度TF1孵育后秀丽隐杆线虫的最大寿命和中位寿命分别降低了22.36%、16.79%。中浓度TF1对秀丽隐杆线虫的最大寿命和中位寿命无显著影响。而经高浓度TF1 孵育后秀丽隐杆线虫的最大寿命和中位寿命分别提高了9.43%、19.01%。冷应激条件下相同浓度的TF1 对秀丽隐杆线虫的保护作用强于EGCG,特别是当孵育浓度为25 μmol/Ⅼ时,TF1对秀丽隐杆线虫的保护作用最显著。
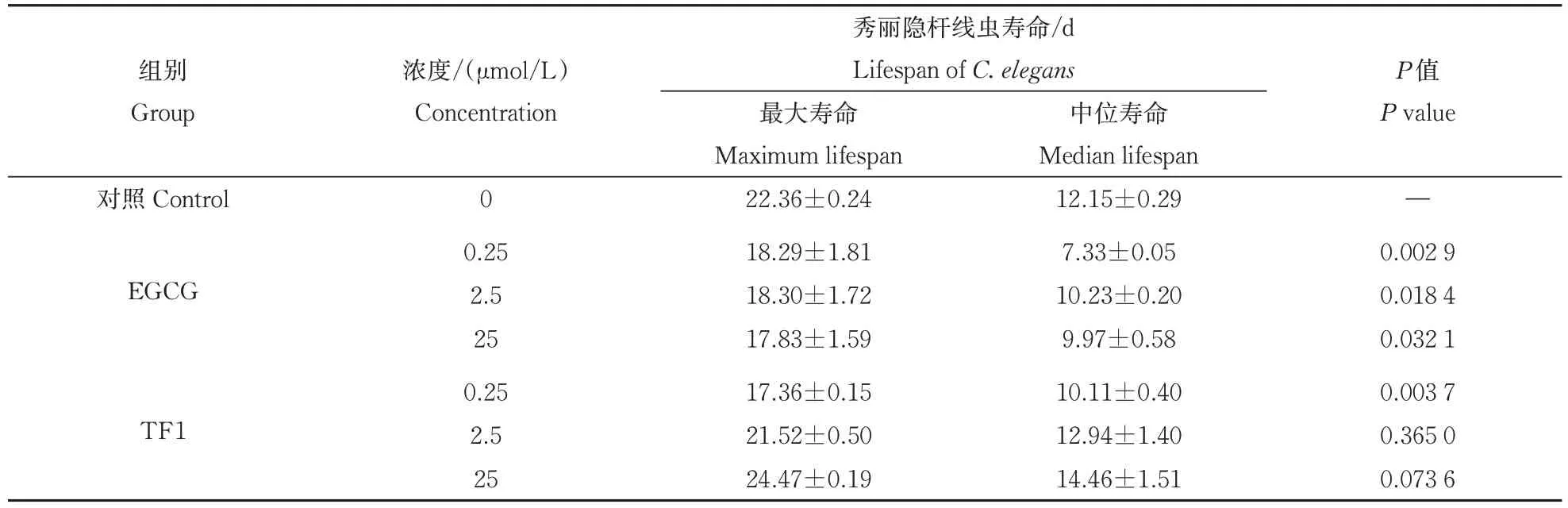
表2 EGCG和TF1孵育后4 ℃冷应激条件下秀丽隐杆线虫的最大寿命和中位寿命(线虫总数n=60)Table 2 Maximum and median lifespan of C.elegans under cold stress at 4 ℃after incubation with EGCG and TF1(total number of C.elegans,n=60)
2.3 EGCG 和TF1 对秀丽隐杆线虫脂肪含量的影响
根据冷、热应激试验结果,选取25 μmol/Ⅼ的EGCG 和TF1 孵育秀丽隐杆线虫至不同时间点后测定其体内脂肪含量。由图3A 可见,在4 ℃条件下经EGCG 和TF1 分别孵育1、5 d 后,秀丽隐杆线虫体内脂肪含量显著高于对照组。长时间(7 d)孵育后,秀丽隐杆线虫体内脂肪含量与对照组相比具有升高的趋势,但无显著差异。图3B 显示在正常培养温度20 ℃下,经EGCG 短时间孵育后,秀丽隐杆线虫体内脂肪含量显著升高,长时间孵育后,秀丽隐杆线虫体内脂肪含量显著降低。与对照组相比,TF1 可显著降低秀丽隐杆线虫体内脂肪含量。由图3C 可见,在30 ℃条件下经EGCG 短时间(1 d)孵育后,秀丽隐杆线虫体内脂肪含量显著降低,长时间(5 d)孵育后脂肪含量逐渐恢复,7 d 后与对照组相比无显著差异。经TF1 5 d、7 d 长时间孵育后,秀丽隐杆线虫体内脂肪含量呈现出先降低后升高的趋势。
2.4 EGCG 和TF1 对秀丽隐杆线虫线粒体膜电位水平的影响
图4显示了在4、20和30 ℃条件下,经25 μmol/ⅬEGCG 和TF1 孵育2 h、12 h、24 h、5 d、7 d 后秀丽隐杆线虫线粒体膜电位的变化,试验以线粒体解偶联剂FCCP 为阳性对照。由图4A 可见,在4 ℃条件下,TF1 短时间孵育2 h 后秀丽隐杆线虫线粒体膜电位水平显著降低,孵育7 d 后线粒体膜电位水平显著高于对照组。与对照组相比,在低温条件下EGCG 短时间孵育对秀丽隐杆线虫线粒体膜电位水平无显著影响,长时间孵育可提高线粒体膜电位水平。随着孵育时间的延长,秀丽隐杆线虫线粒体膜电位水平大大降低,但EGCG 和TF1 可能对衰老秀丽隐杆线虫线粒体活性具有一定的促进作用,使得其线粒体膜电位水平高于对照组。因此,在低温条件下TF1可能对年轻成虫起到了类似线粒体解偶联剂的作用,这与冷应激状态下TF1 对秀丽隐杆线虫具有的保护作用一致。由图4B 可见,当孵育温度为20 ℃时,短时间(2、12 h)孵育后TF1显著降低了秀丽隐杆线虫线粒体膜电位水平,随着孵育时间的延长,与对照组相比秀丽隐杆线虫线粒体膜电位水平显著高于对照组。经EGCG 孵育2 h 后秀丽隐杆线虫线粒体膜电位水平显著降低,长时间孵育后,线粒体膜电位水平高于对照组。在此温度条件下,EGCG 和TF1均表现出类似线粒体解偶联剂的作用,长时间孵育均能改善衰老秀丽隐杆线虫线粒体活性。由图4C可知,在30 ℃条件下,EGCG 和TF1短时间孵育12 h后秀丽隐杆线虫线粒体膜电位水平显著降低。随着孵育时间的延长,秀丽隐杆线虫死亡数增加。当孵育至24 h 时,对照组秀丽隐杆线虫活力降低,EGCG和TF1 孵育可增加线虫活力进而提高线粒体膜电位水平。与低温、正常培养温度条件试验结果一致,EGCG 和TF1 仅对年轻成虫起到了类似线粒体解偶联剂的作用。当孵育时间为5、7 d 时,热应激使秀丽隐杆线虫大部分死亡,无法通过活体秀丽隐杆线虫检测其线粒体膜电位水平。
3 讨论
环境温度是影响生物体存活率的重要因素之一,较低的环境温度可以延长变温动物的寿命[21]。秀丽隐杆线虫的正常培养温度是20 ℃,在此温度下秀丽隐杆线虫的平均寿命为20 d 左右。较高的环境温度会大大降低秀丽隐杆线虫的存活率,而低温下秀丽隐杆线虫具有更长的寿命[22]。本试验结果表明,高温(35 ℃)条件下EGCG 对秀丽隐杆线虫的保护作用显著强于TF1,低温(4 ℃)条件下TF1对秀丽隐杆线虫的保护作用强于EGCG。已有研究表明,0.1 μg/mⅬEGCG 具有抗热应激的能力,可将35 ℃条件下秀丽隐杆线虫的平均寿命提高13.1%[15]。Xiong 等[16]发现红茶提取物可延长热应激秀丽隐杆线虫的寿命。本研究通过测定不同浓度EGCG 以及TF1 对秀丽隐杆线虫在冷、热应激条件下存活率的影响发现,25 μmol/ⅬEGCG 显著提高了热应激秀丽隐杆线虫的存活率,25 μmol/ⅬTF1对热应激秀丽隐杆线虫的存活率无显著影响。25 μmol/ⅬEGCG 降低了秀丽隐杆线虫在冷应激条件下的存活率,而25 μmol/ⅬTF1 对冷应激秀丽隐杆线虫具有一定的保护作用。
为进一步验证EGCG 及TF1 对热、冷应激秀丽隐杆线虫的保护作用差异,本研究测定了不同温度条件下EGCG 和TF1对秀丽隐杆线虫脂肪含量和线粒体膜电位水平的影响。有文献报道,冷应激可激活PKA 信号进而上调激素敏感脂肪酶hosl-1 的表达,脂肪酶诱导脂肪动员,导致甘油积累,从而保护秀丽隐杆线虫免受冷应激伤害[20]。本研究中,低温(4 ℃)条件下经EGCG 和TF1 短时间孵育后秀丽隐杆线虫体内脂肪含量显著高于对照组,这一现象说明EGCG 和TF1通过某种机制补偿了脂肪分解产生甘油为秀丽隐杆线虫成虫早期提供的保护作用。Zhou 等[23]发现高温培养秀丽隐杆线虫提高了其体内的总脂肪含量。而本研究结果显示高温(30 ℃)条件下EGCG 和TF1短时间孵育会降低秀丽隐杆线虫体内的脂肪含量,但经EGCG 孵育5 d、TF1 孵育7 d后秀丽隐杆线虫体内脂肪含量升高。作为绿茶和红茶中的代表性组分,EGCG 和TF1 的生物学活性已被广泛研究。例如,膳食中添加富含EGCG 的绿茶提取物(10 mg/mⅬEGCG)会影响果蝇的葡萄糖代谢,促进健康和延长寿命[24];在健康小鼠模型中,模拟人类喝茶的方式每天喂食25 mg/kg EGCG可以使其中位寿命延长13.5%[25]。动物试验和人体试验结果均表明,TF1 可有效预防肥胖、减少甘油三酯的积累[26-27]。与先前报道的EGCG 和TF1具有降脂作用一致,本研究以秀丽隐杆线虫为模型,通过测定正常培养温度(20 ℃)条件下EGCG和TF1对其脂肪含量的影响发现,经EGCG 和TF1 长时间(5、7 d)孵育后秀丽隐杆线虫体内脂肪含量显著降低。综上所述,在20 ℃条件下EGCG 和TF1 均表现出显著的降脂作用,低温条件下可能通过某种机制对秀丽隐杆线虫成虫早期发挥保护作用进而减少了脂肪动员,高温条件下可提高脂肪含量。
线粒体功能与人体稳态息息相关,人类许多疾病的发生和发展均与线粒体功能紊乱相关,因此,研究外源性物质对其功能的影响尤为重要。研究表明,黄酮类化合物作为质子载体,通过线粒体解偶联消散线粒体膜电位诱导线粒体自噬,从而减轻与衰老相关的神经退行性变[28]。FCCP 是一种线粒体解偶联剂,常作为线粒体膜电位试验中的阳性对照。它作用于线粒体内膜使大量质子回流,从而导致线粒体膜电位降低、氧耗增加,跨膜产生的势能以热能的形式散失而导致ATP 生成减少[29]。为进一步探究TF1 是否可作为质子载体起到类似解偶联剂的作用,本研究还测定了不同温度条件下EGCG 和TF1对秀丽隐杆线虫膜电位的影响。结果显示,在低温条件下,TF1 短时间孵育2 h 可显著降低秀丽隐杆线虫线粒体膜电位水平,而EGCG 对秀丽隐杆线虫线粒体膜电位水平无显著影响。这一结果说明TF1 可能起到类似解偶联剂FCCP的作用,通过降低线粒体膜电位,进而增加热能产生从而提高冷应激线虫的存活率。本研究中线粒体膜电位试验使用的TMRE是一种可渗透细胞膜的橘红色阳离子荧光探针,可在完整的线粒体中聚集,而去极化或非活跃性线粒体膜电位降低,导致TMRE积聚减少。有文献报道,由于线粒体中TMRE 的积累依赖于线粒体活性,经TMRE 染色之后,老年线虫体内荧光强度降低[28]。本研究结果与其一致,长时间孵育后秀丽隐杆线虫体内荧光强度降低,但经EGCG 和TF1 孵育后衰老线虫体内的荧光强度提高,说明EGCG 和TF1 可提高衰老线虫的活力。
综上,在35 ℃热应激条件下,EGCG 对秀丽隐杆线虫的保护作用强于TF1;在4 ℃冷应激条件下,TF1对秀丽隐杆线虫的保护作用强于EGCG。在冷、热应激条件下,当孵育浓度为25 μmol/Ⅼ时二者对比最显著。与对照组相比,4 ℃条件下经25 μmol/ⅬTF1 短时间孵育后,秀丽隐杆线虫体内具有更高的脂肪含量和更低的线粒体膜电位,而25 μmol/ⅬEGCG 对秀丽隐杆线虫线粒体膜电位无显著影响,说明在冷应激条件下TF1 可能是通过发挥类似线粒体解偶联剂的作用而非脂肪动员,进一步促进线粒体生热从而减轻冷应激对秀丽隐杆线虫造成的伤害。正常温度条件下EGCG 和TF1均具有较好的降脂作用。随着孵育时间的延长,衰老秀丽隐杆线虫行为迟钝、生理功能下降,而EGCG 和TF1可减轻衰老对其造成的不利影响,改善其线粒体功能。
