异体自噬调控机制的研究进展*
2022-10-13周岐原李京宴田英平姚咏明
周岐原, 李京宴, 田英平△, 姚咏明
· 综述·
异体自噬调控机制的研究进展*
周岐原1, 李京宴1, 田英平1△, 姚咏明2△
(1河北医科大学第二医院急诊医学科,河北 石家庄 050000;2解放军总医院医学创新研究部转化医学研究中心,北京 100853)
自噬;异体自噬;自噬受体;病原微生物
自噬(autophagy)是机体的自我稳定与保护机制,进化上高度保守,在各种生物细胞中广泛存在。在自噬相关基因(autophagy-related gene,)的调控下,机体通过溶酶体降解自身的细胞器或大分子物质,以实现代谢需要、清除部分代谢废物或有害物质、更新某些细胞器、维持细胞内稳态。依照降解底物转运至溶酶体的途径,可将自噬分为巨自噬(macrophagy)、微自噬(microphagy)和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)3种类型,其中巨自噬为人体内主要的自噬方式,通过选择性或非选择性途径降解胞内物质[1]。
非选择性自噬可由饥饿等外界刺激诱导,在胞内形成吞噬泡随机吞入胞内物质,再经由自噬体形成、与溶酶体结合等步骤将胞内物质降解,最终将降解产物释放入胞内以维持应激状态下细胞对能量、物质的需要。在非应激状态下,机体也因经常性存在的各种诱因而保持着低水平、基础的非选择性自噬[2]。选择性自噬则不同,具有明确的目标底物,如靶向降解线粒体的线粒体自噬(mitophagy)、降解核糖体的核糖体自噬(ribophagy)等,通过特异性降解受损或功能失调的细胞器以调节细胞正常生理功能[3]。
感染性疾病是长期以来人类健康的主要挑战,由致病微生物引起[64]。部分选择性自噬间接参与了胞内致病微生物的清除,如线粒体自噬降解受损线粒体,防止应激状态下由于产生过多活性氧(reactive oxygen species, ROS)而造成的巨噬细胞死亡,保证机体正常的免疫反应[4];部分致病微生物可进入细胞内质网,内质网自噬(endoplasmic reticulum autophagy, ER-phagy)可在降解内质网时也一同降解内质网中病原体[5-6]。与上述选择性自噬不同,异体自噬(xenophagy)是细胞对致病微生物的选择性自噬过程,通过自噬作用直接特异性降解细胞内病原体,在机体抗感染中发挥重要作用,同时可通过影响机体免疫效应参与不同生理、病理过程[7](表1)。本文将从异体自噬的基本过程,调控机制,与炎症、感染及肿瘤等疾病的关系进行探讨。
1 异体自噬的主要过程
自噬过程涉及多种蛋白质复合物的精准调控,由进化上高度保守的编辑。编码生成ATG蛋白,其中ATG11、ATG101与酵母菌中Atg1-Atg10、Atg12-Atg14、Atg16、Atg18等17种ATG蛋白及其在哺乳动物中的同类物被视为核心自噬机制(core autophagy machinery),参与选择性及非选择性自噬,与其他膜转换因子共同调控自噬小体的形成。经典的自噬过程主要包括自噬的诱导激活、自噬体的成核与延伸、自噬体和溶酶体的融合、底物降解4个步骤[8]。以人类细胞自噬为例,在非应激情况下,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通过磷酸化抑制非协同51样激酶(uncoordinated 51-like kinase,ULK),防止其与腺苷5’-磷酸依赖的蛋白激酶[adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK] 相互作用。当受外界刺激后,mTORC1途径受抑制,从而激活ULK1、ATG13、200 kD黏着斑激酶家族相互作用蛋白(focal adhesion family kinase interacting protein of 200 kD, FIP200)、ATG101复合物启动自噬[9];随后Ⅲ型磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)复合物被招募至内质网附近的自噬前体(preautophagosomal structure, PAS),生成内质网相关的Ω体(omegasomes),其逐渐发展形成双层膜的碗状结构,即吞噬泡(phagophore)。包含有beclin-1、BCL-2、VPS34和ATG14的beclin-1复合体促进吞噬泡膜不断延伸,纳入胞质中成分,在泛素共轭物的协同下最终封闭成球状自噬小体。在SNARE蛋白的参与下,自噬小体与溶酶体结合,形成自噬溶酶体,并将其中内容物降解,降解产物随后经溶酶体渗透作用释放至细胞质中,参与能量及物质代谢[3]。在非选择性自噬过程中,吞噬泡随机捕获细胞质内成分,但在选择性自噬下,底物主要通过泛素化等途径标记,以供吞噬泡特异性捕获。
异体自噬的底物为胞内致病微生物及含有微生物的液泡腔。致病微生物主动侵入细胞质,或经细胞吞噬作用被动进入胞内,细菌表面的脂多糖(lipopolysaccharide, LPS)或病毒核酸产物等病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)引起核因子κB(nuclear factor-κB, NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)等信号途径改变[10-11],促进PAS形成,同时经泛素化系统的E3-泛素连接酶在病原体表面形成泛素外壳,在被自噬衔接蛋白识别后与之结合。自噬衔接蛋白具有LC3相互作用结构域(LC3 interacting region, LIR),使泛素化的病原与PAS上吞噬泡靶向结合,病原体随吞噬泡膜闭合而被封闭入自噬小体,最终经吞噬体/内体途径与溶酶体融合,在自噬溶酶体中被降解[12]。除了被吞噬作用吞入外,部分病原体通过形成液泡,进入宿主细胞,或在侵入宿主细胞后形成封闭的空泡室,例如含沙门氏菌空泡(-containing vacuoles, SCVs)[13]。当这些液泡膜受损时,液泡管腔表面的特定标记分子暴露,β-半乳糖苷聚集,从而激活泛素化反应。巨噬细胞等吞噬细胞具有吞噬及消化功能,可通过吞噬作用识别并内化胞外病原体及其他细胞或碎片,再经由活性氮中介物(reactive nitrogen intermediate, RNI)或活性氧中介物(reactive oxygen intermediate, ROI)依赖性杀菌系统等破坏吞入的底物[14]。区别于一般细胞,吞噬细胞亦可直接破坏吞噬体膜,使其中的病原体暴露,引导异体自噬[15],因此同时具有吞噬作用和异体自噬功能。异体自噬与吞噬细胞的吞噬及消化作用不同,后者在吞噬病原体后不依赖泛素化标记,直接由胞膜形成吞噬小体,后续通过杀菌系统完成对底物的破坏[14],而异体自噬则需经自噬溶酶体的融合等步骤降解病原体,相较于前者具有更强的特异性。
2 异体自噬的调控机制
异体自噬是机体免疫和细胞内稳态的重要组成部分,其过程涉及多种关键蛋白以及自噬受体调控,这些蛋白与适配器之间稳定的协调效应在异体自噬清除病原体过程中扮演了重要角色。
2.1经E3-泛素连接酶与自噬受体介导的泛素化对异体自噬的调控目前有观点认为,线粒体最初并非细胞的一部分,而是源自外来细菌[16],原本存在于细菌中的结构通过内共生方式转化为现在的线粒体[17],为真核细胞提供了高效的能量利用方式。研究证实,线粒体自噬可能是在异体自噬的基础上发展而来,通过控制这些“外来”的细胞器以维持细胞内环境稳态[18]。因此,相较于其他的选择性自噬,异体自噬与线粒体自噬有众多的共同点。
泛素化是异体自噬与线粒体自噬主要共同特征之一,两者均可通过泛素化途径对底物进行标记,再经自噬受体对底物进行识别,并将底物与自噬小体的LC3/GABARAP连接,使自噬小体捕获底物。泛素化通过泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)使泛素与底物共价连接,其中E3-泛素连接酶发挥关键作用,主要包括parkin、LRSAM1和人类三基序蛋白21(tripartite motif 21, TRIM21)等[19],前者在线粒体自噬和异体自噬中均参与泛素化过程,而LRSAM1和TRIM21则主要针对病原体的泛素化。parkin蛋白参与众多生理、病理过程,包括线粒体自噬,可通过PINK1/parkin通路维持线粒体稳态,研究证实该信号通路缺陷可导致帕金森等疾病[20]。在异体自噬过程中,parkin蛋白与侵入的病原体共定位,通过不同氨基酸残基与相应病原体外壳相连接,对其进行泛素化修饰,从而形成泛素化外壳[12]。新近资料显示,在基因缺陷小鼠中,parkin合成障碍,导致其对结核分枝杆菌、鼠伤寒沙门菌等病原体高度敏感[21],证明parkin对异体自噬的重要作用,然而针对其如何聚集于病原体所在部位仍无明确解释。与parkin不同,LRSAM1具有SAM结构域和作为E3泛素-蛋白连接酶的环形结构域,其N端富含亮氨酸重复序列(leucine rich repeat, LRR)参与PAMPs的识别,使LRSAM1能准确定位胞内病原体并将其表面泛素化[22]。以LRSAM1等为首的E3-连接酶主要通过识别病原体本身或受损的SCVs,对病原体进行定位;此外,亦存在不直接识别致病微生物的蛋白分子。TRIM蛋白家族中多种成员参与泛素化,包括TRIM9[23]、TRIM18[24]、TRIM21[25]及TRIM36[26]等。以TRIM21为例,除了通过其SPRY结构域与细菌FC区相互作用外,TRIM21也可通过与附着于肠道沙门氏菌的抗体结合,聚集于肠道沙门氏菌旁,最终诱导其泛素化[27]。致病微生物经过这些E3-泛素连接酶修饰,在表面形成泛素化外壳后释放出“吃我”的信号,被具有泛素结合结构域(ubiquitin-binding domains, UBDs)的自噬受体识别并结合。
自噬受体为一类特殊的蛋白,参与吞噬泡或自噬体与降解底物间的连接。异体自噬与泛素依赖性的线粒体自噬在哺乳动物中具有相同自噬受体,即NDP52/CALCOCO2(calcium binding and coiled-coil domain 2)、p62/SQSTM1(sequestosome 1)、视神经素(optineurin, OPTN)和Tax1结合蛋白(Tax1 binding protein 1, TAX1BP1)[28],它们具有不同的UBDs和蛋白质间相互作用模体,可针对不同泛素链进行结合,并介导其后吞噬泡膜的延长[29]。p62作为一种自噬受体,包含多个可与其他蛋白质相互作用的区域,如N端Phox和Bem1结构域(PB1)、ZZ型锌指(zinc finger, ZF)结构、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6, TRAF6)结合域、Keap1相互作用蛋白(Keap1-interacting protein 1)及C端泛素相关结构域(ubiquitin-associated domains, UBA)等[30]。PB1结构域可介导自身或其他蛋白PB1结构域相互作用,促进p62与底物的共聚集;UBA可与多聚泛素化链直接相互作用,使p62与泛素化外壳结合。在此基础上,p62与ATG8s相互作用,后者可通过脂质尾与吞噬泡内膜相连接,从而使p62与底物聚集体被吞噬泡吞噬[28](图1)。NDP52为核点(nuclear dots, NDs)蛋白家族成员,羧基末端包含LIM结构域和ZF结构;ZF结构可与单泛素或多聚泛素混杂聚结合,进而与包裹细菌的泛素化外壳接触,其非传统的LIR差异性地结合不同的LC3/GABARAP,最终将泛素化的细菌与ATG机制相连接[31-32]。氨基末端则存在骨骼肌和肾脏腹肌肌醇磷酸酶羧基同源性(skeletal muscle and kidney-enriched inositol phosphatase carboxyl homology, SKICH)30结构域,NDP52通过其中央卷曲区域形成二聚体,再经SKICH结构域与NAP1(nucleosome assembly protein 1)二聚体的N端螺旋结构域间之间发生相互作用,形成四聚体,并进一步与TANK结合激酶1(Tank binding kinase 1, TBK1)二聚体结合,形成杂六聚体,与NDP52共同招募至泛素化病原体上,调节后续的异体自噬过程[33]。除此之外, NDP52还包含特殊的半乳糖凝集素8(galectin-8)相互作用位点,能特异性与病原体的糖受体galectin-8相互作用,与病原体及其产物靶向结合[34]。在伤寒沙门杆菌感染过程中,galectin-3、-8、-9被招募至SCVs表面对其进行标记,随着NDP52与galectin-8的结合,启动针对SCVs的异体自噬。TAX1BP1是NDP52的同源物,与NDP52具有高度相似的LIR模体、SKICH结构域和C端ZF结构,两者主要差异在于不同中央卷曲区域[33],且TAX1BP1不含有galectin-8相互作用位点。研究显示,两者在诱导自噬过程中不可或缺,缺失将导致致病菌的积累[35]。与前三者相似,OPTN具有多种结构域,如C端ZF结构、亮氨酸拉链结构域、LIR结构域及ABIN和NEMO结构域(UBAN)中泛素结合。OPTN通过卷曲模体实现自身寡聚,并由 UBAN结构域特异性识别细菌泛素化外壳上的M1和K63连接的泛素链[36]。TBK1在OPTN介导的异体自噬过程中发挥重要作用,通过诱导OPTN磷酸化增强其与LC3相互作用,从而促进自噬小体的形成,且上调OPTN与多条泛素链的结合能力,显著抑制沙门氏菌等病原微生物的生长[37]。
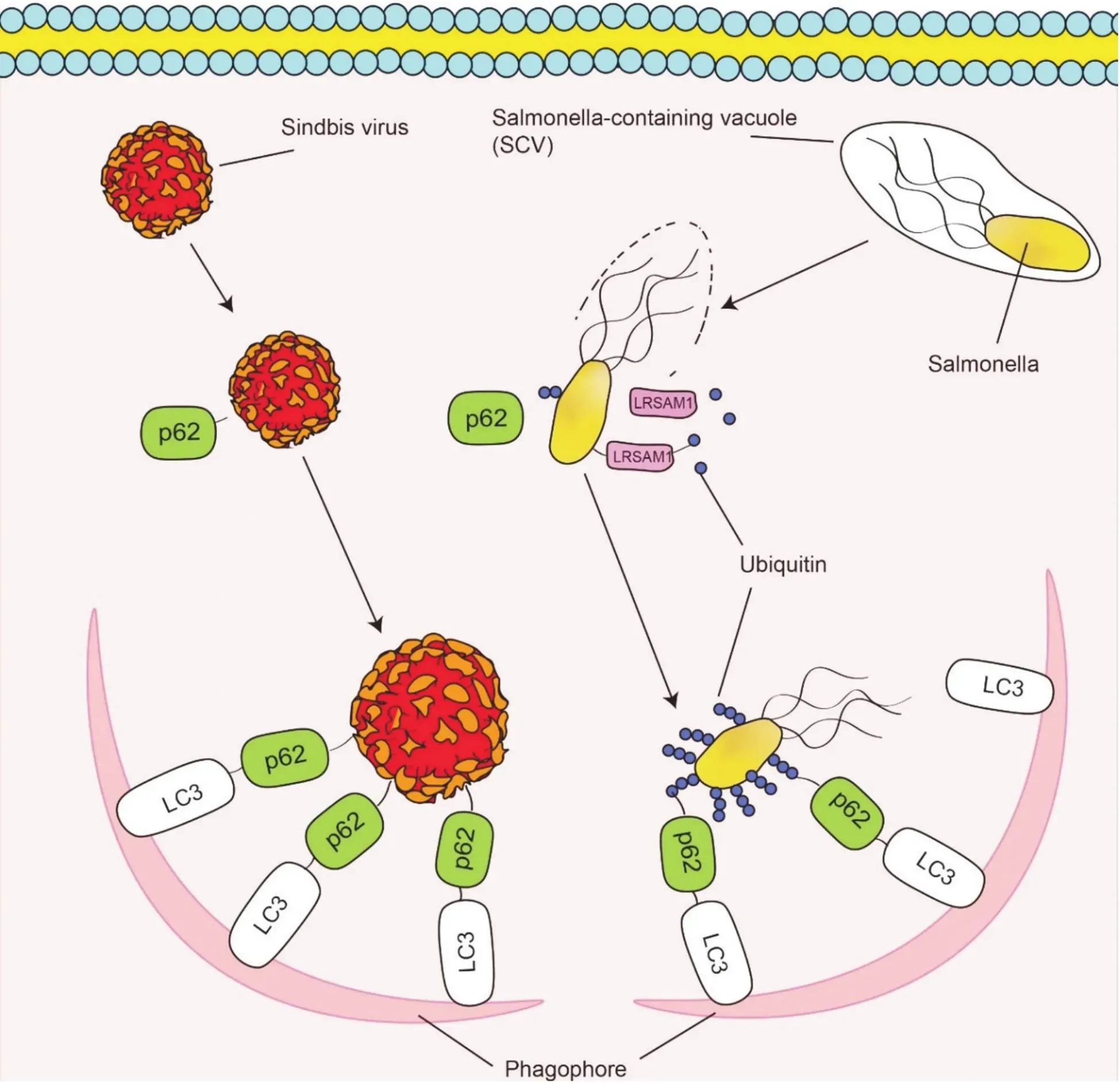
Figure 1. Key steps of Xenophagy in infection of Sindbis virus and Salmonella. p62 interacts with Sindbis virus capsid protein and targets Sindbis virus to the phagophore. Salmonella can be detected by LRSAM1 that generates a dense Ub coat. p62 mediates Salmonella capture by LC3-conjugated phagophores. LC3: light chain 3; LRSAM1: leucine rich repeat and sterile alpha motif containing 1; Ub: ubiquitin.
由此可见,以上4种自噬受体在异体自噬中具有重要作用,单独抑制其中一条通路即可增加病原体的增殖活性,且无法通过其他几种自噬蛋白信号弥补,然而,其确切调控机制尚不清楚[36, 38]。
2.2自噬相关蛋白对异体自噬的调控在选择性及非选择性自噬过程中,ATG蛋白在调控机制中发挥关键作用。核心自噬机制在自噬过程中主要分为以下几个亚组,即调控自噬启动的ATG1/ULK1复合物、PI3K复合物,调控自噬体形成及膜延伸的ATG12-ATG5-ATG16复合物、LC3-ATG8复合物以及调控自噬体成熟的ATG9、VMP1[39]。以上亚组在自噬过程中普遍存在,系各种自噬的共有调控途径,在此基础上,部分ATG蛋白在异体自噬过程中发挥了与以往不同的功能,进一步调节异体自噬。
ATG16-L1主要在ATG12-ATG5-ATG16复合物中参与含病原体液泡封入自噬体膜组装过程。泛素激活酶形式的ATG7和泛素结合酶形式的ATG10将泛素样ATG12与ATG5结合[40-41],ATG16-L1使用氨基末端结构域结合ATG5-ATG12复合体,形成ATG12-ATG5-ATG16复合物[42],引导后续自噬小体膜的延伸与闭合。除此之外,ATG16-L1含有重复序列,该结构参与ATG16-L1和V-ATP酶(V-ATPase)的相互作用。V-ATP酶是一种进化上保守的ATP驱动质子泵,包含跨膜V0结构域转运氢离子和细胞溶质V1结构域ATP,定位于溶酶体膜,可将质子泵入溶酶体使其酸化促成溶酶体的降解[43],并参与活化mTORC1激酶,从而阻断mTORC1的激活,促进自噬启动。当病原体入侵时,V-ATPase将ATG5和ATG16-L1招募至受损的含细菌液泡中,启动ATG12-ATG5-ATG16复合物的形成[42]。当基因缺失时,细胞整体自噬不受影响,但异体自噬过程明显受抑,提示ATG16-L1与V-ATP酶之间的相互作用特异性地调节异体自噬,其作用机制有待深入探索。
哺乳动物自噬相关蛋白8(mammalian autophagy-related protein 8,mATG8s)通过可逆的脂化过程锚定于吞噬泡的内层及外层膜上,在吞噬泡形成过程中作为适配器招募含有LIR的自噬受体至吞噬泡内、外层膜上[44],从而将自噬受体、底物和吞噬泡膜三者连接,OPTN、p62、NDP52及TAX1BP1等4种不同的自噬受体与特定的ATG8间相互作用形成了异体自噬的特异性。
2.3非泛素依赖途径与其他蛋白对异体自噬的调控研究明确,泛素化在多数病原体异体自噬的识别过程中不可或缺,但仍有部分病原体其异体自噬过程不依赖于泛素化,如胞质中正链RNA 病毒辛德毕斯(Sindbis)病毒,其异体自噬过程依赖于p62和壳体蛋白的相互作用,而不需要泛素化的参与[45](图1)。部分异体自噬过程亦不涉及p62和NDP52等自噬受体,而是通过其他分子介导。在SCVs靶向连接自噬小体的过程中,部分受损SCVs未出现泛素化现象,而是通过脂质第二信使甘油二脂(diacylglycerol,DAG)作为共定位信号。DAG的生成依赖于磷脂酸磷酸酶(phosphatidic acid phosphatase,PAP)途径,而后者的激活需通过磷脂酶D(phospholipase D,PLD),在此基础上,DAG经由蛋白激酶C及其下游靶点JNK和NADPH氧化酶共定位于液泡,随后通过LC3与吞噬泡膜相连接[46]。
除了自噬受体和ATG蛋白等在其他自噬过程中常见的蛋白分子外,异体自噬过程的调控也依赖于某些特定的大分子复合物。Rab GTP酶(GTPase)是一类含有TBC结构域的蛋白家族,参与调控胞内膜泡运输,Rab GTP酶和SNARE复合体辅助自噬小体运动使其最终与溶酶体融合是Rab GTP酶在自噬过程中最显著特征[47]。此外,Rab GTP酶通过影响自噬小体形成等途径进而调控异体自噬,且该家族中有多种蛋白参与内体的形成,例如Rab1和Rab17参与吞噬泡在内质网附近的形成过程;在化脓性链球菌(group A, GAS)感染时,Rab5参与了内体的形成,Rab7则调节内体的成熟和自噬小体形成;Rab9A参与含GAS自噬体样空泡的扩大,它与调控自噬小体形成的Rab23在其他自噬过程中并非必需的,而是特异性存在于异体自噬过程,调控内体与自噬溶酶体形成。
RUFY4为包含RUN和FYVE结构域蛋白家族成员之一,在肺泡巨噬细胞呈高表达,参与线粒体自噬和异体自噬。RUFY4包含螺旋线圈模体、N端运行域和C端FYVE结构域,过度表达可增强自噬流,诱导LC3降解。FYVE结构域上游还存在OmpH结构域,不仅促进自噬过程中与线粒体的结合,也可辅助细菌外膜蛋白的折叠及与膜结合过程,增强异体自噬[48-49]。
异体自噬调控机制的总结见图2。
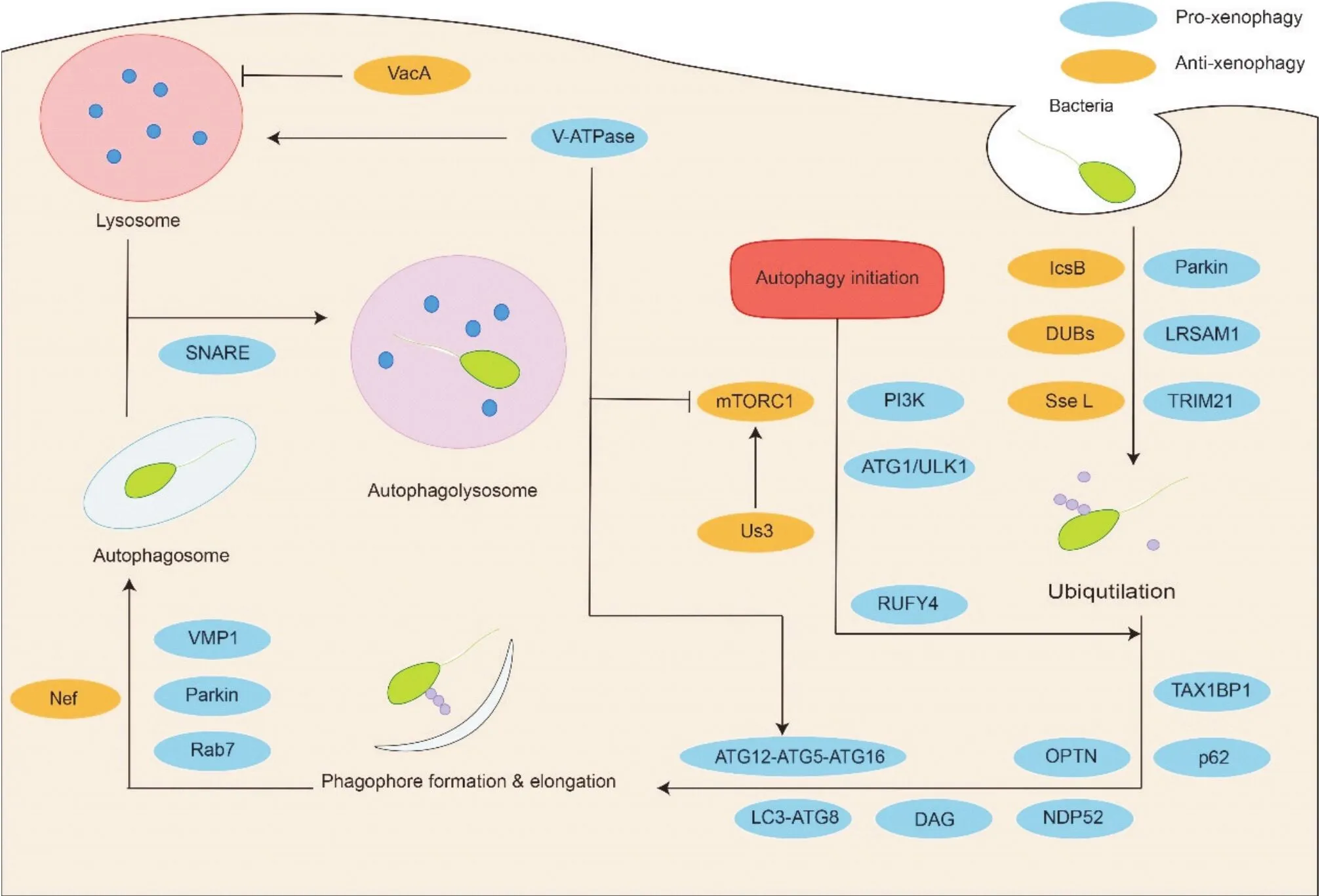
Figure 2. Activation and inhibition mechanisms of xenophagy. DAG: diacylglycerol; DUBs: deubiquitinases; LC3: light chain 3; LRSAM1: leucine rich repeat and sterile alpha motif containing 1; mTOR: mammalian target of rapamycin: NDP52: nuclear dots protein 52; OPTN: optineurin; RUFY4: RUN and FYVE domain containing 4; SNARE: soluble N-ethylmaleimide-sensitive factor attachment proteins receptor; TAX1BP1: Tax1 binding protein 1; TRIM21: tripartite motif 21; ULK1: uncoordinated 51-like kinase 1; VacA: vacuolating cytotoxin; VMP1: vacuole membrane protein 1.
3 异体自噬在炎症、感染及肿瘤中的作用
与其他选择性自噬相似,异体自噬参与多种疾病的发生发展过程,通过对胞内致病微生物的特异性清除,其在机体对抗感染性疾病时发挥重要作用。异体自噬直接降解胞内病原体及其产物抵御病原微生物的感染,并借此减少炎症细胞因子产生,防止过度炎症反应所致细胞损伤;同时,将病原体部分成分转运至含有TLR的内体,协助机体对病原体的识别[50],增强天然免疫应答。然而,许多研究表明,在与机体免疫对抗过程中,病原微生物已进化出一系列机制来适应异体自噬,从而提高其在胞内的存活率。
病原体依靠多种方式逃避异体自噬的清除,如分枝杆菌、军团菌、沙门氏菌,通过包埋于内体中避免自噬机制的识别与降解,并在需要时分解内体[10],再次逃逸至胞内,造成二次感染。内体中沙门氏菌还具有修复内体周围膜损伤的功能,避免损伤后膜上特异性位点暴露,保证其长时间生存[51]。某些病原体通过干扰泛素化途径影响异体自噬,包括抑制泛素化和去泛素化。以福氏志贺菌(S.flexneri)感染为例,正常情况下,进入细胞的志贺菌其表面毒力因子VirG作为ATG5的配体被识别,其后经泛素化与吞噬泡结合。据报道,福氏志贺菌可产生效应子IcsB与VirG竞争性结合,防止自身表面的泛素化,从而抑制细菌与吞噬泡的结合。立克次体也可通过将其外膜蛋白的赖氨酸甲基化,逃避泛素化机制的识别[52]。此外,一些病原体可分泌去泛素化酶(deubiquitinases, DUBs),降解病原微生物表面的泛素化外壳,从而抑制泛素化途径介导的异体自噬。鼠沙门氏菌可分泌Sse L效应蛋白,不仅能抑制NF-κB信号通路[53],还具有去泛素化酶活性,在沙门氏菌感染过程中将SCVs周围的聚集物去泛素化,确保SCVs及其中的沙门氏菌存活[54]。除了干扰识别与泛素化过程,病原体还可通过其他方式影响异体自噬。I型单纯疱疹病毒(HSV-1)产物Us3激酶可激活mTORC1,拮抗应激状态下对mTORC1的抑制作用,下调自噬的启动[55]。HIV编码蛋白Nef通过干扰自噬小体的成熟,进一步抑制异体自噬[56]。机体感染时,巨噬细胞早期发生经典激活,使胞内自噬出现短暂抑制,产生大量ROS对胞内病原体进行杀伤,而潜伏期的卡波西肉瘤疱疹病毒(KSHV)则通过一种未知的机制,在ROS刺激下重新激活并大量增殖[57]。除此之外,病原体发展出特定的机能,通过加强并利用自噬来维持自身生存和增殖。自噬溶酶体降解后循环产物可被细菌利用作为维持生存所需的营养,自噬过程中形成的囊泡也可被用于其自身的增殖和存活,如军团菌生成军团菌囊泡(Legionella-containing vesicles,LCV),通过毒力因子ank B捕获游离的氨基酸,将氨基酸转运至LCV中为自身增殖提供必要的物质及能量[58]。
病原体逃避或利用异体自噬对机体抵抗感染造成了极大阻碍,极易发生反复感染,造成慢性炎症,或发展为脓毒症等严重的全身性感染,影响患者预后。长期感染性应激会引发肿瘤基因过度表达,最终导致肿瘤发生。幽门螺杆菌参与了胃癌发生,可分泌细胞毒素相关蛋白A(cytotoxin associated gene-Aprotein,CagA),通过c-Met-PI3K/Akt-mTOR信号通路抑制自噬,并激活NF-κB,刺激IL-8大量产生,促使慢性炎症发生与发展[59]。同时,幽门螺杆菌的另一产物细胞空泡毒素(vacuolating cytotoxin,VacA)可诱导异体自噬的发生,但长期暴露于VacA的细胞会造成溶酶体成熟障碍,使异体自噬水平降低,以致幽门螺杆菌的长期感染及胃癌的发生[60]。
异体自噬异常与感染性疾病及与之相关的炎症、肿瘤发生发展密不可分,因此,确保异体自噬机制的正常运转对防治感染性疾病具有重要意义。目前,已有实验证明,通过诱导异体自噬可有效达到清除致病微生物、防治相关疾病的目的,如5-氨基乙酰丙酸光动力疗法(5-aminolevulinic acid photodynamic therapy, ALA-PDT)可调节Ras/Raf/MEK/ERK及PI3K/Akt/mTOR通路,诱导异体自噬,降低HPV感染Hela细胞的HPV病毒载量[61];植物提取物金合欢素(acacetin)为异体自噬调节剂,经mTOR非依赖性途径调控异体自噬,可显著减少沙门氏菌感染小鼠细胞内沙门氏菌含量[62]。在此基础上,有学者提出利用自噬诱导剂激活异体自噬,通过异体自噬对病原体的广谱杀伤效应且不易产生耐药性的特点,起到代替抗生素的作用[63]。该推测为抗感染治疗提供了新策略,但如何避免病原体的逃避作用仍亟待解决。
4 问题与展望
目前,异体自噬作为机体抗感染的天然防御系统,其分子机制及调控靶点备受关注。然而,该领域研究仍存在许多困难与挑战。首先,由于异体自噬降解底物的特殊性,不同致病微生物的异体自噬过程可能完全不同,微生物的代谢产物、组成成分和降解产物也可能对异体自噬过程产生不同的影响,造成其研究进展缓慢。其次,与其他选择性自噬研究相似,异体自噬的研究大多停留在动物实验及体外细胞水平,大规模临床试验及最终用于人类治疗的先导化合物亟待进一步探索。此外,现有研究多集中于单一病原微生物的异体自噬过程,而忽视了感染过程中异体自噬与机体整体的相互作用以及临床上常见多种病原体感染,导致客观认识的滞后及不足。作为近年来提出的新概念,未来异体自噬领域存在诸多重要科学问题亟待解决。例如,异体自噬如何调控其他自噬、在感染性疾病的发病过程中与代谢等因素的相互作用需要进一步澄清;增强或抑制异体自噬对胞内病原体的清除作用是否会影响天然免疫及获得性免疫的免疫记忆形成,这一问题也值得深入思考。总之,异体自噬在严重感染及相关疾病中发挥重要作用,深刻了解异体自噬与病原体间作用的机制以及其在机体免疫反应中的调控环节,将为人类对抗病原微生物提供新思路、开辟新途径。
[1] Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation[J]. Nature, 2011, 469(7330):323-335.
[2] Anding AL, Baehrecke EH. Autophagy in cell life and cell death[J]. Curr Top Dev Biol, 2015, 114:67-91.
[3] Anding AL, Baehrecke EH. Cleaning house: selective autophagy of organelles[J]. Dev Cell, 2017, 41(1):10-22.
[4] Matta SK, Kumar D. AKT mediated glycolytic shift regulates autophagy in classically activated macrophages[J]. Int J Biochem Cell Biol, 2015, 66:121-133.
[5] Lennemann NJ, Coyne CB. Dengue and Zika viruses subvert reticulophagy by NS2B3-mediated cleavage of FAM134B[J]. Autophagy, 2017, 13(2):322-332.
[6] Chiramel AI, Dougherty JD, Nair V, et al. FAM134B, the selective autophagy receptor for endoplasmic reticulum turnover, inhibits replication of Ebola virus strains makona and mayinga[J]. J Infect Dis, 2016, 214(Suppl 3):S319-S325.
[7] Deretic V, Saitoh T, Akira S. Autophagy in infection, inflammation and immunity[J]. Nat Rev Immunol, 2013, 13(10):722-737.
[8] Mizushima N, Levine B. Autophagy in human diseases[J]. N Engl J Med, 2020, 383(16):1564-1576.
[9] Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13(2):132-141.
[10] Xu Y, Jagannath C, Liu XD, et al. Toll-like receptor 4 is a sensor for autophagy associated with innate immunity[J]. Immunity, 2007, 27(1):135-144.
[11] Jounai N, Takeshita F, Kobiyama K, et al. The Atg5 Atg12 conjugate associates with innate antiviral immune responses[J]. Proc Natl Acad Sci U S A, 2007, 104(35):14050-14055.
[12] Tripathi-Giesgen I, Behrends C, Alpi AF. The ubiquitin ligation machinery in the defense against bacterial pathogens[J]. EMBO Rep, 2021, 22(11):e52864.
[13] LaRock DL, Chaudhary A, Miller SI. Salmonellae interactions with host processes[J]. Nat Rev Microbiol, 2015, 13(4):191-205.
[14] Shiloh MU, Nathan CF. Reactive nitrogen intermediates and the pathogenesis ofand mycobacteria[J]. Curr Opin Microbiol, 2000, 3(1):35-42.
[15] Schnettger L, Rodgers A, Repnik U, et al. A Rab20-dependent membrane trafficking pathway controls M. tuberculosis replication by regulating phagosome spaciousness and integrity[J]. Cell Host Microbe, 2017, 21(5):619-628.e5.
[16] Embley TM, Martin W. Eukaryotic evolution, changes and challenges[J]. Nature, 2006, 440(7084):623-630.
[17] Archibald JM. Endosymbiosis and eukaryotic cell evolution[J]. Curr Biol, 2015, 25(19):R911-R921.
[18] Singh A, Kendall SL, Campanella M. Common traits spark the mitophagy/xenophagy interplay[J]. Front Physiol, 2018, 9:1172.
[19] Franco LH, Nair VR, Scharn CR, et al. The ubiquitin ligase Smurf1 functions in selective autophagy ofand anti-tuberculous host defense[J]. Cell Host Microbe, 2017, 21(1):59-72.
[20] Redmann M, Dodson M, Boyer-Guittaut M, et al. Mitophagy mechanisms and role in human diseases[J]. Int J Biochem Cell Biol, 2014, 53:127-133.
[21] Manzanillo PS, Ayres JS, Watson RO, et al. The ubiquitin ligase parkin mediates resistance to intracellular pathogens[J]. Nature, 2013, 501(7468):512-516.
[22] Perrin AJ, Jiang X, Birmingham CL, et al. Recognition of bacteria in the cytosol of mammalian cells by the ubiquitin system[J]. Curr Biol, 2004, 14(9):806-811.
[23] Rose JE, Behm FM, Drgon T, et al. Personalized smoking cessation: interactions between nicotine dose, dependence and quit-success genotype score[J]. Mol Med, 2010, 16(7/8):247-253.
[24] Short KM, Hopwood B, Yi Z, et al. MID1 and MID2 homo- and heterodimerise to tether the rapamycin-sensitive PP2A regulatory subunit, alpha 4, to microtubules: implications for the clinical variability of X-linked Opitz GBBB syndrome and other developmental disorders[J]. BMC Cell Biol, 2002, 3:1.
[25] Hos NJ, Fischer J, Hos D, et al. TRIM21 is targeted for chaperone-mediated autophagy duringTyphimurium infection[J]. J Immunol, 2020, 205(9):2456-2467.
[26] Singh N, Kumble Bhat V, Tiwari A, et al. A homozygous mutation in TRIM36 causes autosomal recessive anencephaly in an Indian family[J]. Hum Mol Genet, 2017, 26(6):1104-1114.
[27] Rakebrandt N, Lentes S, Neumann H, et al. Antibody- and TRIM21-dependent intracellular restriction of[J]. Pathog Dis, 2014, 72(2):131-137.
[28] Lamark T, Svenning S, Johansen T. Regulation of selective autophagy: the p62/SQSTM1 paradigm[J]. Essays Biochem, 2017, 61(6):609-624.
[29] Kirkin V, Rogov VV. A diversity of selective autophagy receptors determines the specificity of the autophagy pathway[J]. Mol Cell, 2019, 76(2):268-285.
[30] Lin X, Li S, Zhao Y, et al. Interaction domains of p62: a bridge between p62 and selective autophagy[J]. DNA Cell Biol, 2013, 32(5):220-227.
[31] von Muhlinen N, Akutsu M, Ravenhill BJ, et al. LC3C, bound selectively by a noncanonical LIR motif in NDP52, is required for antibacterial autophagy[J]. Mol Cell, 2012, 48(3):329-342.
[32] Xie X, Li F, Wang Y, et al. Molecular basis of ubiquitin recognition by the autophagy receptor CALCOCO2[J]. Autophagy, 2015, 11(10):1775-1789.
[33] Fu T, Liu J, Wang Y, et al. Mechanistic insights into the interactions of NAP1 with the SKICH domains of NDP52 and TAX1BP1[J]. Proc Natl Acad Sci U S A, 2018, 115(50):E11651-E11660.
[34] Kim BW, Hong SB, Kim JH, et al. Structural basis for recognition of autophagic receptor NDP52 by the sugar receptor galectin-8[J]. Nat Commun, 2013, 4:1613.
[35] Tumbarello DA, Manna PT, Allen M, et al. The autophagy receptor TAX1BP1 and the molecular motor myosin VI are required for clearance of Salmonella typhimurium by autophagy[J]. PLoS Pathog, 2015 11(10):e1005174.
[36] Wild P, Farhan H, McEwan DG, et al. Phosphorylation of the autophagy receptor optineurin restricts Salmonella growth[J]. Science, 2011, 333(6039):228-233.
[37] Richter B, Sliter DA, Herhaus L, et al. Phosphorylation of OPTN by TBK1 enhances its binding to Ub chains and promotes selective autophagy of damaged mitochondria[J]. Proc Natl Acad Sci U S A, 2016, 113(15):4039-4044.
[38] Gatica D, Lahiri V, Klionsky DJ. Cargo recognition and degradation by selective autophagy[J]. Nat Cell Biol, 2018, 20(3):233-242.
[39] Nakatogawa H, Suzuki K, Kamada Y, et al. Dynamics and diversity in autophagy mechanisms: lessons from yeast[J]. Nat Rev Mol Cell Biol, 2009, 10(7):458-467.
[40] Tanida I, Mizushima N, Kiyooka M, et al. Apg7p/Cvt2p: a novel protein-activating enzyme essential for autophagy[J]. Mol Biol Cell, 1999, 10(5):1367-1379.
[41] Shintani T, Mizushima N, Ogawa Y, et al. Apg10p, a novel protein-conjugating enzyme essential for autophagy in yeast[J]. EMBO J, 1999, 18(19):5234-5241.
[42] Huang J, Brumell JH. Bacteria-autophagy interplay: a battle for survival[J]. Nat Rev Microbiol, 2014, 12(2):101-114.
[43] Zhao J, Benlekbir S, Rubinstein JL. Electron cryomicroscopy observation of rotational states in a eukaryotic V-ATPase[J]. Nature, 2015, 521(7551):241-245.
[44] Birgisdottir ÅB, Lamark T, Johansen T. The LIR motif: crucial for selective autophagy[J]. J Cell Sci, 2013, 126(Pt 15):3237-3247.
[45] Orvedahl A, MacPherson S, Sumpter R Jr, et al. Autophagy protects against Sindbis virus infection of the central nervous system[J]. Cell Host Microbe, 2010, 7(2):115-127.
[46] Shahnazari S, Yen WL, Birmingham CL, et al. A diacylglycerol-dependent signaling pathway contributes to regulation of antibacterial autophagy[J]. Cell Host Microbe, 2010, 8(2):137-146.
[47] Shen Q, Shi Y, Liu J, et al. Acetylation of STX17 (syntaxin 17) controls autophagosome maturation[J]. Autophagy, 2021, 17(5):1157-1169.
[48] Terawaki S, Camosseto V, Prete F, et al. RUN and FYVE domain-containing protein 4 enhances autophagy and lysosome tethering in response to interleukin-4[J]. J Cell Biol, 2015, 210(7):1133-1152.
[49] Valečka J, Camosseto V, McEwan DG, et al. RUFY4 exists as two translationally regulated isoforms, that localize to the mitochondrion in activated macrophages[J]. R Soc Open Sci, 2021, 8(7):202333.
[50] Kudchodkar SB, Levine B. Viruses and autophagy[J]. Rev Med Virol, 2009, 19(6):359-378.
[51] Kreibich S, Emmenlauer M, Fredlund J, et al. Autophagy proteins promote repair of endosomal membranes damaged by thetype three secretion system 1[J]. Cell Host Microbe, 2015, 18(5):527-537.
[52] Engström P, Burke TP, Tran CJ, et al. Lysine methylation shields an intracellular pathogen from ubiquitylation and autophagy[J]. Sci Adv, 2021, 7(26):eabg2517.
[53] Le Negrate G, Faustin B, Welsh K, et al.secreted factor L deubiquitinase ofinhibits NF-κB, suppresses IκBα ubiquitination and modulates innate immune responses[J]. J Immunol, 2008, 180(7):5045-5056.
[54] Mesquita FS, Thomas M, Sachse M, et al. Thedeubiquitinase SseL inhibits selective autophagy of cytosolic aggregates[J]. PLoS Pathog, 2012, 8(6):e1002743.
[55] Rubio RM, Mohr I. Inhibition of ULK1 and Beclin1 by an α-herpesvirus Akt-like Ser/Thr kinase limits autophagy to stimulate virus replication[J]. Proc Natl Acad Sci U S A, 2019, 116(52):26941-26950.
[56] Kyei GB, Dinkins C, Davis AS, et al. Autophagy pathway intersects with HIV-1 biosynthesis and regulates viral yields in macrophages[J]. J Cell Biol, 2009, 186(2):255-268.
[57] Ye F, Zhou F, Bedolla RG, et al. Reactive oxygen species hydrogen peroxide mediates Kaposi's sarcoma-associated herpesvirus reactivation from latency[J]. PLoS Pathog, 2011, 7(5):e1002054.
[58] Zhang YJ, Rubin EJ. Feast or famine: the host-pathogen battle over amino acids[J]. Cell Microbiol, 2013, 15(7):1079-1087.
[59] Li N, Tang B, Jia YP, et al.CagA protein negatively regulates autophagy and promotes inflammatory response via c-Met-PI3K/Akt-mTOR signaling pathway[J]. Front Cell Infect Microbiol, 2017, 7:417.
[60] Greenfield LK, Jones NL. Modulation of autophagy byand its role in gastric carcinogenesis[J]. Trends Microbiol, 2013, 21(11):602-612.
[61] Xie J, Wang S, Li Z, et al. 5-aminolevulinic acid photodynamic therapy reduces HPV viral load via autophagy and apoptosis by modulating Ras/Raf/MEK/ERK and PI3K/AKT pathways in HeLa cells[J]. J Photochem Photobiol B, 2019, 194:46-55.
[62] Ammanathan V, Mishra P, Chavalmane AK, et al. Restriction of intracellularreplication by restoring TFEB-mediated xenophagy[J]. Autophagy, 2020, 16(9):1584-1597.
[63] Ammanathan V, Vats S, Abraham IM, et al. Xenophagy in cancer[J]. Semin Cancer Biol, 2020, 66:163-170.
[64] Morens DM, Folkers GK, Fauci AS. The challenge of emerging and re-emerging infectious diseases[J]. Nature, 2004, 430(6996):242-249.
Potential regulatory mechanism of xenophagy
ZHOU Qi-yuan1, LI Jing-yan1, TIAN Ying-ping1△, YAO Yong-ming2△
(1,,050000,;2,,100853,)
Autophagy is aselfdigesting mechanism responsible forremovalofdamaged organellesand other intracellular components. It is closely related to inflammation and immunity. Xenophagy, a specialized form of autophagy, can specifically degrade intracellular pathogenic microorganisms to resist infection caused by pathogens. Xenophagy is involved in the occurrence and development of various diseases. The current review focuses on the main process, regulatory mechanism, research progress of xenophagy as well as its roles in human diseases such as inflammation, infection, and tumor, with in-depth discussion regarding to its potential impact on the anti-infection treatment.
Autophagy; Xenophagy; Autophagy receptors; Pathogenic microorganisms
1000-4718(2022)09-1677-09
2022-04-11
2022-07-29
0311-66002707; E-mail: tianyingping-jzh@163.com(田英平); c_ff@sina.com(姚咏明)
R363.2; R392.12
A
10.3969/j.issn.1000-4718.2022.09.018
[基金项目]国家自然科学基金重点项目(No. 81730057; No. 82130062)
(责任编辑:李淑媛,罗森)
