氯吡格雷相关胰岛素自身免疫综合征的文献病例分析Δ
2022-10-13王思文宋燕青王相峰
王思文,高 欢,宋燕青,王相峰
(吉林大学第一医院药学部,长春 130021)
胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)是一种以高胰岛素血症和低血糖为主要临床表现的免疫反应性胰岛素自身抗体水平升高的疾病,在临床诊断为血清胰岛素水平降低,C肽和胰岛素原水平极度升高[1]。与IAS相关的低血糖通常发生于餐后3~4 h,可能是由于餐后抗体快速与胰岛素结合,导致激素生物活性降低,使胰岛素分泌延长,形成的复合物在餐后3~5 h解离,导致胰岛素大量释放产生低血糖。IAS于1970年由Hirata等首次在日本杂志“Tohoku Journal of Experimental Medicine”上报道,可能由于该病诊断检查的困难和疾病自身的自限性,IAS在近10年里才逐渐被人们关注,其确切发病率目前仍存在争议[2-4]。氯吡格雷在临床上被广泛用于抗血小板聚集治疗,其主要的不良反应为消化道出血、中性粒细胞减少、腹痛和食欲减退等,由氯吡格雷诱发的IAS较罕见。本研究收集国内外文献报道的氯吡格雷相关IAS病例并进行分析,现报告如下。
1 资料与方法
1.1 资料来源
以“氯吡格雷”和“胰岛素自身免疫综合征”或“IAS”为中文检索词,以“Clopidogrel”和“insulin autoimmune syndrome”或“IAS”为英文检索词,分别检索中国知网、维普数据库、万方数据库、PubMed和Embase等数据库(截至2021年4月),收集氯吡格雷相关IAS的病例报告类文献。文献纳入标准:报告的病例经作者诊断为IAS,首先可疑致病药物为氯吡格雷;临床资料相对完整;文献语种限定为汉语和英语。排除标准:非病例报告类文献;氯吡格雷为非首要可疑致病药物;临床资料不完整。
1.2 方法
由2名研究者按纳入与排除标准独立筛选文献,应用自行设计的Excel表格提取资料并交叉核对,提取的内容包括患者的性别、年龄、发病时血糖水平、联合用药、胰岛素水平、C肽水平、干预措施、人类白细胞抗原(human leukocyte antigen,HLA)基因分型以及IAS的治疗与转归情况。对收集到的资料和数据进行描述性统计分析。
2 结果
2.1 文献检索结果与患者基本情况
共收集到氯吡格雷相关IAS患者6例,来自5篇病例报告类文献[5-9],包括1篇中文文献,4篇英文文献。6例患者中,澳大利亚1例,美国1例,日本2例,我国2例;均为男性患者,年龄63~84岁;3例患者提及原发病,为心肌梗死、冠状动脉疾病、高血压、高尿酸血症、颈动脉斑块和脑腔隙性梗死。6例氯吡格雷相关IAS患者的主要临床资料见表1。
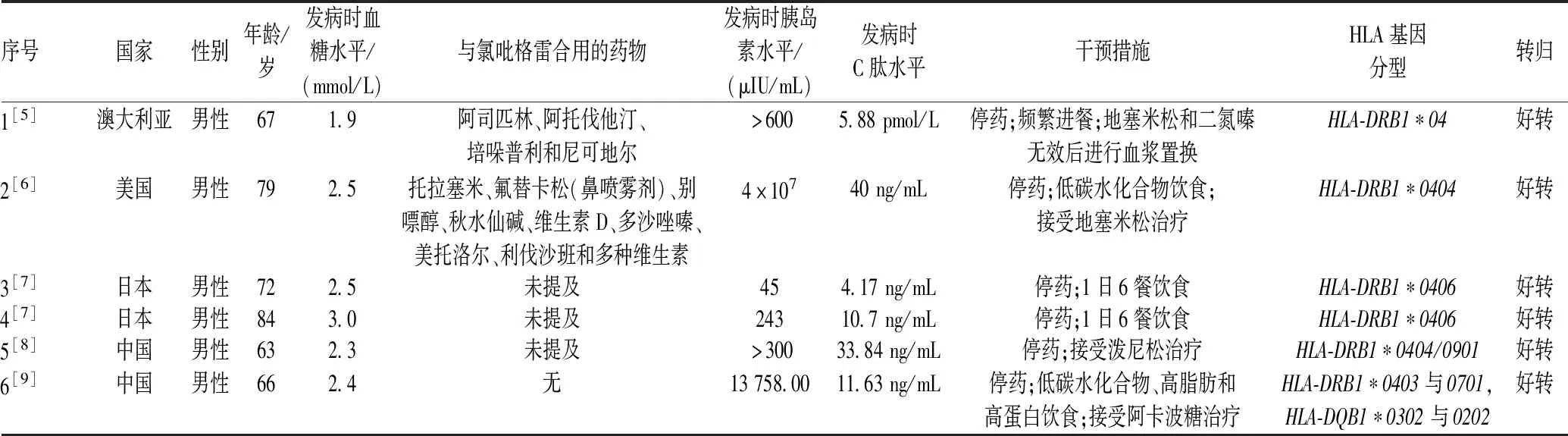
表1 6例氯吡格雷相关IAS患者的主要临床资料Tab 1 Clinical data of 6 patients with clopidogrel-related insulin autoimmune syndrome
2.2 患者用药情况
6例患者中,有2例患者提及联合用药情况,其中1例患者合用药物为4种,包括阿司匹林、阿托伐他汀、培哚普利和尼可地尔[5];另外1例患者合用药物为9种,包括托拉塞米、氟替卡松(鼻喷雾剂)、别嘌醇、秋水仙碱、维生素D、多沙唑嗪、美托洛尔、利伐沙班和多种维生素[6]。
2.3 IAS的临床表现及辅助检查结果
6例患者均无糖尿病病史,在服用氯吡格雷2~3周后表现出低血糖症状;其中4例患者提及具体症状,主要表现为进行性意识混乱1例,头晕2例,虚脱1例,晃动1例,出汗2例,晕厥1例,心悸1例。6例患者均记录了发病时血糖、血清胰岛素和C肽水平,见表1。4例记录糖化血红蛋白水平(HbA1c)的患者中,3例患者HbA1c水平在正常值范围(正常值范围为0~6%);1例患者HbA1c水平略高于正常值(为6.9%)[8]。4例记录胰岛素自身抗体水平的患者中,2例患者胰岛素自身抗体水平均>5 000 nU/mL[7];1例患者胰岛素自身抗体水平>50 IU/mL(正常值参考范围为0.00~0.40 IU/ml)[8];1例患者胰岛素自身抗体为“+”(2.41,正常值参考范围<1)[9]。6例患者的HLA基因分型分别为HLA-DRB1*04单倍型[5]、HLA-DRB1*0404[6]、HLA-DRB1*0406[7]、HLA-DRB1*0406[7]、HLA-DRB1*0404/0901[8]、HLA-DRB1*0403与0701[9]以及HLA-DQB1*0302与0202[9]。
2.4 治疗与转归
6例患者在诊断为IAS后均停用氯吡格雷,并在接受相关治疗后均好转。2例患者调整饮食结构为1日6餐,4例患者在对饮食进行调整的同时接受相关治疗[7]。4例接受治疗的患者中,2例患者接受糖皮质激素治疗(1例患者接受地塞米松治疗7 d内好转,1例患者接受泼尼松治疗)[7,9];1例患者接受阿卡波糖治疗[5];1例患者在接受地塞米松和二氮嗪治疗无效后,进行血浆置换,13 d内经历了7个血浆置换期,血糖水平恢复正常[8]。6例患者停药或接受相关治疗后,分别在6个月内(2例)、5个月内(2例)、7个月内(1例)和10个月内(1例)进行随访或复查,均没有出现任何低血糖事件。
3 讨论
IAS发病的原因之一是由于血清中天然胰岛素自身抗体水平升高,胰岛素自身抗体分为单克隆抗体和多克隆抗体,目前大多数IAS病例的胰岛素自身抗体为多克隆抗体,而没有预先暴露于胰岛素或胰岛的病理异常[10]。从20世纪90年代初开始,研究者对IAS的遗传背景进行了广泛研究,在HLA系统的基因中发现了IAS的免疫遗传决定因素[11]。研究结果显示,IAS与HLA-DR4密切相关(主要与HLA-DRB1*0406有关,有时与HLA-DRB1*0403和HLA-DRB1*0407有关),表明HLA分子中第74位的谷氨酰胺被认为是IAS中多克隆胰岛素自身抗体产生的必要条件,而第37位的丝氨酸(HLA-DRB1*0406所独有)极大地增加了该病的易感性,HLA-DRB1*0406的基因产物是人类胰岛素表达的主要限制因素[3,12-13]。大多数IAS病例出现在日本和其他东亚国家,可能是由于HLA-DRB1*0406等位基因较高频率地出现在该类人群中,而欧美人群中HLA-DRB1*0406等位基因较为罕见[14]。Uchigata等[12,15]的研究结果表明,当自身抗原暴露于人类胰岛素时,IAS患者具有的HLA Ⅱ类等位基因HLA-DRB1*0406、HLA-DQA1*0301和HLA-DQB1*0302会导致T-细胞增殖。但无论HLA-DR4等位基因是否存在差异,均存在HLA-DQA1*0301/DQB1*0302[15]。近年来有学者报道,HLA-DRB1*0415、HLA-DRB1*0404等基因也可能是IAS的易感基因[8,16]。在我国人群中,HLA-DR4的患病率尚未可知。本研究中,氯吡格雷相关IAS患者的HAL基因分型包括HLA-DRB1*04、HLA-DRB1*0404、HLA-DRB1*0406、HLA-DRB1*0404/0901、HLA-DRB1*0403与0701和HLA-DQB1*0302与0202,与上述报道一致。
本研究中,6例患者均为携带HLA-DRB1*04基因的无糖尿病的老年男性。有研究结果显示,约47%的IAS患者接触过含巯基的药物,如卡托普利、青霉胺、吡啶醇、卡比唑、亚胺培南、丙硫氧嘧啶、肼、普鲁卡因胺、异烟肼和青霉素等[10,17]。巯基能够结合并减少链接胰岛素链A和B的巯基键,使内源性胰岛素更具有免疫原性,虽然氯吡格雷的分子中不含有巯基,但其经细胞色素P450酶系激活后的活性代谢物与胰岛素分子中的二硫键结合,使胰岛素分子产生免疫原性,从而导致低血糖发生[6]。目前越来越多的研究结果表明,药物的代谢物也是导致IAS的原因之一。有研究结果表明,白蛋白分子中的半胱氨酸残基(Cys34)具有很强的还原能力,可导致IAS发生[18]。此外,IAS患者发生低血糖的其他机制包括:(1)胰岛素自身抗体使胰岛素-胰岛素受体复合物交联,从而增强和延长胰岛素的作用;(2)胰岛素抗体的产生,导致胰岛素受体的直接激活;(3)胰岛素抗体与抗胰岛素抗体结合[5]。
药物诱导的IAS通常在3~6个月内缓解,80%非药物诱导的病例在3个月后自行缓解[6]。尽管相关文献报道,停用含有巯基的药物,大多数患者少量多次地摄入碳水化合物以降低餐后高血糖和增加胰岛素分泌,IAS的症状可自行改善,但目前对于IAS没有标准化的治疗方案,不同研究者根据病情的严重程度和自然病史选用不同的治疗方案[5-9,18]。本研究中,6例氯吡格雷相关IAS患者的干预措施包括调整饮食结构、少食多餐、减少碳水化合物的摄入、高蛋白饮食,使用糖皮质激素、二氮嗪和阿卡波糖等药物;其中1例患者使用药物治疗无效后,进行血浆置换。
综上,即使没有使用已知可导致IAS的药物,若健康个体出现内源性高胰岛素血症性低血糖时,血清胰岛素水平过高而游离胰岛素水平相对较低时,应怀疑是IAS引起的[15]。氯吡格雷相关IAS多在用药2~3周后出现头晕、虚脱、出汗、心悸和昏厥等典型低血糖症状,但较容易被忽视是由氯吡格雷引起的,在停药或进行相关治疗后恢复正常。对于服用氯吡格雷的人群,应注意防范IAS的发生,保障患者用药安全。
