医疗机构药品遴选中药品临床必需性考察项下罕见病用药判别的方法Δ
2022-10-13吴佳瑶仲威龙李正翔
禹 洁,段 蓉,吴佳瑶,仲威龙,李正翔#
(1.天津医科大学总医院药剂科,天津 300052;2.天津医科大学总医院消化内科,天津 300052)
药品遴选是医疗机构药事管理工作的重要内容。为实现药品遴选工作标准化、规范化,天津医科大学总医院自2019年4月发起《医疗机构药品遴选指南》(以下简称《指南》)的制定工作[1]。该《指南》从药品临床必需性、有效性和安全性等10个维度对药品进行综合评价[2]。临床必需性是该《指南》的首个一级指标,鉴于各医疗机构诊疗病种及需求的差异,该指标又分为4个二级指标,主要包括“是否符合疾病的流行病学特点”“药物临床使用率及使用情况”“罕见病用药”及“特殊人群用药”。前两个二级指标可作为多数常见疾病用药的“临床必需性”的衡量标准。然而,罕见病是一类发病率低、患病人口少、误诊率高、可严重威胁生命健康的疾病的总称[3-4]。罕见病用药通常指用于治疗、诊断、预防罕见疾病或罕见状态的药物、疫苗、诊断试剂等[5]。由于低发病率的特点,罕见病用药并不适宜使用以上两个指标来评价其临床必需性。因此,该《指南》将“罕见病用药”单独作为“临床必需性”项下的二级指标之一[6]。即只要是罕见病用药,则临床必需性考察项目为满分,不再做药物流行病学及使用率的考察。为罕见病用药的临床必需性考察单独开辟了评价方法。由于临床对罕见病的认知度水平偏低[7],且我国未开展罕见病用药资格认定相关工作,也并未建立专项的罕见病用药目录。因此,医疗机构在药品遴选中,无可直接对标的文件来明确待遴选药品是否属于罕见病用药。鉴于我国罕见病用药判别研究的空白及医疗机构药品遴选工作的实际需求,本文通过检索相关法律法规、政策和文献,开展了文献分析研究,旨在为形成医疗机构药品遴选中罕见病用药判别的方法,为《指南》中药品临床必需性的评价提供方法。
1 资料与方法
1.1 文献检索
以“罕见病用药”“罕见病”和“孤儿药”为中文关键词,“rare diseases”和“orphan drug”为英文关键词,检索发布在国家行政部门相关网站(见表1)中的政策法规及解读文件,同时检索PubMed、万方数据库、中国知网和维普数据库中的相关文献,并补充检索百度和Google等网站中的相关信息,提取可用于罕见病用药判别的资料,形成医疗机构药品遴选中评价药品临床必需性的罕见病用药判别的方法。检索时限均为各数据库或网站自建立/建库至2021年2月。

表1 检索所涉及的国家行政部门Tab 1 National administrative departments involved in the search
1.2 纳入与排除标准
1.2.1 纳入标准:能够获取全文并与本研究内容相关的我国政策性文件和研究性文献。
1.2.2 排除标准:(1)与罕见病用药判别主题无关的文献以及重复发表的文献;(2)会议论文;(3)罕见病单病种研究性文献;(4)政府网站与研究主题相关的新闻、重复信息及废止的文件;(5)不适用于我国现行政策的国外罕见病文献。
1.3 文献筛选与资料提取
由2名研究者根据纳入与排除标准,独立筛选文献;若遇分歧,通过相互讨论或咨询第三方达成一致。设计统一的资料提取表,资料提取表的内容主要包括:政策性文件的文件名称、发布机构、发布时间、引用内容等,研究性文献的出处和内容等。
1.4 统计方法与分析
采用EndNote X7软件对文献进行管理,采用Excel 2016软件对纳入文献进行统计分析。采用描述性分析方法,分析用于形成“医疗机构药品遴选中罕见病用药判别方法”的文献资料。
2 结果
2.1 文献/文件检索与筛选结果
通过检索5个国家行政部门网站和4个数据库,共检索到文献/文件1 476篇,经筛选最终纳入文献/文件7篇,包括政策文件6篇和研究性文献1篇。文献/文件筛选流程见图1。形成医疗机构药品遴选中罕见病用药判别方法纳入的文献/文件汇总见表2。

表2 形成医疗机构药品遴选中罕见病用药判别方法纳入的文献/文件Tab 2 Documents/Literature related to constructing the method of recognizing rare diseases drugs in drug selection in medical institutions
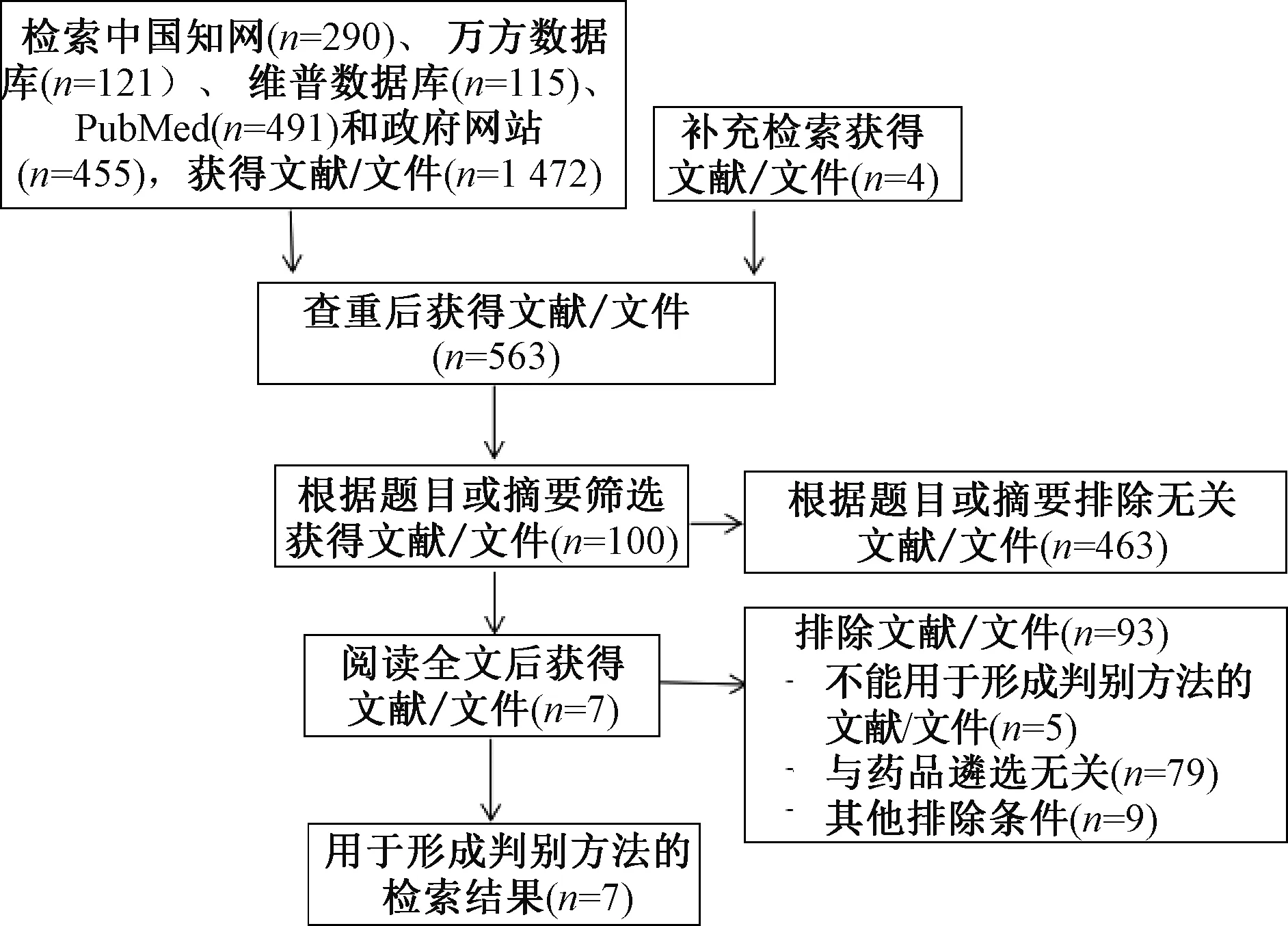
图1 文献/文件筛选流程与结果Fig 1 Literature/document screening process and results
2.2 医疗机构药品遴选中罕见病用药判别方法的形成
本研究在系统检索获得的我国国家政策文件及文献的基础上,经过综合汇总及分析,提取可用于罕见病用药判别的资料,形成医疗机构药品遴选中罕见病用药判别的方法,见表3。

表3 医疗机构药品遴选中罕见病用药判别方法的主要内容Tab 3 Main contents of the method to recognize rare diseases drugs in drug selection in medical institutions
医疗机构药品遴选中,待遴选药品满足上述判别方法中4个主要内容的数量N≥1,则可判断该药品为罕见病用药,其临床必需性考察项下给予相应满分值,且无需进行“是否符合疾病流行病学特点”及“药物临床使用率”的药品临床必需性的评价。同时,结合该《指南》中药品有效性、安全性和经济性等共10个维度的指标评价结果,对待遴选药品做出综合评价。
3 讨论
3.1 我国罕见病及罕见病用药管理现状
目前,世界各国对于罕见病的界定并不相同,不同国家通常根据本国国情,依据流行病学标准、疾病严重程度和罕用药经济学标准来界定罕见病[15]。世界卫生组织将罕见病定义为患病人数占总人口0.65‰~1‰的疾病[16]。2010年,中华医学会从患病率方面给出了我国罕见病的定义,但由于其标准较高等原因,并未得到广泛使用。2018年5月,由国家卫生健康委员会联合五部门公布的《第一批罕见病目录》[8],并未参照2010年的定义[17]。目前,我国无基于流行病学的罕见病的官方定义,而是通过发布罕见病目录的形式来界定我国罕见病的管理范畴。为提高罕见病诊疗水平,维护罕见病患者健康权益,我国建立了全国罕见病诊疗协作网,并指出协作网医院要及时将罕见病用药纳入医院处方集和基本用药供应目录。然而,鉴于我国罕见病用药管理现状,准确辨别罕见病用药是医院药学有挑战性的工作。
3.2 基于药品说明书的罕见病用药的界定
药品说明书是具有法律效力的文书。对于罕见病,因其发病率及知晓率低的特点,药学人员可能并不能直接明确药品说明书的适应证疾病是否为罕见病。2018年,国家发布了《第一批罕见病目录》[8],包含121种罕见病,为目前我国认定的罕见病病种;同年,国家卫生健康委员会发布了《罕见病目录制订工作程序》[9],提出将分批遴选目录覆盖病种,对目录进行动态更新。基于上述文件,本研究在形成医疗机构罕见病用药判别方法时,以目前公布的《第一批罕见病目录》为基础,增加了“后续公布的目录”作为补充,以弥补目录公布时效性的不足,使基于药品说明书的罕见病用药的判别清晰化及具有可操作性。
3.3 基于有“罕见病”标签药品的罕见病用药的判别
为保证罕见病用药的可及性,很多国家和地区制定了专门的法律法规,以促进罕见病用药的开发。我国也为罕见病用药的研发审批开辟了绿色通道[18-19]。基于政策利好,大量罕见病用药上市,但国内外上市销售的罕见病用药品种仍然存在巨大差异[20]。通过利用国际资源,可在尽量短的时间内满足我国罕见病患者的诊疗需求。2018年,我国发布了《关于临床急需境外新药审评审批相关事宜的公告》,对罕见病药品等临床急需境外新药建立专门通道进行审评审批,并先后发布了三批《临床急需境外新药名单》[10-12],其中“列为临床急需原因”中用于治疗罕见病的药品有41个。将涉及罕见病用药的上述3批名单也纳入本研究,可为上述药品陆续在我国上市后,医疗机构药品遴选中罕见病用药必需性考察提供依据。
3.4 基于《罕见病诊疗指南(2019年版)》的罕见病用药的判别
由于药企发展规划或罕见病用药独占期保护等因素,并非具有同类药理作用的药品都可获批罕见病适应证。mTOR抑制剂依维莫司是国内唯一获批治疗TSC的靶向治疗药物。同为mTOR抑制剂的西罗莫司的药品说明书中无TSC适应证,但其对TSC的疗效已被证实。在《罕见病诊疗指南(2019年版)》[13]中,西罗莫司与依维莫司一同被推荐用于TSC的治疗。因此,“无罕见病适应证,但在我国《罕见病诊疗指南(2019年版)》中推荐的罕见病治疗药品”也作为本研究罕见病用药判别的方法之一,用来弥补药品说明书界定范围的不足。需要强调的是,本部分内容主要针对与已有罕见病适应证药品作用机制相同,在本医疗机构临床使用率低,但确又为罕见病诊疗需要的,《罕见病诊疗指南(2019年版)》推荐的药品。罕见病诊疗中的常规对症治疗药物不在研究范围。
3.5 基于用于治疗新的国际罕见病的国内具可及性的药品的罕见病用药的判别
随着人类对疾病研究的深入和诊疗技术的发展,新的罕见病会被逐渐发现。我国以公布罕见病目录界定罕见病的形式在时效性及对新罕见病种覆盖性方面具有一定的局限性。Orphanet网站是专用于罕见病的国际数据资源,是目前有关罕见病的信息和数据最全面的库[14]。对于国外新研发上市,而国内未上市销售的罕见病用药,因国内无法获得,暂不在本研究考察范围。鉴于“老药新用”本就是新药研发的重要方法的思路,本研究将治疗我国罕见病目录未纳入但Orphanet网站已纳入的罕见病的,且国内可获得的老药,也纳入本研究罕见病用药判别方法之一。本部分内容为前三个判别方法的探索性补充,主要立足点在尽可能满足罕见病患者的诊疗需求。本部分所指的“老药”,为各种原因导致的临床使用率低,但可用于治疗相关新发现罕见病的药品。本文参考文献[14]已明确给出Orphanet网站链接及如何使用Orphanet数据库的文献,提供了具体操作方法。
综上所述,本研究为《医疗机构药品遴选指南》中的一部分。医疗机构药品遴选过程中,需要严格执行我国相关医药法规及政策。因此,本研究纳入文献时以我国政策文件为主,国外参考文献虽然有开拓思路的作用,但因国情差异不适用于作为本研究罕见病用药判别方法的形成。本研究为医疗机构药品遴选中罕见病用药的临床必需性评价开辟了新的思路,对罕见病用药可被及时、规范地遴选入医疗机构有重要意义。但也存在一定的局限性。随着我国罕见病流行病学数据的完善及各项罕见病政策的推进,期待国家给出具体详实的罕见病用药界定标准或目录,为医疗机构保证罕见病用药可及性的最后环节提供官方的参考。
