口腔扁平苔藓合并2型糖尿病的临床及病理特征研究
2022-10-13李凯一何汶秀任晓萌罗海燕李春蕾
李凯一,何汶秀,任晓萌,罗海燕,李春蕾,华 红
口腔扁平苔藓(oral lichen planus, OLP)是一种慢性炎症性皮肤黏膜疾病,患病率为0.1%~4.0%,2005年世界卫生组织(World Health Organization,WHO)将其归类为口腔潜在恶性疾患(oral potentially malignant disorders,OPMD)[1]。约2/3的OLP患者会表现出不适或疼痛症状,严重影响患者的生活质量。OLP的病因及发病机制目前尚不清楚,可能与遗传因素、免疫失衡、感染因素、精神心理因素,或系统性疾病(如糖尿病、高血压)等密切相关[2]。糖尿病(diabetes mellitus,DM)是一种由于胰岛素分泌缺陷、胰岛素作用障碍或两者兼而有导致血糖浓度升高为特征的慢性代谢疾病[3]。近年来,我国2型糖尿病(type 2 diabetes mellitus,T2DM)患病率急剧上升,2020年最新研究显示我国DM患者总数约为1.298亿,约占世界DM患者的1/3,其中成人DM患病率12.8%,对中国人的生命健康及国民经济造成重大影响[4]。DM 患者口腔问题突出,与非糖尿病人群相比,DM患者的牙周炎、龋病及一些口腔黏膜病(如口腔念珠菌病、口腔扁平苔藓、沟纹舌等)患病率更高[5-9]。2020年有关OLP与DM的Meta分析结果显示二者存在相关关系(OR=1.87,95%CI:1.57~2.34)[8]。此外,有研究发现OLP合并DM患者发生癌变的概率更大(OR=1.87,P<0.001)[10]。目前,国内外有关OLP合并DM的研究多集中在临床流行病学方面,而OLP合并DM的临床及病理特征研究鲜有报道。因此,本研究旨在分析OLP合并T2DM患者临床及病理特征,以期为OLP合并T2DM患者提供个性化诊治方案,提升该类患者临床诊疗的效果及预后。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年12月于北京大学口腔医院口腔黏膜科经过临床检查及病理活检的OLP患者共104例。分为OLP组与OLP+T2DM组,每组各52例且性别及年龄相匹配。
1.1.1 诊断标准 OLP的诊断基于2022年《口腔扁平苔藓诊疗指南》的诊断流程与WHO 2003 年口腔扁平苔藓诊断标准[11-12];T2DM的诊断基于2020年《中国2型糖尿病防治指南》中的诊断标准[4],由内分泌科医师根据以上标准做出。
1.1.2 纳入标准 年龄≥18岁;临床及病理诊断为OLP;签署知情同意书的受试者。该研究经过北京大学口腔医院伦理委员会批准(批件号:PKUSSIRB-202162036)。
1.1.3 排除标准 患有其他已确定的口腔黏膜疾病或具有免疫系统疾病病史的患者;全身有其他代谢性疾病如高血压、高血脂、糖尿病并发症等及恶性肿瘤等病史;重度牙周炎患者(牙周袋>6 mm,附着丧失≥5 mm,牙槽骨吸收超过根长1/2)。
1.2 研究方法与检查指标
本研究为病例对照研究,研究设计遵循STROBE规范。主要研究OLP合并T2DM患者的临床及组织病理学表现特征。调查了所有受试者的年龄、性别、吸烟、饮酒、OLP病程、OLP的临床类型(糜烂型、非糜烂型)等基本信息以及空腹血糖(FPG)和糖化血红蛋白(HbA1c)等实验室资料。
1.2.1 REU评分系统[13]在该评分系统中,对口腔各部位病变的严重程度进行以下评分:存在网纹病变(无=0,存在=1),糜烂/红斑(无=0,<1 cm2=1,1~3 cm2=2,>3 cm2=3)。加权总评分为网状评分、红斑评分(×1.5)和溃疡评分(×2.0)的总和。两位临床医师在不知研究设计的情况下对OLP病损面积进行REU评分,进行了一致性检验,Kappa值为0.78,具有高度一致性。
1.2.2 社区牙周指数(community periodontal index,CPI)[14]使用WHO推荐的CPI牙周探针检查指数牙的牙龈出血、牙石和牙周袋深度。将口腔分为6个区段。每个区段两颗功能牙检查结果,以最重情况记分。以6个区段中最高的记分作为个人CPI值。
1.2.3 病理检查 病理表现按照以下分类[15]。①淋巴细胞浸润带是否清晰,淋巴细胞浸润密集度,轻度:固有层淋巴细胞浸润带的淋巴细胞密集程度较轻;重度:固有层淋巴细胞浸润带密集。②基底细胞液化变性,上皮基底层是否存在纤维蛋白、胶样小体;基底层破坏程度,轻度:基底细胞较清楚,有空泡变,基底膜尚可分辨;重度:基底细胞明显液化变性,基底细胞和基底膜分辨不清,上皮与结缔组织裂开。请2位病理科专家在不知研究分组的情况下进行组织病理学的描述,一致性检验Kappa值为0.72,具有高度一致性。
1.2.4 随访资料分析 对OLP+T2DM组患者随访资料进行分析,根据是否服用降糖药物分为用药组与未用药组,比较这两组患者口腔局部治疗(碳酸氢钠含漱液+曲安奈德口腔膏或他克莫司软膏)1个月后的REU评分。此外,根据FPG将OLP+T2DM患者分为血糖控制理想组(FPG<6.1 mmol/L)与血糖控制欠佳组(FPG≥7.0 mmol/L)[4],分别比较这两组患者局部治疗1个月后的REU评分。
1.3 统计学方法
采用SPSS 24.0统计学软件进行数据处理分析。采用t检验,Mann-WhitneyU检验,χ2检验及多因素二元Logistic回归分析筛选出OLP合并T2DM的临床及病理表现特征。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
本研究根据诊断标准及纳排标准共纳入104例受试者,其中OLP组52例,OLP+T2DM组52例。两组在年龄、性别、病程、吸烟、饮酒、病程方面均无显著统计学差异(P>0.05)。两组之间在CPI=2和CPI=3的水平上存在差异(P<0.05)。在临床类型方面,OLP+T2DM组出现糜烂型病损发生率(P<0.001)与REU评分(P<0.001)显著高于OLP组(表1)。
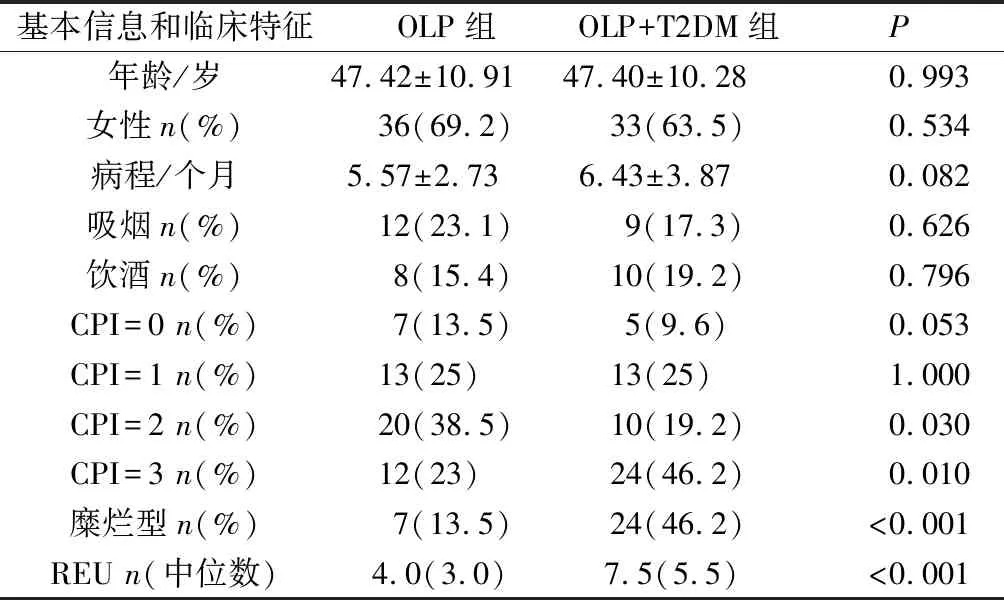
表1 OLP组和OLP+T2DM组研究人群的临床特征Tab.1 Clinical characteristics of OLP group and OLP+T2DM group
2.2 OLP及OLP+T2DM组病理表现特征分析
本部分从OLP淋巴细胞浸润及基底细胞液化变性(图1)两个方面对104例OLP患者的组织病理表现进行了研究。单因素分析结果显示,与OLP组相比,OLP+T2DM组患者淋巴细胞浸润密集(P=0.02),淋巴细胞浸润带不清晰(P=0.01)基底细胞液化变性破坏更严重(P=0.01),并且基底层含有纤维蛋白的情况发生率更高(P=0.01)。见表2。

A:固有层淋巴细胞浸润带的淋巴细胞密集程度较轻;基底细胞较清楚,有空泡变,基底膜尚可分辨;B:固有层淋巴细胞浸润带密集;基底细胞明显液化变性,基底细胞和基底膜分辨不清,上皮与结缔组织裂开
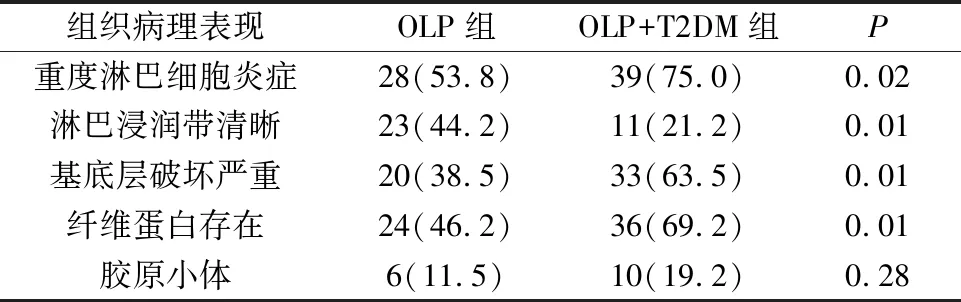
表2 OLP组及OLP+T2DM组的病理表现特征分析Tab.2 Histopathological features of OLP group and OLP+T2DM group n(%)
2.3 OLP合并T2DM临床与组织病理特征的Logistic回归分析
将REU评分、OLP类型、淋巴细胞密集程度、淋巴浸润带清晰度、基底层破坏程度、基底层是否存在纤维蛋白纳入Logistic回归分析,CPI作为混杂因素也纳入。结果显示糜烂型发生率高(OR=37.15,95%CI:5.21~64.97),REU评分更高(OR=1.58,95%CI:1.17~2.13)、淋巴细胞浸润密集(OR=8.49,95%CI:1.90~37.92)、淋巴细胞浸润带不清晰(OR=10.16,95%CI:2.03~50.74)、基底层破坏严重(OR=3.94,95%CI:1.10~14.07)、基底层存在纤维蛋白(OR=4.35,95%CI:1.16~16.24)是OLP+T2DM更易出现的临床与组织病理学特征(表3)。

表3 两组临床及组织病理特征的Logistic分析Tab.3 Logistic analysis of clinical and histopathological features of the two groups
2.4 糖尿病治疗前后的OLP病损变化
调查52例OLP+T2DM患者后续随访治疗情况,对其中23例仅局部治疗(碳酸氢钠含漱液+曲安奈德口腔膏或他克莫司软膏)患者1个月的随访资料进行分析,结果显示:其中14例服用降糖药物患者的REU评分的秩平均值从20.07降到8.93,OLP口内病损显著好转(P<0.001),9例未用任何降糖药物患者的REU评分的秩平均值从11.06降到了7.94,无统计学差异。又分析了以上23例OLP患者的血糖控制情况与OLP临床转归的关系,其中有13例血糖控制理想的OLP患者(FPG<6.1 mmol/L)治疗前后的REU评分的秩平均值从18.63降到了8.38,OLP的临床病损明显好转(P<0.001),7例血糖控制欠佳患者(FPG≥7.0 mmol/L)REU评分的秩平均值从9.43降到了5.57,不具有统计学意义(表4)。
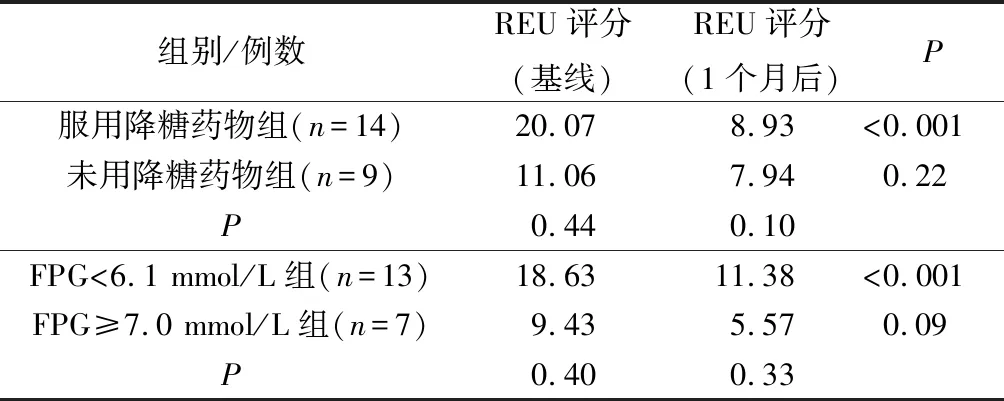
表4 随访1个月后各组的REU评分比较(秩平均值)Tab.4 Comparison of REU scores in each group after one month follow-up
3 讨 论
OLP是一种常见的口腔黏膜病,全球发病率约为1.01%,具有一定的癌变风险,最新的统计其恶变率为0.8%~1.5%[16]。2020年的一篇Meta分析显示OLP与DM存在一定的相关性(OR:1.87,95%CI:1.57~2.34),证实了DM为OLP危险因素之一[8]。DM是全球增长最快的慢性病之一,估计到2030年全球增长到5.78亿人口。我国DM患病率目前居世界第一,约占世界DM患者的1/3[4]。DM对牙体、牙周组织以及口腔黏膜等均可造成严重影响[17]。目前,多个循证医学研究证实DM是OLP的危险因素之一[8,18],而有关OLP合并DM的临床及组织病理特征研究鲜有报道。开展此方面的研究有助于对此类患者实施个性化的诊疗方案,规范其临床诊治流程,改善其临床预后。
本研究发现与OLP患者相比,合并T2DM的OLP患者更易表现为糜烂型且REU评分更高。此外,通过对OLP+T2DM患者局部治疗1个月后随访资料分析发现:服用降糖药物(P<0.001)和血糖控制理想(P<0.01)的OLP患者REU评分均显著降低,而未服用降糖药物和血糖控制欠佳的OLP患者REU评分变化不明显。这与2019年国内学者病例报道结果相似[19]。表明伴有T2DM的OLP患者需要进行更为规范积极的控制血糖治疗,控制血糖良好可以减低机体免疫炎症反应,进而有助于OLP病损的愈合。
在组织病理学方面,本研究结果表明OLP+T2DM组其固有层淋巴细胞浸润密集,淋巴细胞浸润带清晰度下降,基底层破坏更严重,并且上皮基底层存在纤维蛋白的情况更高。表明糖尿病可以影响OLP的组织病理表现并且在一定程度上加重了OLP的炎症程度。T2DM 被广泛视为一种慢性低度炎症性疾病,炎症被认为是T2DM和相关并发症的主要驱动力[20]。因此,推测T2DM状态可加重OLP患者的炎症浸润程度,从而加重OLP的病损程度。
本研究采用病例对照研究,分析了OLP合并T2DM患者的临床及病理表现特征。与OLP患者比较,OLP合并T2DM的患者临床病损更为严重,组织破坏程度更高。并且服用降糖药物和血糖控制理想的OLP患者REU评分均显著降低,而未服用降糖药物和血糖控制欠佳的OLP患者REU评分变化不明显,表明T2DM在一定程度上加重了OLP的炎症。在诊治OLP患者时,尤其是反复不愈的糜烂型OLP患者,应常规筛查空腹血糖及糖化血红蛋白等,应与内分泌科医师积极合作对DM进行规范诊疗及控制。告知患者良好血糖控制对于OLP病损愈合与疾病预后的益处。以期为OLP合并DM患者提供更为个性化及精准的诊疗方案。
