Avagacestat抑制破骨细胞形成及溶骨功能改善骨关节炎骨破坏
2022-10-13何佳嘉周薇娜江宏兵
何佳嘉,张 平,周薇娜,江宏兵
骨关节炎(osteoarthritis, OA)是一种常见的影响整个关节肌肉骨骼结构的退行性疾病,其特点是关节软骨和软骨下骨均发生进行性破坏[1-2]。关节软骨的完整性依赖于软骨下骨,在OA相关的骨代谢改变中,破骨细胞活性增加被认为是OA发展过程中软骨变性的早期促发因素[3]。在骨关节炎的早期阶段,破骨细胞活性升高致使软骨下骨密度显著减低、骨与软骨连接处结构的完整性丧失,并促进软骨变性发生[4-6]。
破骨细胞作为一种独特的、高度特化的多核巨细胞,具有显著的降解矿化骨和软骨基质的能力,通过分泌酸和蛋白酶降解骨基质,如抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase, TRAP)和组织蛋白酶K参与破骨活动[7-8],多种信号通路参与了此过程的调节,其中NOTCH相关信号通路,作为细胞分化成熟相关的信号通路,通过与肿瘤坏死因子α转换酶(tumor necrosis factor α-covertinng enzyme,TACE)、γ-分泌酶相互反应,调节κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL),进而参与破骨细胞分化成熟及骨破坏的过程[9-12]。
Avagacestat是一种γ-分泌酶选择性抑制剂,既往研究报道提示其具有调节NOTCH信号通路的作用[13],但其是否可以抑制破骨细胞形成及骨溶解进而对骨关节炎有潜在治疗价值未见报道。本研究中,我们通过体外细胞实验及体内脂多糖(lipopolysaccharide, LPS)诱导OA模型,证实Avagacestat抑制破骨细胞形成并可进一步减少溶骨活动。
1 材料与方法
1.1 实验动物和试剂
25只雄性6周龄C57 SPF级小鼠,α-MEM完全培养基,胎牛血清(fetal bovine serum,FBS)(Gibco,美国),胰蛋白酶(Sigma,美国),青/链霉素,Trizol(Invitrogen,美国),反转录试剂盒(Takara,日本),巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF),TRAP染色液(Merck,德国),Avagacestat(Selleck,BMS-708163,美国),骨板(Osteo Assay Surface plates, Corning,美国),SYBR RT-PCR试剂盒(Takara Bio,美国),Revert Aid cDNA合成试剂盒(Thermo Fisher Scientific,美国)。
1.2 方法
1.2.1 骨髓巨噬细胞(bone marrow macrophages,BMMs)获取和培养 从6周龄C57雄性小鼠股骨和胫骨中分离BMMs,小鼠脱颈处死后,75%乙醇溶液浸泡5 min;剥离股骨与胫骨外软组织,眼科剪剪开股骨与胫骨两端,暴露髓腔;使用含10% FBS的α-MEM完全培养基反复冲洗髓腔5次,收集骨髓悬液经过滤、离心、红细胞裂解等步骤后获得骨髓细胞,重悬细胞后,加入M-CSF诱导液至终浓度30 μg/L,隔日换液,至80%以上细胞贴壁,得到原代骨髓巨噬细胞BMMs;取原代BMMs[14],将细胞置于含10% FBS的α-MEM完全培养基中,用100 μg/L RANKL和33.3 μg/L M-CSF刺激细胞分化,进行培养[15]。所有动物实验均按照国际实验动物护理与使用指南进行,并获得南京医科大学医学伦理委员会的批准(实验伦理编号:IACUC-2006014,饲养协议/合同编号:SY-20200145)。
1.2.2 细胞毒性测定 采用CCK8法测定Avagacestat的细胞毒性。将BMMs接种到96孔板中(1×104个/孔),将含有用100 μg/L RANKL和33.3 μg/L M-CSF的诱导液培养基中加入不同浓度的Avagacestat(0、1、2、4、16、32、64、160、320、640、1 280、2 560 nmol/L)。处理后,不同孔板BMMs分别孵育不同时间点(24、48、96 h)。实验结束时,每孔加入100 μL 10% CCK8溶液,37 ℃孵育2 h后Varioskan LUX多功能酶标仪检测460 nm波长下光密度,使用Excel绘制不同药物浓度不同时间的细胞活性曲线图,并得到曲线方程式,取50%细胞活性对应的药物浓度为IC50浓度。
1.2.3 破骨细胞形成实验 取BMMs,扩增后接种在96孔板中(1×104个/孔),使用含100 μg/L RANKL、33.3 μg/L M-CSF和不同浓度(0、120和240 nmol/L)的Avagacestat,每48 h更换1次培养基,持续6 d。对照组观察到破骨细胞后,用4%多聚甲醛固定;在37 ℃条件下,每孔加入TRAP染色液60 μL,染色1 h。TRAP阳性细胞至少有3个细胞核被认为是破骨细胞。拍照后使用Image J软件进行细胞计数,并作统计学分析。
1.2.4 实时荧光定量RT-PCR分析 诱导后的破骨细胞接种于6孔板,加入0、120和240 nmol/L三种浓度的Avagacestat,培养4 d,PBS洗净后使用Trizol提取总RNA,测定总RNA浓度。使用逆转录试剂盒进行cDNA的合成。使用SYBR RT-PCR试剂盒进行实时荧光定量RT-PCR,实验步骤按照说明书进行,以GAPDH内参基因为检测C-fos、Cath-K、TRAP等基因的相对表达量,相关引物见表1。
1.2.5 破骨细胞溶骨功能实验 BMMs接种于6孔板中(2×106个/孔),1 d后,使用含100 μg/L RANKL、33.3 μg/L M-CSF培养至可观测到破骨细胞。将破骨细胞按1×104个/孔接种于Osteo Assay Surface plates骨板中,培养基中加入同前浓度的RANKL和M-CSF及不同实验浓度的Avagacestat(0、120和240 nmol/L),培养4 d。观察拍照,对比分析。
1.2.6 构建LPS诱导骨关节炎小鼠模型行骨吸收实验 本实验所有动物实验均在南京医科大学动物中心动物护理和使用委员会的监督下,按照ARRIVE的指导方针进行的。雄性C57小鼠(6周龄)随机分为3组:假手术组(PBS)、LPS组和LPS+Avagacestat加药组。异氟烷气体麻醉小鼠后,3组小鼠膝关节分别局部注射PBS(10 mg/kg)、LPS(100 μL)、溶有Avagacestat(240 nmol/L)的LPS(100 μL),持续2周。实验期间未见明显不良反应或毒性反应。小鼠的体重没有明显下降亦未见小鼠死亡。异氟烷气体深度麻醉后脱颈法处死小鼠,切除膝关节并用4%多聚甲醛固定48 h。采用高分辨率Micro-CT(μCT-100 SCANCO Medical AG,瑞士)进行微计算机断层扫描。扫描分辨率为10 μm,X射线能量被设定为70 kV、200 μA,固定曝光时间为300 ms,后对包含胫骨平台的整个软骨下骨进行观察分析。
1.2.7 组织切片HE染色及TRAP标记 多聚甲醛固定的小鼠膝关节在10% EDTA中脱钙2周,并包埋在石蜡中。然后,将样本切成特定的切片(厚度4 μm),进行HE和TRAP染色,使用光学显微镜获得图像。
1.3 统计学分析
2 结 果
2.1 Avagacestat抑制破骨细胞生长
CCK8实验表明,BMMs细胞在加入Avagacestat后,细胞的增殖受到了抑制,且随药物浓度增加,细胞增殖受抑制更加显著(图1A),计算得出在24、48、96 h的半抑制浓度(half maximal inhibitory concentration,IC50)分别为493、426、405 nmol/L,证实Avagacestat对BMMs诱导分化为破骨细胞的过程具有抑制作用。为了进一步探究Avagacestat对破骨细胞功能的抑制作用,同时避免因抑制作用过强而影响实验观察,因而选取小于IC50的浓度来设置分组。利用TRAP实验检测0、120、240 nmol/L 3组浓度Avagacestat对破骨细胞形成的影响,随着Avagacestat浓度升高,破骨细胞形成数量减少,Dunnett检验提示差异具有统计学意义(120 nmol/Lvs. 对照组,P<0.01, 240 nmol/Lvs. 对照组,P<0.001,图2B)。
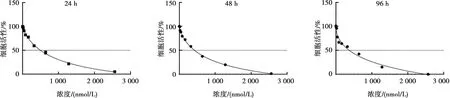
24 h IC50为493 nmol/L,48 h IC50为426 nmol/L,96 h IC50 405 nmol/L
2.2 Avagacestat抑制破骨基因表达及骨吸收功能
检测0、120、240 nmol/L 3组浓度Avagacestat对破骨细胞功能相关基因的影响,单因素方差分析提示3组不同剂量的Avagacestat影响破骨相关基因C-fos、Cath-K、TRAP表达量统计学差异显著,Dunnett分析提示加药组与对照组之间具有统计学差异,进一步,Turkey分析提示240 nmol/L组表达明显低于120 nmol/L组,3种基因得出的P均小于0.05,差异具有统计学意义,提示Avagacestat浓度越高,对破骨细胞基因表达的抑制作用越明显(图3A)。
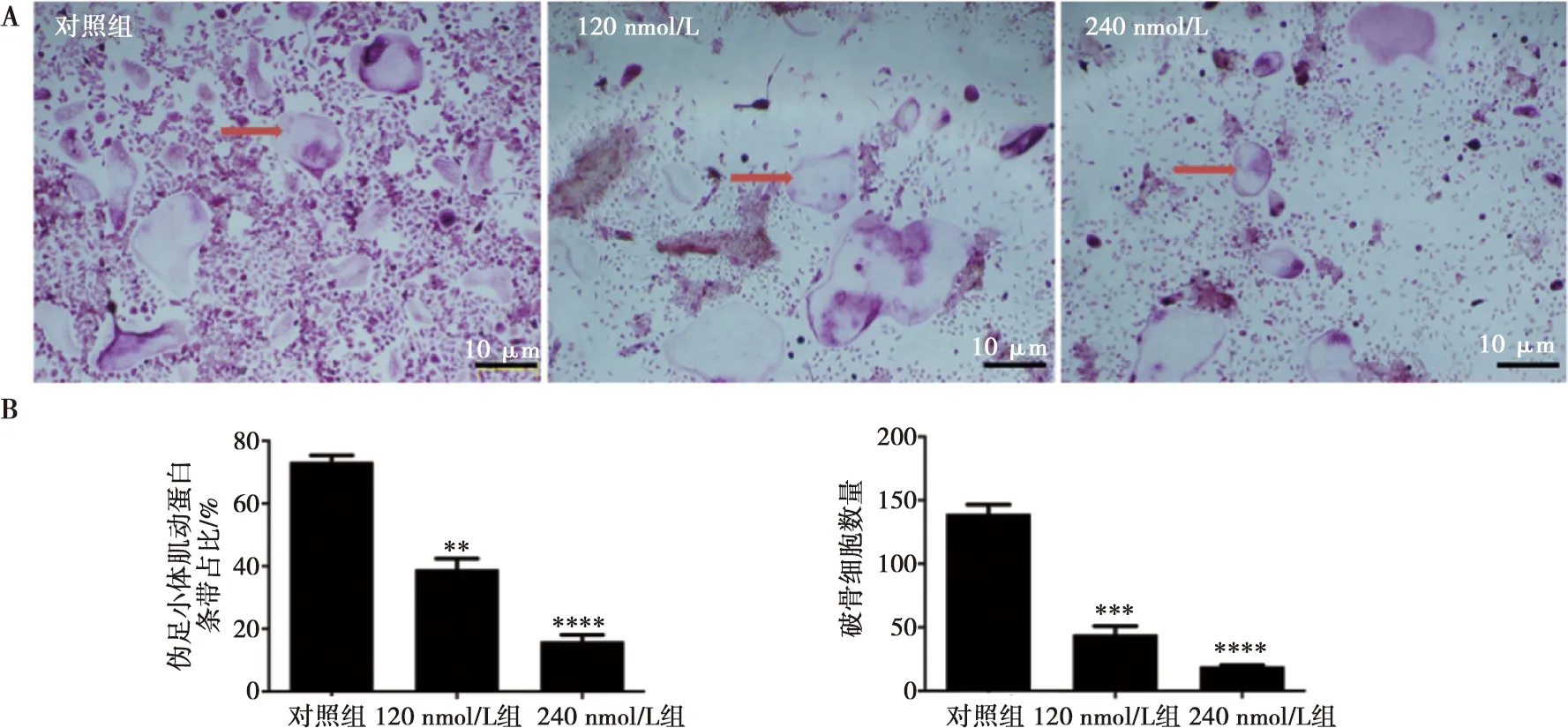
A:TRAP染色检验对照组、120 nmol/L、240 nmol/L 3组Avagacestat对破骨细胞形成的影响,TRAP阳性细胞至少有3个细胞核被认为是破骨细胞,红色箭头指示破骨细胞;B:伪足小体肌动蛋白条带占比及破骨细胞数量的计数统计结果,**为P<0.01,***为P<0.001,****为P<0.000 1
此外,将破骨细胞接种于骨板之上,设置3组浓度的Avagacestat浓度培养基,4 d后观察发现,加药后骨板上骨溶解区域显著减少,且药物浓度越高,溶解破坏越少(图3B)。
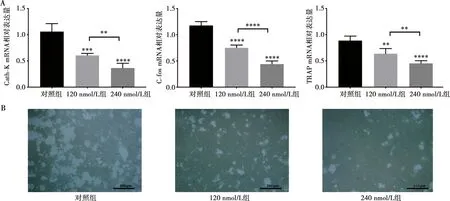
A:横坐标为Avagacestat的浓度,纵坐标为破骨细胞相关基因的mRNA 相对表达量,120 nmol/L、240 nmol/L两组浓度Avagacestat与对照组进行比较,**为P<0.01,***为P<0.001,****为P<0.000 1; B:BMMs接种于骨板,不同浓度的Avagacestat培养4 d后观察溶骨情况
2.3 Avagacestat抑制LPS诱导的小鼠膝关节炎骨吸收
小鼠骨关节腔内注射LPS构建骨关节炎模型,分别注射PBS(假手术组)、注射LPS(LPS组)、注射LPS+Avagacestat(加药组),2周后取小鼠膝关节多聚甲醛固定后行高分辨率Micro-CT扫描,并进行骨重建,检查发现加入LPS的骨关节炎模型中骨质破坏较假手术组严重,而加入Avagacestat的骨质密度较LPS诱导组损害减轻(图3A),对3组图像进行骨分析提示,在加入LPS诱导关节炎后,骨密度(bone mineral density, BMD)、骨组织体积与组织体积比(BV/TV)、骨小梁数量(trabecular number, Tb.n)均出现减低,当同时加入Avagacestat,BMD、BV/TV、Tb.n均显著提高,单因素方差分析提示3组数据有统计学差异,Turkey检验提示加药组比LPS组数值显著升高,差异具有统计学意义(图4B),进而表明Avagacestat可以抑制骨关节炎骨吸收。
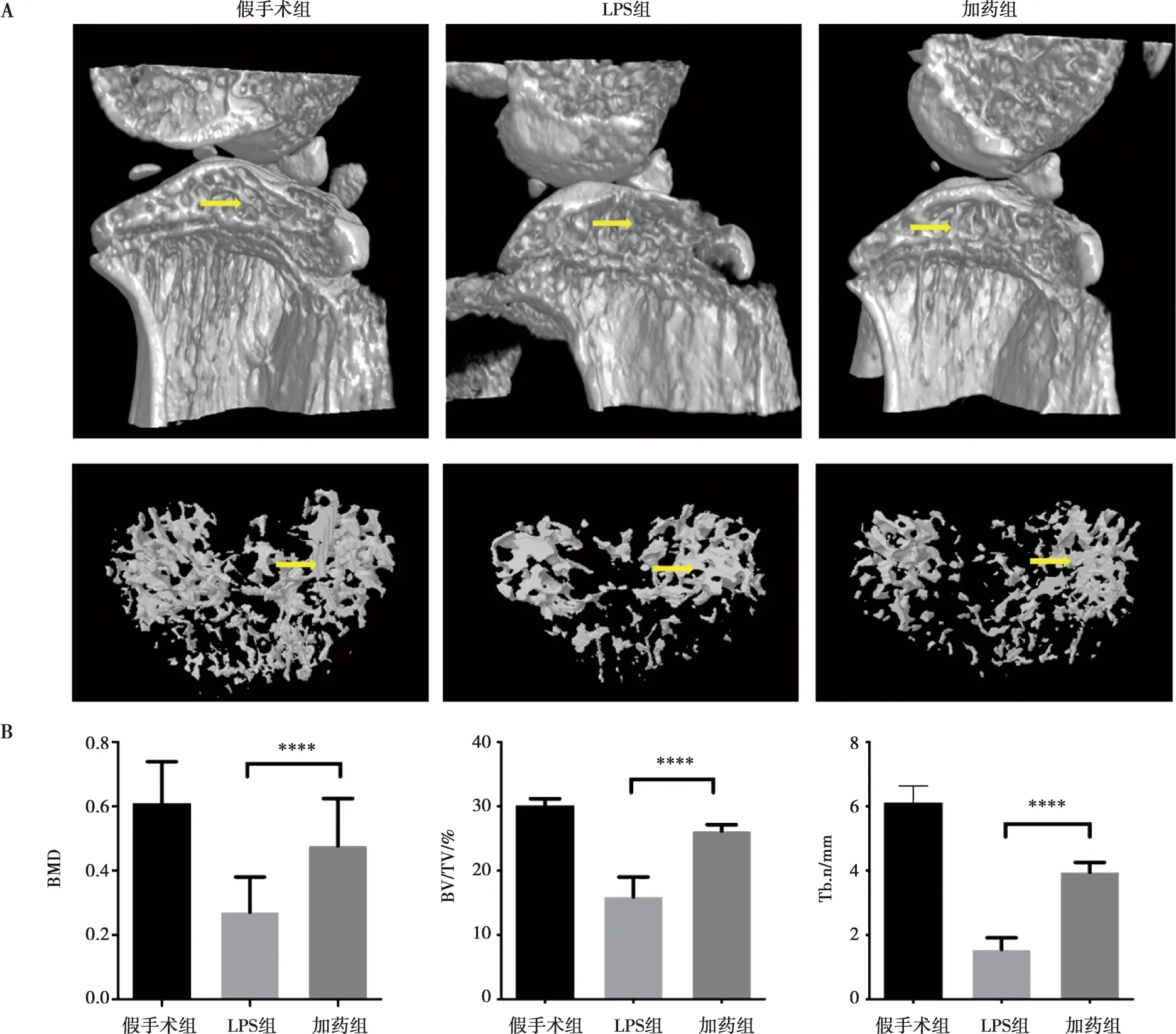
A:膝关节三维骨重建图,下层为骨含量分布图,黄色箭头指示骨质改变较为显著的部位;B:BMD为骨密度、BV/TV为骨组织体积与组织体积比、Tb.n为骨小梁数量,均为体现骨质存留情况的指标,****为P<0.000 1
2.4 Avagacestat抑制骨关节炎模型中破骨细胞生成
取以上骨关节炎模型中3组小鼠的膝关节,固定包埋处理后(图5C),进行组织HE染色及TRAP标记实验,实验表明,LPS可以诱导膝关节炎症反应,与假手术组相比,炎症细胞浸润显著,而加药组炎症反应较LPS诱导组明显减轻(图5A)。TRAP实验显示LPS诱导的膝关节组织中破骨细胞数量大量增加,加入Avagacestat的膝关节炎模型中的破骨细胞数量相较LPS诱导组则显著减少,Turkey检验P<0.05,提示两组间差异具有统计学意义(图5B,D)。
3 讨 论
骨关节炎,作为一种慢性骨关节退行性变,骨稳态的破坏是其核心。在此过程中,破骨细胞的过度增殖和激活,对骨实质造成破坏,导致疾病的进展,因此,抑制破骨过程的过度激活成为一种潜在的治疗思路。前期文献调研提示破骨细胞表面的RANKL募集肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factors, TRAF)、核因子κB配体受体激活物(receptor activator for nuclear factor-κ,RANK)等[16-18],激活C-fos,T-cell核因子c1(nuclear factor of activated T cells c1,NFAT)等一系列转录因子,参与破骨细胞的增殖分化和溶骨功能[19-22],而NOTCH可通过NF-κB信号调节RANKL功能,进而影响破骨细胞分化和骨吸收过程[23],NOTCH是调节细胞生命活动的信号受体,包括NOTCH1~4四种亚型,分为胞外结构域、跨膜结构域和胞内结构段(NOTCH intracellular domain, NICD),其配体包括JAG1,JAG2,Delta1、3、4。在NOTCH与其配体结合后, γ-分泌酶可以水解
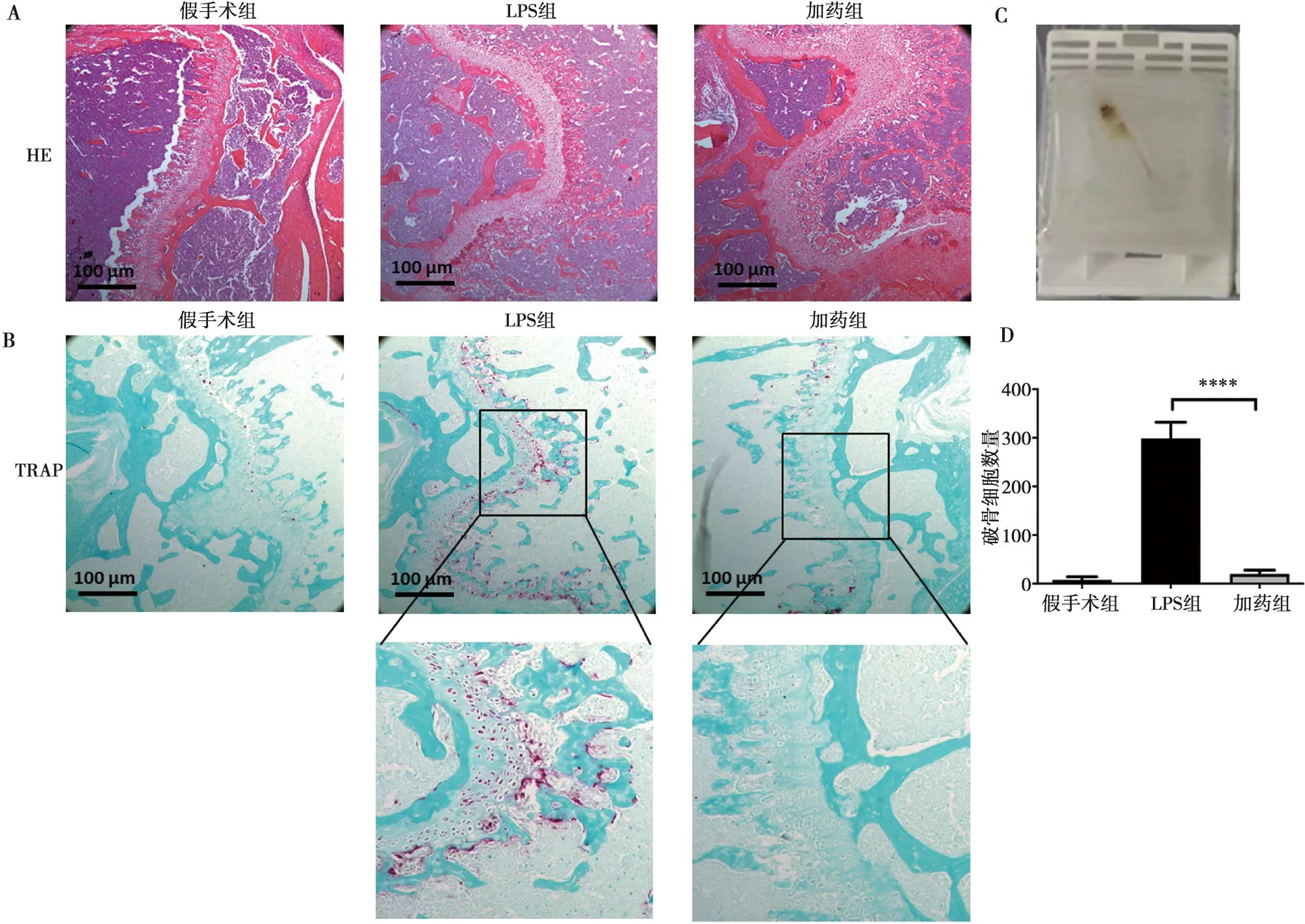
A:HE染色对比图;B:TRAP标记实验对比图(破骨细胞染为红色),最下方两图为对应LPS组和加药组的4倍放大图;C:小鼠膝关节蜡块标本;D:TRAP标记实验中破骨细胞统计图,****:P<0.000 1
NOTCH并释放NICD,NICD向核内转移,激活靶基因Hes1、Hey1等的表达,促使破骨细胞启动溶骨[24]。因此,通过抑制γ-分泌酶,就可以抑制NOTCH水解,进而调控破骨细胞的骨溶解进程,所以,寻找合适的γ-分泌酶抑制剂是针对骨关节炎基本的潜在治疗策略。
Avagacestat是一种γ-分泌酶抑制剂[13],而γ-分泌酶抑制剂可抑制IL-1β、TNF-α等多种因子表达[25],其是否可以通过调节破骨细胞相关功能而改善关节炎中的溶骨性病变尚未被证实,因此设置本实验探究其是否可以调节破骨细胞功能。在获取小鼠的BMMs细胞诱导分化后,利用毒性实验确定后续实验选择的药物浓度,之后,TRAP实验初步确定120 nmol/L与240 nmol/L药物浓度培养中,破骨细胞显著减少,且浓度越高,效果越明显;而骨吸收实验及破骨相关基因表达检测证实此药物对破骨细胞骨吸收功能具有抑制作用。
体内实验部分,利用LPS关节内注射,构建骨关节炎模型[26],Micro-CT影像学数据分析[27]和组织学检查提示LPS诱导骨关节炎模型成骨,影像学和组织学都提示关节炎中骨质遭到破坏、炎症细胞局部聚集、破骨细胞数量显著增加,而Avagacestat加药组,炎症反应有效地被抑制、破骨细胞分布显著减低、骨破坏也显著减轻,印证了Avagacestat加药后有效抑制破骨细胞的形成及功能,维持骨稳定。
综上所述,Avagacestat通过影响破骨细胞的形成、调节骨吸收相关基因表达,抑制溶骨活动,因此,可作为延缓关节炎进展的潜在药物。
