氢吗啡酮、舒芬太尼及吗啡在难治性癌痛合并口服困难患者静脉自控镇痛中的疗效比较研究
2022-10-12曾媛王国华杨勇
曾媛,王国华,杨勇
癌痛是一种令人痛苦的症状,随着癌症的进展,疼痛的频率和强度往往会增加。晚期癌症患者疼痛的患病率高达90%,其中30%~50%为中、重度疼痛[1]。世界卫生组织(WHO)的癌症三阶梯止痛法是目前首选的止痛方案。在临床实践中,该方案在最初控制轻、中度癌痛方面有效且迅速[2],在80%以上的癌痛患者中有效,但仍有10%~20%的中、重度癌痛患者并不能通过其有效缓解疼痛或因不可耐受的副作用而中断治疗导致疼痛加剧[3-4],即为难治性癌痛。癌痛药物治疗基本原则首选口服给药,但难治性癌痛患者常伴有口服困难(如:吞咽困难、恶心呕吐、消化道出血或因大量口服阿片类药物导致严重胃肠道反应),增加了治疗难度,且由于爆发痛频繁发作,频繁口服或注射短效镇痛药物时间延迟易引发患者的焦躁情绪[5];持续的疼痛给患者带来身体及精神上的双重痛苦,高达20%的癌症患者会出现抑郁,未缓解的剧烈疼痛严重影响患者的生活质量[6]。患者静脉自控镇痛(patient-controlled intravenous analgesia,PCIA)能保持达到止痛所需的最低血药浓度,通过“背景输注+患者自控”模式,可实现持续有效镇痛,同时将阿片类药物的过量、不足和毒性风险降至最低,避免阿片类药物的延迟给药[2,7]。PCIA近年来被广泛用于晚期癌痛的治疗[8],已有研究证明氢吗啡酮、舒芬太尼在癌痛患者中的镇痛效能均优于吗啡[9-10];但在比较氢吗啡酮、舒芬太尼的镇痛效能上得出的结论却不一致,有研究认为氢吗啡酮明显优于舒芬太尼[11-13],也有研究认为无明显差异[2,14],且目前尚无研究探讨氢吗啡酮与舒芬太尼在难治性癌痛合并口服困难患者PCIA中的疗效比较。因此,本研究对102例难治性癌痛合并口服困难患者进行随机对照试验,综合比较氢吗啡酮、舒芬太尼及吗啡3种强阿片类药物在PCIA中的疗效及安全性,以期为难治性癌痛合并口服困难患者提供更优的镇痛治疗方案。
1 对象与方法
1.1 研究对象 选取武汉钢铁(集团)公司第二职工医院肿瘤科及安宁疗护中心2020年5月至2022年1月收治的102例难治性癌痛合并口服困难患者为研究对象。将102例患者按随机数字表法分为三组:氢吗啡酮PCIA组、舒芬太尼PCIA组、吗啡PCIA组,每组各34例。纳入标准:(1)符合难治性癌痛诊断标准,参考《难治性癌痛专家共识(2017年版)》[15];(2)因恶心、呕吐、消化道出血、吞咽困难等原因不能口服药物,近3个月未使用过PCIA;(3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分[16]≤2分;(4)对自身疼痛、睡眠有评估及表达能力;(5)对试验药物无过敏;(6)预计生存期≥2个月;(7)自愿入组,依从性好,可自行操作PCIA泵。排除标准:(1)存在认知障碍,无法交流;(2)有药物滥用或成瘾史;(3)有严重器官功能障碍、生命体征不稳定或需紧急外科干预的急重症;(4)有医疗纠纷史;(5)因严重不良反应而不宜继续试验。本研究已通过武汉钢铁(集团)公司第二职工医院医学伦理委员会批准〔(2020)伦审科第(03)号〕,所有患者在入组前签署PCIA癌痛治疗知情同意书,并接受癌痛规范化治疗及PCIA泵操作方法的宣教。
1.2 研究方法 本研究使用的PCIA电子泵〔型号:REHN(11)〕及一次性储药盒〔型号:REHN(11)-156〕均来自江苏人先医疗科技有限公司。试验开始前根据阿片类药物剂量换算原则将所有患者前24 h使用的阿片类药物总剂量(简称前24 h总量)换算为每日等效口服吗啡剂量(morphine equivalent daily dose,MEDD),并计算三组患者首次PCIA泵入药物剂量,记录治疗前及治疗后1个月的MEDD。参数设定:(1)每小时背景量(前24 h总量/24 h);(2)PCIA量(0.5~2.0倍的背景量);(3)1 h极限量(4~6倍PCIA量+输注量/h);(4)锁定时间15 min。
1.2.1 药物配置 (1)氢吗啡酮PCIA组患者:90 mg盐酸氢吗啡酮注射液(宜昌人福药业有限责任公司,规格:2 ml∶2 mg,批号:03A08041)总量为 90 mg/200 ml(0.45 mg/ml)。(2)舒芬太尼PCIA组患者:600 μg枸橼酸舒芬太尼注射液(宜昌人福药业有限责任公司,规格:1 ml∶50 μg,批号:1180213)总量为600 μg/200 ml(3 μg/ml)。(3)吗啡 PCIA 组患者:600 mg盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,规格:1 ml∶10 mg,批号:130903-1)总量为 600 mg/200 ml(3 mg/ml)。
1.2.2 给药方法 爆发痛发作时给予PCIA量,每24 h进行1次疼痛评估,若NRS评分≤3分且前24 h爆发痛次数≤2次时维持原剂量,否则调整剂量如下:(1)轻度疼痛(NRS评分为1~3分)前24 h总量=前24 h背景总量+PCIA总量;(2)中度疼痛(NRS评分为4~6分)前24 h总量=(前24 h背景总量+PCIA总量)×(1+25%~50%);(3)重度疼痛(NRS评分≥7分)前24 h总量=(前24 h背景总量+PCIA总量)×(1+50%~100%),均取范围最小值。根据计算出的剂量重新调整参数。三组患者均持续给药1个月,及时对症处理不良反应,必要时减量10%~25%。治疗过程中密切监测患者的生命体征,定期复查血常规、血生化、心电图等。
1.3 观察指标及相关定义
1.3.1 基线资料 收集患者入院时的基线资料,主要包括性别、年龄、疼痛程度、NRS评分、MEDD、原发肿瘤类型、疼痛类型和恶性肿瘤TNM分期(参照《恶性肿瘤TNM分期》第8版[17])。
1.3.2 ECOG评分 1960年ECOG提出治疗前应该对患者一般健康状态做出评价,一般健康状态的一个重要指标是评价其活动状态(performance status,PS),因此ECOG评分又被称为WHO PS评分,用于从患者体力来了解其一般健康状况及对治疗的耐受能力,分为0~5级(分别计0~5分),评分越高表示健康状况越差[16]。
1.3.3 疼痛情况 采用疼痛数字评分表(Numerical Rating Scale,NRS)评分[18]及爆发痛发作次数评估患者疼痛情况,根据疼痛情况调整给药剂量,持续给药1个月。记录治疗前和治疗后24 h、72 h、1周、2周、1个月的NRS评分及爆发痛发作次数。
NRS评分用于评估疼痛程度,为单维度疼痛强度评估量表,将疼痛程度用0~10个数字依次表示,0表示无疼痛,10表示能够想象到的最剧烈疼痛,由患者自己选择一个最能代表自身疼痛程度的数字,或由医护人员协助患者理解后选择相应的数字描述疼痛。轻、中、重度癌痛的NRS评分分别为1~3分(睡眠不受影响)、4~6分(睡眠受影响)、7~10分(严重影响睡眠)[18]。
爆发痛于1990年被首次提出,但普遍采用2009年英国和爱尔兰姑息治疗协会给出的定义,指在背景痛控制相对稳定、镇痛药物充分应用的前提下,自发或在某些可预知或不可预知因素的诱发下突然出现的短暂疼痛加重。诊断标准:(1)在过去1周内存在持续性疼痛(背景痛);(2)在过去1周内背景痛被充分控制(NRS≤3分);(3)存在短暂疼痛加重的现象(NRS≥4分),以上条件需同时满足[19]。
1.3.4 睡眠质量 采用匹兹堡睡眠质量指数(Pittsburgh Sleep Quality Index,PSQI)评分评估患者的睡眠质量,并记录治疗前及治疗后1个月的PSQI评分。该量表由19个自评和5个他评条目构成,其中第19个自评条目和第5个他评条目不参与计分。所有的条目分为主观睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物及日间功能7个维度。每个维度按0~3计分,各维度累计得分即为PSQI总分,共0~21分,评分越高睡眠越差[20]。
1.3.5 生活质量 采用癌症患者生命质量测定量表(Cancer Quality of Life Core Questionnaire 30,QLQ-C30)评分评估患者的生活质量,并记录治疗前及治疗后1个月的QLQ-C30评分。该量表于1986年由欧洲癌症研究治疗组织(European Organization for Research and Treatment of Cancer,EORTC)[21]制定,为反映癌症患者共性的生存质量核心量表,可分为15个维度,共30个条目。本研究采用其中的5个功能维度(躯体、社会、认知、情绪、角色功能)和1个总体生活质量维度,每项评分0~100分,评分越高表示生活质量越高。
1.3.6 不良反应 记录患者治疗后1个月的不良反应,包括恶心、呕吐、便秘、食欲缺乏、口干、多汗、头晕、嗜睡、皮肤瘙痒、尿潴留、呼吸抑制、谵妄等。
1.4 统计学方法 采用SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料以(±s)表示,三组间比较采用单因素方差分析;组间两两比较采用LSD-t检验;组内治疗前后比较采用配对t检验;重复测量资料采用重复测量方差分析。计数资料以相对数表示,三组间比较采用χ2检验,当差异有统计学意义时用χ2分割法进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者基线资料比较 102例难治性癌痛合并口服困难患者中男51例、女51例,平均年龄(60.2±6.3)岁。三组患者性别、年龄、疼痛程度、NRS评分、MEDD、原发肿瘤类型、疼痛类型、TNM分期比较,差异均无统计学意义(P>0.05),见表1。
2.2 三组患者不同时间NRS评分、爆发痛发作次数比较 与治疗前相比,三组患者治疗后NRS评分、爆发痛发作次数均降低,组别与时间对NRS评分、爆发痛发作次数均存在交互作用(P<0.05);组别及时间分别对NRS评分、爆发痛发作次数主效应显著(P<0.05)。其中治疗后24 、72 h,氢吗啡酮PCIA组患者NRS评分、爆发痛发作次数均低于舒芬太尼PCIA组和吗啡PCIA组,差异有统计学意义(P<0.05);治疗后1周,氢吗啡酮PCIA组与舒芬太尼PCIA组患者NRS评分均低于吗啡PCIA组,氢吗啡酮PCIA组患者爆发痛发作次数低于吗啡PCIA组,差异有统计学意义(P<0.05);治疗后2周、1个月,氢吗啡酮PCIA组与舒芬太尼PCIA组患者NRS评分、爆发痛发作次数均低于吗啡PCIA组,差异有统计学意义(P<0.05),见表2。
表2 三组患者不同时间NRS评分、爆发痛发作次数比较(±s)Table 2 Comparison of the NRS score and frequency of episodes of breakthrough pain among three groups at different points in time

表2 三组患者不同时间NRS评分、爆发痛发作次数比较(±s)Table 2 Comparison of the NRS score and frequency of episodes of breakthrough pain among three groups at different points in time
注:a表示与氢吗啡酮PCIA组比较P<0.05,b表示与舒芬太尼PCIA组比较P<0.05
组别 例数NRS评分(分)治疗前 治疗后24 h 治疗后72 h 治疗后1周 治疗后2周 治疗后1个月氢吗啡酮PCIA组 34 7.29±1.14 5.53±1.19 5.09±1.26 3.59±1.18 2.62±0.99 1.65±0.49舒芬太尼PCIA组 34 7.12±1.07 6.56±1.02a 5.79±1.15a 3.79±1.23 2.71±1.27 1.82±0.63吗啡 PCIA 组 34 7.15±1.18 6.85±0.99a 6.47±1.11a 4.71±1.17ab 3.56±1.28ab 2.56±0.61ab F 值 F交互=2.839,F时间=461.150,F组间=31.625 P 值 P交互=0.003,P时间<0.001,P组间<0.001爆发痛发作次数(次)治疗前 治疗后24 h 治疗后72 h 治疗后1周 治疗后2周 治疗后1个月氢吗啡酮PCIA组 8.50±1.05 5.15±1.05 3.21±1.27 2.35±1.01 1.65±0.54 1.15±0.36舒芬太尼PCIA组 8.59±1.13 6.03±1.22a 4.00±1.21a 2.74±1.16 1.71±0.52 1.18±0.39吗啡 PCIA 组 8.38±1.07 6.26±1.08a 4.56±1.13a 3.35±1.04a 2.53±0.51ab 1.79±0.41ab F值 F交互=3.016,F时间=1036.618,F组间=31.434 P值 P交互=0.001,P时间<0.001,P组间<0.001组别
2.3 治疗前后MEDD及PSQI评分比较 与治疗前相比,三组患者治疗后1个月MEDD均升高,PSQI评分均降低,差异有统计学意义(P<0.05)。治疗后1个月,吗啡PCIA组患者MEDD高于氢吗啡酮PCIA组和舒芬太尼PCIA组,舒芬太尼PCIA组患者MEDD高于氢吗啡酮PCIA组,差异均有统计学意义(P<0.05);治疗后1个月,吗啡PCIA组患者PSQI评分均高于氢吗啡酮PCIA组和舒芬太尼PCIA组,差异有统计学意义(P<0.05),见表3。
表3 三组患者治疗前后MEDD及PSQI评分比较(±s)Table 3 Comparison of MEDD and PSQI score among three groups before and after treatment
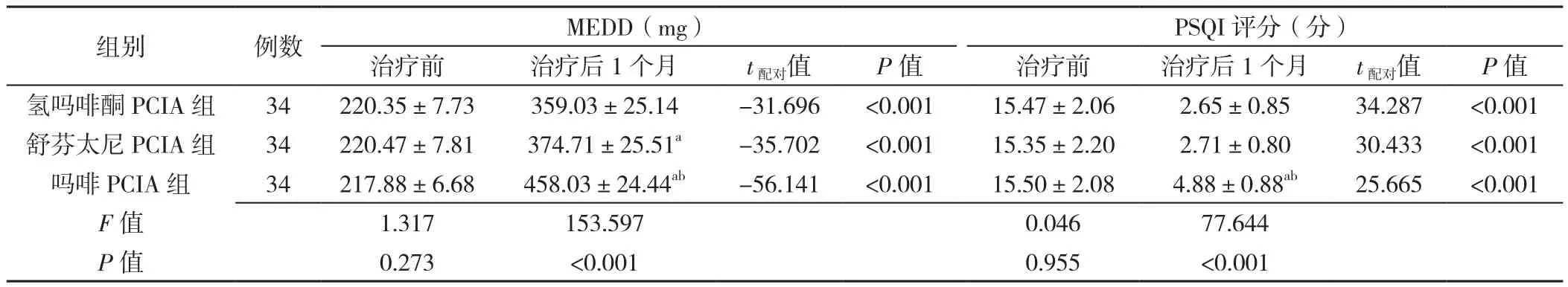
表3 三组患者治疗前后MEDD及PSQI评分比较(±s)Table 3 Comparison of MEDD and PSQI score among three groups before and after treatment
注:PSQI=匹兹堡睡眠质量指数;a表示与氢吗啡酮PCIA组比较P<0.05,b表示与舒芬太尼PCIA组比较P<0.05
组别 例数 MEDD(mg) PSQI评分(分)治疗前 治疗后1个月 t配对值 P值 治疗前 治疗后1个月 t配对值 P值氢吗啡酮PCIA组 34 220.35±7.73 359.03±25.14 -31.696 <0.001 15.47±2.06 2.65±0.85 34.287 <0.001舒芬太尼PCIA组 34 220.47±7.81 374.71±25.51a -35.702 <0.001 15.35±2.20 2.71±0.80 30.433 <0.001吗啡PCIA组 34 217.88±6.68 458.03±24.44ab -56.141 <0.001 15.50±2.08 4.88±0.88ab 25.665 <0.001 F值 1.317 153.597 0.046 77.644 P值 0.273 <0.001 0.955 <0.001
2.4 治疗前后QLQ-C30评分比较 与治疗前相比,三组患者治疗后1个月QLQ-C30各项生活质量评分均升高,差异有统计学意义(P<0.05)。治疗后1个月,吗啡PCIA组患者QLQ-C30各项生活质量评分均低于氢吗啡酮PCIA组和舒芬太尼PCIA组,舒芬太尼PCIA组患者情绪功能评分低于氢吗啡酮PCIA组,差异均有统计学意义(P<0.05);氢吗啡酮PCIA组与舒芬太尼PCIA组患者QLQ-C30躯体功能、社会功能、认知功能、角色功能和总体生活质量评分比较,差异无统计学意义(P>0.05),见表4。
表4 三组患者治疗前后QLQ-C30评分比较(±s,分)Table 4 Comparison of the total score and domain score of the QLQ-C30 among three groups before and after treatment

表4 三组患者治疗前后QLQ-C30评分比较(±s,分)Table 4 Comparison of the total score and domain score of the QLQ-C30 among three groups before and after treatment
注:QLQ-C30=生命质量测定量表;a表示与氢吗啡酮PCIA组比较P<0.05,b表示与舒芬太尼PCIA组比较P<0.05
社会功能治疗前 治疗后1个月 t配对值 P值 治疗前 治疗后1个月 t配对值 P值氢吗啡酮PCIA组 34 60.94±4.23 72.88±2.71 -14.305 <0.001 57.47±3.13 68.18±3.66 -12.410 <0.001舒芬太尼PCIA组 34 61.65±4.32 71.76±3.16 -10.828 <0.001 57.18±2.87 67.97±3.43 -15.150 <0.001吗啡PCIA组 34 61.29±4.37 67.15±2.83ab -6.224 <0.001 57.12±2.79 62.24±3.53ab -6.716 <0.001 F值 0.229 37.224 0.141 30.820 P值 0.796 <0.001 0.868 <0.001组别 例数 躯体功能组别 认知功能情绪功能治疗前 治疗后1个月 t配对值 P值 治疗前 治疗后1个月 t配对值 P值氢吗啡酮PCIA组 56.00±3.38 65.24±3.75 -12.227 <0.001 53.68±3.91 78.06±3.50 -26.062 <0.001舒芬太尼PCIA组 56.35±3.02 65.5±3.69 -9.688 <0.001 54.18±4.25 72.82±3.66a -17.782 <0.001吗啡PCIA组 56.56±3.13 61.24±3.32ab -7.139 <0.001 54.62±3.95 67.06±3.42ab -13.707 <0.001 F值 0.269 15.053 0.462 82.664 P值 0.765 <0.001 0.631 <0.001组别 角色功能 总体生活质量治疗前 治疗后1个月 t配对值 P值 治疗前 治疗后1个月 t配对值 P值氢吗啡酮PCIA组 57.21±3.57 67.18±3.19 -11.239 <0.001 58.53±3.22 77.82±2.56 -30.310 <0.001舒芬太尼PCIA组 56.76±3.63 66.71±3.06 -11.449 <0.001 58.21±3.25 76.91±2.56 -27.591 <0.001吗啡PCIA组 57.47±3.84 62.44±2.83ab -5.504 <0.001 59.29±3.56 70.74±2.92ab -14.181 <0.001 F值 0.319 25.217 0.949 70.075 P 值 0.727 <0.001 0.390 <0.001
2.5 治疗1个月后不良反应发生率比较 治疗后1个月,三组患者各项不良反应发生率比较,差异无统计学意义(P>0.05)。经对症治疗或药物减量后不良反应均可减轻或消失。在治疗阶段患者生命体征稳定,均未发生严重的药物相关不良反应,治疗后定期复查也未见与阿片类药物相关的血常规、血生化、心电图等明显异常,见表5。

表5 三组患者治疗1个月后不良反应发生率比较〔n(%)〕Table 5 Comparison of the incidence of adverse reactions among three groups one month after treatment
3 讨论
疼痛作为晚期癌症患者四种最常见和令人痛苦的症状(疼痛、呼吸困难、恶心呕吐和疲劳)之一,发生率达35%~96%,控制好这些症状能使患者及其家庭的治疗依从性、生活质量甚至生存优势大幅提高[22],癌痛的控制不佳与患者的免疫力下降、肿瘤复发及转移进展密切相关[23]。治疗中、重度癌痛首选口服阿片类药物,然而,口服困难的癌痛患者,尤其是患有头颈部或胃肠道恶性肿瘤的患者常出现严重吞咽困难、恶心呕吐等症状,此时需要非口服给药[24]。患者自控镇痛(patient-controlled analgesia,PCA)作为一种非口服给药方式,能迅速响应患者不断变化的需求,减少止痛延迟,提供比非PCA更有效的止痛效果,产生更高的患者满意度,已广泛应用于术后疼痛、分娩疼痛、创伤性疼痛等多种疼痛[25]。PCA技术也被认为是减轻癌症疼痛的镇痛阶梯的第四步,成为癌症患者姑息治疗、门诊护理和突破性疼痛管理的重要手段[26]。PCIA与患者皮下自控镇痛(patient-controlled subcutaneous analgesia,PCSA)的疗效和不良反应相似,但较PCSA起效更快[8]。有研究显示,难治性癌痛患者对吗啡的需求量增加,使用吗啡PCIA能迅速、有效止痛,显著提高其生活质量,且无严重不良反应发生[5]。
本研究结果显示,治疗后24、72 h时氢吗啡酮PCIA组的NRS评分及爆发痛发作次数均低于舒芬太尼PCIA组和吗啡PCIA组,且治疗后24 h时仅氢吗啡酮PCIA组的NRS评分显著低于治疗前,说明氢吗啡酮比舒芬太尼、吗啡起效更快,与一项包含13项研究(812例患者)的Meta分析[11]结果一致。氢吗啡酮的蛋白结合率中位数为11.6%,游离部分几乎保持不变,而舒芬太尼的蛋白结合率中位数为88.4%,游离部分在PCA期末增加[12],导致了在自控镇痛的早期,氢吗啡酮的镇痛效果明显强于舒芬太尼;有研究报道,氢吗啡酮静脉给药后5 min内起效,随后分布于各个器官[27]。本研究结果显示,治疗后1周、2周、1个月时氢吗啡酮PCIA组NRS评分及爆发痛发作次数均低于吗啡PCIA组,氢吗啡酮PCIA组与舒芬太尼PCIA组无显著性差异;治疗后2周、1个月时氢吗啡酮PCIA组与舒芬太尼PCIA组NRS评分及爆发痛发作次数均低于吗啡PCIA组,说明氢吗啡酮PCIA和舒芬太尼PCIA在起效后镇痛效果相似,均明显强于吗啡PCIA。氢吗啡酮是半合成吗啡衍生物,其化学结构在苯环的第6位有一个酮基而不是羟基,使得其效力是吗啡的5~10倍,并增强了其在大脑中的分布。由于第6位的酮基,氢吗啡酮只在第3位发生葡萄糖醛酸化,3-葡萄糖醛酸苷具有镇痛和神经兴奋作用,不通过阿片受体介导,因此氢吗啡酮在镇痛方面比吗啡更有优势[28]。芬太尼由于亲脂性,比吗啡起效更快,而舒芬太尼是芬太尼N-4位衍生物,效力是芬太尼的5~10倍,治疗指数(26 716)明显高于吗啡(71)和芬太尼(277)[29],通过直接与患者的脊髓、延髓和中脑等痛觉传导区域的μ阿片受体结合,产生显著的镇痛效果[30]。MA等[9]进行的多中心临床研究(233例患者)结果显示,氢吗啡酮对难治性癌痛的缓解效果不逊于吗啡,且随时间的推移,吗啡的剂量呈增加趋势,而氢吗啡酮的剂量呈下降趋势,在控制爆发痛方面,氢吗啡酮也比吗啡更有优势,本研究结果与之一致。
本研究结果显示,治疗后1个月,三组患者MEDD均显著高于治疗前,但氢吗啡酮PCIA组与舒芬太尼PCIA组患者MEDD均低于吗啡PCIA组,且氢吗啡酮PCIA组低于舒芬太尼PCIA组,说明三组患者PCIA治疗前的癌痛控制均不佳,阿片类药物剂量不足,治疗后氢吗啡酮和舒芬太尼的阿片类药物等效剂量均显著低于吗啡,且氢吗啡酮比舒芬太尼的等效剂量更低,降低了与阿片类药物剂量增加相关的不良反应风险。治疗后1个月,三组患者的PSQI评分均显著低于治疗前,氢吗啡酮PCIA组与舒芬太尼PCIA组的PSQI评分无显著性差异,且均显著低于吗啡PCIA组,说明三组患者PCIA治疗后睡眠均较治疗前明显好转,但氢吗啡酮PCIA和舒芬太尼PCIA的患者睡眠质量相似,且均显著高于吗啡PCIA,这也与三组患者的疼痛控制情况一致,NRS评分及爆发痛发作次数与睡眠质量呈反比。
本研究结果显示,三组患者各项生活质量评分在治疗后1个月均较治疗前升高,说明PCIA治疗后所有患者的整体生活质量均得到显著提升。氢吗啡酮PCIA组与舒芬太尼PCIA组的各项生活质量评分均高于吗啡PCIA组,说明氢吗啡酮PCIA和舒芬太尼PCIA患者的生活质量显著优于吗啡PCIA。有研究显示,癌痛控制不足是影响患者生活质量并导致患者焦虑和抑郁的主因[31]。2017年一项对126例癌症门诊患者开展的对照横断面研究也显示,焦虑的强烈预测因素是疼痛程度,报告疼痛的患者更容易出现焦虑和抑郁,充分的疼痛评估和调整被证明是疼痛管理所必需的[32]。本研究中,氢吗啡酮PCIA组与舒芬太尼PCIA组在躯体、社会、认知、角色功能和总体生活质量评分上无显著差异,但氢吗啡酮PCIA组的情绪功能评分显著高于舒芬太尼PCIA组,说明氢吗啡酮PCIA在控制患者焦虑、抑郁等情绪障碍明显好于舒芬太尼PCIA,与YANG等[14]的研究结果相似。多项研究显示,μ、δ和κ阿片受体对情绪相关过程起着非常明显的控制作用,δ阿片受体激动剂和κ阿片受体拮抗剂具有良好的抗抑郁作用[33-38]。尽管μ阿片受体激动剂具有很强的镇痛和镇静作用,但会引起呼吸抑制、便秘和欣快感等不良反应。κ阿片受体激动剂不仅具有镇痛作用,还能抑制成瘾,而δ阿片受体激动剂则具有强镇痛活性及抗焦虑、抑郁和器官保护作用。氢吗啡酮对μ阿片受体、δ阿片受体和κ阿片受体均有较高的亲和力,而舒芬太尼是一种高选择性μ阿片受体激动剂,对δ阿片受体和κ阿片受体亲和力较低。因此,氢吗啡酮PCIA改善情绪的潜在机制可能与兴奋μ阿片受体引起的疼痛缓解和兴奋δ阿片受体引起的抗焦虑和抗抑郁有关。
目前,改善阿片类药物镇痛的主要目标是以最小的不良反应负担提供最满意的镇痛效果。本研究结果显示,治疗后1个月,三组患者各项不良反应发生率无显著性差异,说明氢吗啡酮PCIA在保证镇痛效果的同时不良反应发生率与舒芬太尼PCIA、吗啡PCIA相比没有增加。
综上所述,难治性癌痛合并口服困难患者使用PCIA,相比吗啡,氢吗啡酮、舒芬太尼均能更有效地降低疼痛评分、减少爆发痛发作次数、改善睡眠、提高生活质量,但氢吗啡酮比舒芬太尼起效更快,在改善情绪方面效果更佳,阿片类药物用量更低,且不增加不良反应发生率。本研究为难治性癌痛合并口服困难患者提供了一个很好的治疗思路,由于本研究为单中心研究,样本量较少,期待未来有多中心、大样本量或前瞻性随机对照试验对本研究进行证实及补充,为不同人群找到更佳的PCIA镇痛方案。
本研究创新性:患者PCIA近年来被广泛用于晚期癌痛的治疗,已有研究证明氢吗啡酮、舒芬太尼在癌痛患者中的镇痛效能均优于吗啡,但在比较氢吗啡酮、舒芬太尼的镇痛效能上得出的结论却不一致,有研究认为氢吗啡酮明显优于舒芬太尼,也有研究认为无明显差异,且目前国内外均无研究探讨氢吗啡酮与舒芬太尼在难治性癌痛合并口服困难患者中的PCIA疗效比较。本研究进行三组方案(氢吗啡酮、舒芬太尼、吗啡)随机对照试验,采用重复测量方差分析的统计学方法,综合比较三种药物PCIA的疗效及安全性,内容新颖、方法科学合理、研究对象明确,样本量足够,得出结论较可靠,对难治性癌痛合并口服困难患者的PCIA方案选择有指导意义。
作者贡献:曾媛、杨勇进行文章的构思与设计;曾媛进行研究的实施与可行性分析,统计学处理,结果的分析与解释,撰写论文并修订论文;王国华进行数据整理,负责文章的质量控制及审校;杨勇对文章整体负责,监督管理。
本文无利益冲突。
