小鼠胆囊胆固醇结石模型不同建立方法的研究*
2022-10-12谢玉春闵莉
谢玉春,闵莉
福建中医药大学,福建 福州 350122
胆囊胆固醇结石是临床常见病和高发病,多发于女性、肥胖及中老年人群。饮食不规律、偏嗜高油高脂饮食等是目前我国胆囊胆固醇结石呈高发病率的主要原因[1-2]。常见的建立胆固醇结石动物模型方法包括控制动物饮食成分、缩窄及梗阻动物胆道、异物植入胆囊等[3]。研究发现,长期高脂致石饮食喂养可导致动物出现高血脂、肝脏脂肪性变、胆汁胆固醇过饱和,最终出现胆囊胆固醇结石,该方法成石率高、安全可靠,且表现的病理生理学变化与胆囊胆固醇结石患者相似[4],是制备胆囊胆固醇结石动物模型的常用方法。胆囊胆固醇结石与肝胆系统结构功能异常、脂代谢失衡和免疫功能障碍等病理变化相关,制备可靠、高效的胆囊胆固醇结石模型是研究防治胆囊胆固醇结石的基础,意义重大[5]。高脂致石饮食可成功制备疾病模型,但不同致石饲料的选用会影响模型建立的周期与效果。本研究通过对比相同喂养周期下不同饲料喂养诱导小鼠胆囊胆固醇结石模型的效果,探讨制备高效、可靠胆囊胆固醇结石动物模型的方法。
1 材料
1.1 实验动物36只5周龄SPF级ICR雄性小鼠,体质量(18±2) g,由福建中医药大学动物实验中心提供,许可证号:SCXK(沪)2017-0005。所有小鼠饲养于福建中医药大学实验动物中心SPF级屏障系统,室温(20±2) ℃,湿度50%~55%,12 h周期性光照环境,经普通颗粒饲料适应性喂养1周,无不良反应且饮食、饮水正常者纳入实验。本实验经福建中医药大学伦理委员会审批通过,伦理批号:FJTCM IACUC2021067。
1.2 药物与试剂小鼠总胆固醇(total cholesterol,TC)、总胆汁酸(total bile acids,TBA)、磷脂(phospholipid,PL)、胆囊收缩素(cholecystokinin,CCK)ELISA试剂盒(江苏酶免实业有限公司,货号:MM-0632M2、MM-44537M2、MM-1001M2、MM-0028M1)。
1.3 仪器EG1150H型生物组织包埋机、RM2245型石蜡切片机(德国Leica公司);SB80型摊片机、SW85型烤片机(德国Microm公司);SZ66型体视显微镜(重庆奥特光学仪器有限公司);Axio Imager A2型显微镜(德国Carl Zeiss公司)。
2 方法
2.1 动物分组与模型制备将36只5周龄SPF级ICR雄性小鼠随机分为对照组、2%高脂组、1%胆固醇组,每组12只。对照组采用普通颗粒饲料(60%碳水化合物、22%蛋白质、10%脂肪、8%纤维)喂养;2%高脂组采用2%高脂饲料(每1 kg含全价饲料粉料825 g,胆固醇20 g,胆酸5 g,牛油150 g)喂养[6-7];1%胆固醇组采用1%胆固醇致石饲料(0.5%胆酸盐、1%胆固醇、56%碳水化合物、10%乳脂、18%蛋白质)喂养[8],自由摄食16周后,通过查看小鼠胆囊结石的大小和数量、胆囊体积、胆汁浑浊度及透光性等评估模型。
2.2 小鼠存活率、成石率及结石形成情况观察饲养过程中动态观察小鼠精神状态、饮食及饮水情况,记录各组小鼠的死亡数量,计算存活率。小鼠处死后,观察并记录各组造模成功的小鼠数量及胆囊体积大小、胆汁的浑浊度、透光性等。
2.3 肝脏、胆囊HE染色喂养16周后,小鼠禁食不禁水12 h,腹腔注射麻醉后摘眼球取血,颈椎脱臼处死小鼠,打开腹腔,完整剥离胆囊并清理表面血液,体视镜拍照后将胆汁吸取放入EP管保存备用,胆囊组织放入固定液中保存。在肝大叶处取一块大小约为5 mm×5 mm的肝组织放入40 ng·L-1多聚甲醛固定,脱水、透明、包埋、切片、染色、封片后在显微镜下观察胆囊、肝脏组织的形态变化。
2.4 胆汁中TC、TBA、PL、CCK的测定严格根据ELISA试剂盒说明书的要求进行操作,检测胆囊中胆汁相关成分的含量。

3 结果
3.1 各组小鼠存活率、成石率及胆汁情况比较对照组小鼠无死亡,胆囊大小正常,胆汁澄清透亮,透光性好,胆囊内无沉淀。2%高脂组小鼠死亡1只,胆汁呈浑浊状态,透光性变差,8只小鼠胆囊可见固体沉淀,成石率为67%。1%胆固醇组小鼠死亡1只,胆囊体积明显增大,胆汁呈褐色浑浊状态,透光性差,有10只小鼠胆囊出现明显的固体沉淀,成石率约为83%。见表1、图1。

表1 各组小鼠存活率、成石率比较 只

图1 各组小鼠胆囊结石情况
3.2 各组小鼠胆囊胆汁脂类成分含量及CCK水平比较与对照组比较,2%高脂组和1%胆固醇组胆汁内TC含量升高,胆汁TBA、PL、CCK含量降低;与2%高脂组比较,1%胆固醇组胆汁TC、CCK含量降低,胆汁内TB、PL含量升高,差异均有统计学意义(P<0.01)。2%高脂组和1%胆固醇组胆汁中TC、TBA、PL三者比例失衡,胆汁内胆固醇溶解率低,胆汁具有成石趋势。见表2。

表2 各组小鼠胆囊胆汁脂类成分含量及CCK水平比较
3.3 各组小鼠肝脏、胆囊病理学改变肝脏HE染色显示,对照组肝脏细胞排列整齐,结构完整;2%高脂组小鼠肝脏细胞结构破坏严重,可见大量脂质空泡,肝脏存在明显的脂肪变性;1%胆固醇组肝细胞排列紊乱,细胞结构破坏,肝脏出现小的脂质空泡。胆囊HE染色显示,对照组胆囊壁结构正常;2%高脂组胆囊壁肌层变厚,浆膜结构及形态破坏;1%胆固醇组胆囊壁肌层毛糙、增厚,浆膜结构及形态破坏严重。见图2、图3。
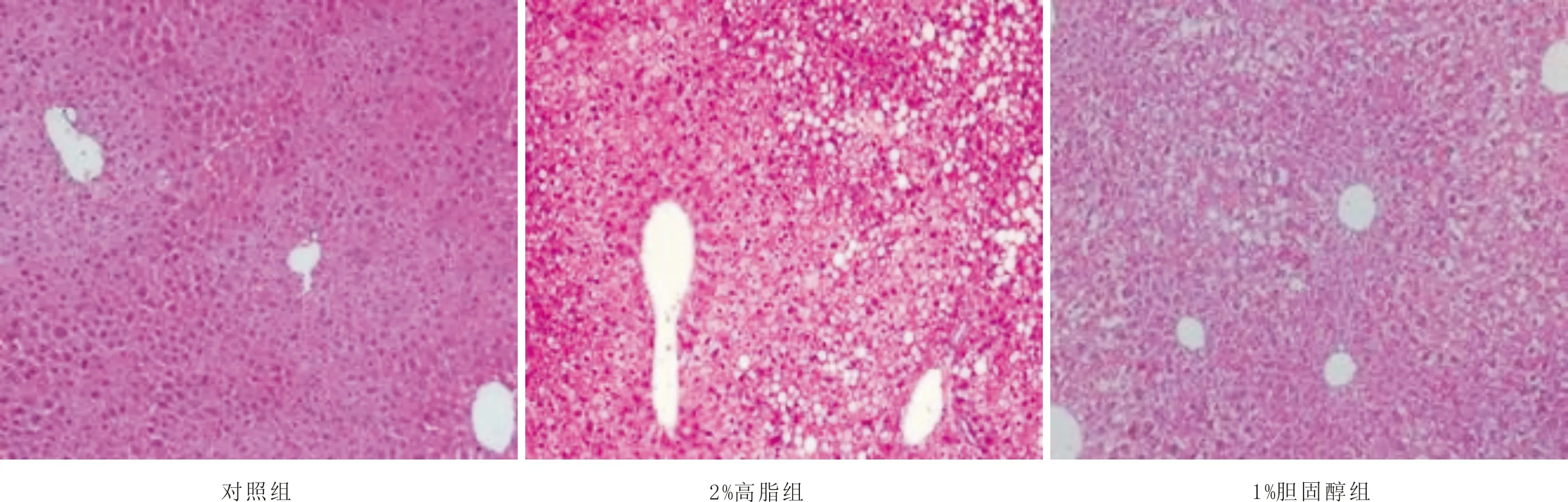
图2 各组小鼠肝脏病理组织图(HE,×150)
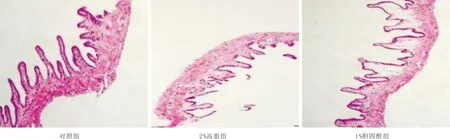
图3 各组小鼠胆囊病理组织图(HE,×200)
4 讨论
胆囊胆固醇结石的发病涉及一系列复杂病理变化,年龄、性别、饮食习惯等相关危险因素[9]通过影响脂质代谢[10]、胆囊功能运动[11]致使胆汁化学成分异常[12]、胆汁淤积、细菌感染等诱发胆囊胆固醇结石。胆固醇为胆囊胆固醇结石的主要成分,胆汁胆固醇过饱和是胆固醇结石形成的首要条件[13]。正常胆汁中含有胆固醇、胆汁酸、磷脂三种脂类[14-16]。肝脏调控机体胆固醇的合成、分解、吸收与转运,胆汁中胆固醇来源于肝细胞摄取的血浆脂蛋白胆固醇和肝细胞合成的胆固醇[17]。胆酸循环是清除类固醇物质的主要途径,胆汁内胆固醇溶于胆盐形成的微胶粒中,肝细胞内胆固醇异常代谢引起胆汁酸、磷脂等三种脂类比例失调是胆囊胆固醇结石重要的病理基础[18]。本实验结果表明,与对照组相比,2%高脂和1%胆固醇饮食喂养的两组小鼠肝脏可见脂质空泡,胆汁TC水平升高,而TBA及PL水平下降,胆囊内胆汁浑浊,透光性差,且可见固体沉淀。胆固醇的摄入导致肝脏分泌到胆汁的胆固醇过多,产生的胆汁酸和磷脂过少,胆汁内脂类比例失调,胆汁胆固醇含量增高,过多胆固醇附着在胆囊黏膜表面最终形成胆囊胆固醇结石,即含胆固醇饮食诱导胆囊胆固醇结石模型的方法可靠。
研究表明,胆汁中的胆固醇饱和状态不是形成胆固醇结石的唯一条件[19],胆囊动力损伤可加速过饱和胆固醇结晶析出成石过程。胆囊胆固醇结石产生于胆囊,胆囊规律性的收缩和舒张运动促进胆汁的排出,可防止胆结石的发生。CCK介导胆囊收缩及胰酶分泌[20],是调节胆囊运动最主要的激素,可评估胆囊功能[21]。动物模型和临床研究提示,胆囊壁CCK受体在胆石症胆囊收缩损害中起重要作用[22]。胆囊结石患者血浆CCK水平明显降低[23],血液循环中CCK与胆囊壁CCK受体结合可触发胆囊收缩,将胆汁释放到十二指肠,因此,CCK水平可间接反映胆囊壁CCK受体活性。本实验研究结果显示,与2%高脂组相比,1%胆固醇组CCK水平明显降低,胆囊体积明显增大,胆囊内有较大的固体沉淀,胆汁褐色浑浊,透光性差,胆囊壁毛糙、增厚严重。1%胆固醇组小鼠低水平CCK含量导致胆囊壁CCK与受体结合减弱,胆囊动力不足致使胆汁淤积于胆囊,胆囊体积增大;胆汁过度浓缩致使胆汁内成分发生改变,胆汁呈褐色浑浊状态。CCK水平差异及胆囊结构病理变化导致胆囊动力减弱,为成石胆汁中过饱和的胆固醇成核、析出提供充足的时间和空间。
综上所述,胆固醇饮食是建立胆囊胆固醇结石动物模型的重要因素,长期喂养含胆固醇致石饲料可导致肝脏脂肪性变,胆汁内三种脂类比例失调,胆固醇成核析出。但胆固醇对胆石症的贡献度受脂质代谢的内在差异影响[24],致石饲料中胆固醇含量的高低并不是影响模型效果的唯一或者决定性条件。胆囊胆固醇结石是多因素共同作用的结果,1%胆固醇组与2%高脂组模型成功建立与摄入含胆固醇饮食导致机体脂质代谢异常有关,而两组的模型效果差异可能与两组CCK水平及胆囊形态结构差异影响的胆囊动力密切相关。2%高胆固醇饲料为课题组前期构建胆石症“病”模型主要方法,本实验通过对比1%胆固醇饲料与2%高胆固醇饲料喂养建立模型的差异发现,同一条件下,1%胆固醇饲料制备胆石症模型效果优于2%高胆固醇饲料,即1%胆固醇饲料可作为制备胆囊胆固醇结石模型的备选,为课题组后期探讨中医药防治胆石症分子机制研究及其他相关研究提供模型支持。不同成分配比的致石饮食构建的模型效果存在差异,本研究仅对比了两种致石饲料的模型差异,研究范围较局限,对构建模型方法的选用有一定的参考价值,但未筛选出最优的造模方法。1%胆固醇组与2%高脂组CCK水平及胆囊形态改变与“病”模型差异具有一致性,但本研究未进行胆囊收缩功能相关实验进一步证明模型差异与胆囊动力的相关性。除饮食成分外,胆石症模型效果与实验动物的种属[25]、品系[26-27]、性别[28]等因素密切相关,构建成石率高、造模周期较短、动物存活率高的简单、可复制理想模型仍需进一步研究探索。
