子痫前期合并胎儿生长受限对新生儿严重不良结局的影响
2022-10-12王晓燕
王晓燕,彭 兰
(南京医科大学附属苏州市立医院产科,江苏 苏州 215002)
胎儿生长受限(fetal growth restriction,FGR)的新生儿死亡率和发病率均高于正常胎龄儿[1],可增加成人心血管疾病和2型糖尿病等发病风险[2]。目前早发型子痫前期被认为是胎盘子痫前期,晚发型子痫前期被认为是母体子痫前期[3]。早发型子痫前期的产妇常易合并FGR,通常认为是由于胎盘功能不良导致。由于不同国家间诊断标准的差异,FGR在子痫前期产妇中的发病率从12.8%到58.6%不等[4-6]。
2018年国际妊娠高血压研究学会(International Society for the Study of Hypertension in Pregnancy,ISSHP)指南建议子痫前期的诊断包含胎儿生长受限,但不建议作“轻度”或“重度”的分级,并强调FGR应作为子痫前期的诊断依据,其原因是子痫前期为胎盘源性疾病,胎盘源性疾病可以导致胎儿生长受限[7]。而2020年更新的美国妇产科医师协会(American College of Obstetricians and Gynecologists,ACOG)指南未将胎儿生长受限作为子痫前期的诊断或严重特征之一[8]。我国2020年发布的妊娠期高血压疾病诊治指南中,将胎儿生长受限或羊水过少、胎死宫内、胎盘早剥等作为重度子痫前期的诊断指标之一[9]。不同指南的差异可影响子痫前期的诊断和处理,从而影响妊娠结局。本文选择子痫前期产妇作为研究对象,目的在于探讨子痫前期产妇合并FGR对新生儿结局的影响,为指导子痫前期合并FGR是否积极终止妊娠及分娩孕周的选择提供临床依据。
1 对象与方法
1.1 研究对象
选择2015年1月1日至2015年12月31日在苏州市立医院本部分娩的300例子痫前期产妇为研究对象。纳入标准:孕周≥28周、诊断为子痫前期、单胎活产分娩。排除标准:有内分泌疾病(如2型糖尿病、甲状腺疾病等)、心血管疾病(慢性高血压、心脏病等)、肝肾疾病等既往病史,胎死宫内者。所有研究对象均知情同意自愿参与研究。
1.2 资料收集及诊断标准
产妇及新生儿的相关信息通过医院电子病历系统查询并获取,内容包括年龄、不良孕产史、妊娠合并症和并发症、分娩方式、分娩孕周、围产儿结局、入院至分娩前的血压及尿蛋白的最差值等。所有数据通过EpiData软件录入,由双人核对信息,建立数据库。研究分组:按照结局分为发生新生儿严重不良结局组和未发生新生儿严重不良结局组。
本研究相关诊断标准包括①子痫前期:妊娠20周后孕妇出现收缩压≥140mmHg和(或)舒张压≥90mmHg,伴有下列任意1项:尿蛋白定量≥0.3g/24h,或尿蛋白/肌酐比值≥0.3,或随机尿蛋白≥(+);无蛋白尿但伴有以下任何1种器官或系统受累:心、肺、肝、肾等重要器官,或血液系统、消化系统、神经系统的异常改变,胎盘-胎儿受到累及等;②胎儿生长受限:根据2019年发布的《胎儿生长受限专家共识》诊断[10];③新生儿严重不良结局:为复合不良结局,参考国内外文献报道[11-13],包括新生儿死亡(含放弃抢救自动出院者)、呼吸衰竭、脑出血、坏死性肠炎、败血症等。
1.3 统计学方法
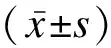
2 结果
2.1 影响新生儿严重不良结局的单因素分析
本研究共纳入300例子痫前期产妇,年龄20~43岁,中位年龄29(26~33)岁。发生新生儿严重不良结局者41例(13.67%),未发生新生儿严重不良结局者259例(86.33%)。发生新生儿严重不良结局组产妇分娩孕周、胎儿出生体重均小于未发生新生儿严重不良结局组,且发生新生儿严重不良结局组流产史、剖宫产终止妊娠比例更高,疾病的严重程度更高(平均血压更高,尿蛋白≥3+更常见),合并FGR的比例更高(Z/χ2值介于-9.28~42.15之间,P<0.05)。两组年龄、是否试管婴儿、瘢痕子宫、患有妊娠期糖尿病及发生胎盘早剥等方面差异无统计学意义(P>0.05),见表1。

表1 影响新生儿严重不良结局的单因素分析[M(Q1~Q3),n(%)]
2.2 影响新生儿严重不良结局的多因素分析
多因素Logistic回归分析显示,子痫前期产妇合并FGR是发生新生儿严重不良结局的独立危险因素,分娩孕周较长(<40周)是发生新生儿严重不良结局的独立保护因素,其OR值及95%CI分别为3.02(1.05~8.69)、0.47(0.37~0.60),P<0.05,见表2。

表2 影响新生儿严重不良结局的多因素Logistic回归分析
2.3 子痫前期合并FGR产妇中孕周与新生儿严重不良结局的关系
对90例子痫前期合并FGR进行单独分析,发生新生儿严重不良结局30例(33.3%),未发生新生儿严重不良结局60例(66.7%)。在子痫前期合并FGR产妇中,不同孕周发生新生儿严重不良结局差异有统计学意义(χ2=32.95,P<0.05),两两比较发现,28~33周组发生新生儿严重不良结局的风险高于34~36周组及37~40周组(χ2值分别为20.80、23.67,P<0.01),但后两组差异无统计学意义,见表3。

表3 子痫前期合并FGR产妇中孕周与新生儿严重不良结局的关系[n(%)]
3 讨论
3.1 FGR与胎盘功能不全
FGR可由母体因素(如营养不良、高血压疾病、子痫前期)、胎儿因素(染色体异常、多胎)或胎盘因素等引起[14],其中大部分FGR是由胎盘功能不全引起的[15]。早发性子痫前期和FGR病都被认为是胎盘源性疾病,具有相似的胎盘病理变化,其特征是子宫和胎盘螺旋动脉的重塑存在生理缺陷,导致子宫胎盘灌注受限[16]。Surrico等[17]用人脐带间充质干细胞和滋养层细胞系检测子痫前期和胎儿宫内发育迟缓患者体内的过氧化应激反应,发现两种疾病都与氧化应激水平升高有显著联系。因此当子痫前期患者出现FGR时,有理由认为此时胎盘功能受损。胎盘功能不全的特征是血流优先重新分布到重要器官(如脑、心肌和肾上腺),而其他器官包括胃肠道、皮肤等血流相对减少,这种胎儿血流的重新分布是由缺氧直接导致[18]。新生儿的预后通常取决于胎盘功能不全发生的时间和生长受限的严重程度,因此早期识别、早期干预对新生儿预后至关重要。
与本研究相似,Venkatesh等[6]发现<34周的子痫前期新生儿的不良结局与胎儿生长受限有关,且与有无合并症无关。Carter等[12]研究发现子痫前期产妇中合并FGR者比不合并FGR者更易发生母亲和新生儿不良结局。Gardosi等[19]通过两年时间研究了389例死产,发现胎儿生长受限是死产的主要危险因素,并且产前未检测到FGR的死产率比在产前检测到FGR的死产率高5倍(32.0% vs 6.2%)。一项回顾性队列研究显示,对FGR的适当检测有利于降低死产率[20]。FGR常常提示胎盘功能不全,应该引起临床的足够重视,因此本研究支持FGR作为重度子痫前期的诊断指标之一。
3.2 子痫前期合并FGR时分娩孕周的选择
大多数国家指南推荐妊娠37周后的子痫前期孕妇应建议分娩,因为这样既可显著降低孕妇疾病发生风险又不会增加围产儿疾病风险。然而,妊娠34~37周的先兆子痫孕妇应在何时终止妊娠,目前仍存在争议。本研究将子痫前期合并FGR患者孕34~36周与37~40周对比,发现发生新生儿严重不良结局的差异无统计学意义,因此支持子痫前期合并FGR时,当孕周≥34周后即可适时终止妊娠。2019年《Lancet》上发表的研究共招募了46家医院中901名妊娠34~37周的子痫前期孕妇,将其随机分为计划提前分娩组(n=450)和期待疗法组(n=451),结果发现与期待疗法组相比,计划提前分娩可降低母亲不良结局且未增加新生儿不良结局[21]。子痫前期产妇中合并FGR是新生儿严重不良结局的危险因素,但分娩时机仍需权衡早产相关的潜在风险。本研究认为部分患者经过系统评估后≥34周终止妊娠是可行的。
本研究存在一定的局限性。首先,样本量相对较小,可能存在选择偏倚,后期应进一步扩大样本量;第二,本文为单中心研究,可进一步加大与多中心合作,增加其他相关因素的调查,降低混杂因素;第三,本研究未对胎儿生长受限的程度进行分层管理,且未对严重不良结局逐一进行分析,在之后的研究中可继续深入探讨。
