绵羊干扰素调节因子1基因克隆、序列分析及真核表达
2022-10-12魏立翔解艺璇高之煜曹鑫艳张彦兵孙延鸣
魏立翔,解艺璇,高之煜,曹鑫艳,张彦兵,孙延鸣
(石河子大学动物科技学院,新疆石河子 832003)
干扰素调节因子(interferon regulatory factors,IRFs)是一类在天然免疫和适应性免疫调控中均发挥作用的转录因子,IRFs广泛表达于免疫细胞[1]。在哺乳动物中,该家族成员包括IRF1~IRF9,具有抗病毒、免疫调节以及生长调控等功能[2]。其中,干扰素调节因子1(interferon regulatory factor 1,IRF1)是干扰素(interferon,IFN)通路中的重要组成部分,可激活IFN和核因子κB(nuclear factor kappa-B,NF-κB)启动子[3]。IRF1的转录活性取决于其基因N端的DNA结合区域(DNA binding domain,DBD),由115个氨基酸组成,通过DBD结构,IRF1基因可以结合到DNA上,从而发挥调控功能[4]。IRF1是最早被认为可以激活IFN-β的转录因子,后来被证实IRF1可以与IFN-β基因启动子区域的干扰素调节元件(interferon stimulated responsive elements,ISREs)结合,从而调控该基因的表达[5]。
静息状态细胞中IRF1常以低水平表达,当机体受病毒感染时,IRF1表达显著上调,激活1型IFN的启动子,触发由IFN介导的抗病毒反应[6-7]。同时也有研究发现,新佛朗西丝菌感染细胞时,IRF1可通过驱动鸟苷酸结合蛋白(guanylate binding proteins,GBPs)的表达,使细菌在细胞内被杀死[8]。绵羊支原体肺炎是一种由绵羊肺炎支原体(Mycoplasmaovipneumoniae,MO)引起的呼吸道疾病,以咳嗽、气喘、进行性体重减轻和肺间质增生炎症为主要特征[9],严重威胁我国养羊业发展;前期数据发现,MO感染能诱导绵羊肺部IRF1差异表达[10]。然而,绵羊IRF1基因尚未克隆,以及绵羊IRF1功能尚不清楚。
本研究旨在克隆绵羊IRF1基因ORF,对其进行生物信息学分析,构建IRF1真核表达载体,以期为探索绵羊IRF1功能提供基础资料。
1 材料与方法
1.1 材料
1.1.1 细胞和质粒 HEK293T为本实验室保存;DH5α感受态细胞,购自天根生化科技(北京)有限公司;真核表达载体p3×Flag-CMV-14,购自上海康朗生物科技有限公司。
1.1.2 主要试剂 Trizol,英潍捷基有限公司产品;DNA分子质量标准DL 2000,反转录试剂盒,LATaq酶,Hind Ⅲ、EcoRⅠ限制性内切酶,TaKaRa公司产品;琼脂糖凝胶DNA回收试剂盒,南京诺维赞生物科技有限公司产品;质粒小提试剂盒,天根生化科技(北京)有限公司;小鼠抗FLAG-M2抗体,Sigma公司产品;HRP标记的羊抗鼠IgG,上海圣尔生物科技有限公司产品;超敏ECL发光试剂盒,上海圣尔生物科技有限公司产品;LipofectamineTM2000,赛默飞世尔科技(中国)有限公司产品。
1.1.3 主要仪器 Micro21低温高速离心机、ABI-2720 PCR扩增仪,赛默飞世尔科技(中国)有限公司产品;Alpha紫外凝胶成像仪,美国Protein Simple公司产品;PowerPac基础型核酸电泳仪,美国Bio-Rad公司产品;恒温培养箱,Thermo Fisher生物科技有限公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中预测的绵羊IRF1基因序列(登录号:NM_001009751.1),使用Primer5.0软件设计扩增引物,上游引物添加了HindⅢ酶切位点,序列为:5′-ccAAGCTTatgcctatcactcggatgcgcatgagacc-3′;下游引物添加了EcoRⅠ酶切位点,序列为:5′-cgGAATTCtggtgcacaaggaatggcctggatggagggc-3′。引物由生工生物工程(上海)股份有限公司合成。
1.2.2 绵羊IRF1扩增及鉴定 采集感染MO绵羊肺脏组织,用Trizol法提取绵羊肺组织总RNA,按照反转录酶试剂盒说明合成cDNA。以反转录的cDNA为模板,扩增绵羊IRF1基因。PCR反应体系为50 μL:2×LATaqmix 25 μL,肺组织cDNA 2 μL,上、下游引物各2 μL,ddH2O 19 μL;PCR反应程序为:95℃预变性5 min;95℃ 20 s,56℃ 20 s,72℃ 1 min,35个循环;72℃ 7 min。PCR产物以10 g/L琼脂糖凝胶电泳检测,回收DNA并测序。
1.2.3 绵羊IRF1生物信息学分析 使用DNAMAN软件对测序的基因序列进行拼接,获得绵羊IRF1 ORF基因全长序列,将IRF1全长序列提交GenBank(登录号:MZ959373)。从GenBank数据库中搜索不同物种的IRF1 氨基酸序列,使用ClustalX2、DNAstar软件对山羊、猪、人、马氨基酸序列进行比对;利用MEGA7软件构建系统进化树;使用ProtParam tool(https://web.expasy.org/protparam/)在线程序对绵羊IRF1蛋白的氨基酸组成、分子式、等电点等进行分析;使用SignalP (http://www.cbs.dtu.dk/services/SignalP/)、TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)在线软件对绵羊IRF1蛋白的信号肽和跨膜结构域进行分析;使用NetPhos2.0 Server(http://www.cbs.dtu.dk/services/NetPhos-2.0/)、NetNGlyc1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc-1.0/)在线软件对绵羊IRF1蛋白的磷酸化位点和糖基化位点进行预测。
1.2.4 重组质粒p3×Flag-CMV-14-IRF1构建和鉴定 利用限制性内切酶HindⅢ和EcoRⅠ对测序正确的PCR产物和p3×Flag-CMV-14载体分别双酶切,纯化回收后连接。连接体系20 μL,包括T4 DNA连接酶1 μL、线性化载体3 μL、纯化的片段14 μL、10×Ligation buffer 2 μL,16℃金属浴过夜连接;将连接产物转化DH5α感受态细胞,涂布于氨苄西林抗性平板,挑选阳性单菌落液体培养后提取质粒。IRF1质粒双酶切验证后,送生工生物工程(上海)股份有限公司测序。
1.2.5 绵羊IRF1质粒转染及蛋白样品制备 HEK293T细胞接种6孔板,过夜培养,使用LipofectamineTM2000将重组阳性质粒p3×Flag-CMV-14-IRF1质粒转染细胞,同时将空质粒p3×Flag-CMV-14转染至HEK293T细胞设为空白对照组,转染24 h后,收获细胞。蛋白裂解液裂解细胞,沸水浴5 min,超声处理裂解,12 000 r/min离心10 min,吸取上清与5×SDS loading buffer混合,沸水浴10 min;蛋白样品保存-20℃。
1.2.6 蛋白免疫印迹试验 将蛋白样品进行100 g/L SDS-PAGE电泳,电泳结束后使用湿转印法将蛋白转印到NC膜,用50 g/L的脱脂乳于室温封闭2 h~3 h,用1×TBST对NC膜漂洗3次,加入小鼠抗-FLAG 抗体(1∶4000),4℃孵育过夜,用1×TBST洗涤3次后,加入HRP标记的山羊抗鼠IgG(1∶6000),室温孵育50 min,用1×TBST洗涤3次后,用ECL显色发光试剂盒进行显色。
2 结果
2.1 绵羊IRF1扩增及鉴定
用PCR成功扩增出绵羊IRF1基因ORF,大小为969 bp,与预期大小相符(图1)。克隆的绵羊IRF1 ORF基因序列与GenBank中预测的绵羊IRF1 ORF基因序列一致,表明成功克隆绵羊IRF1基因ORF。
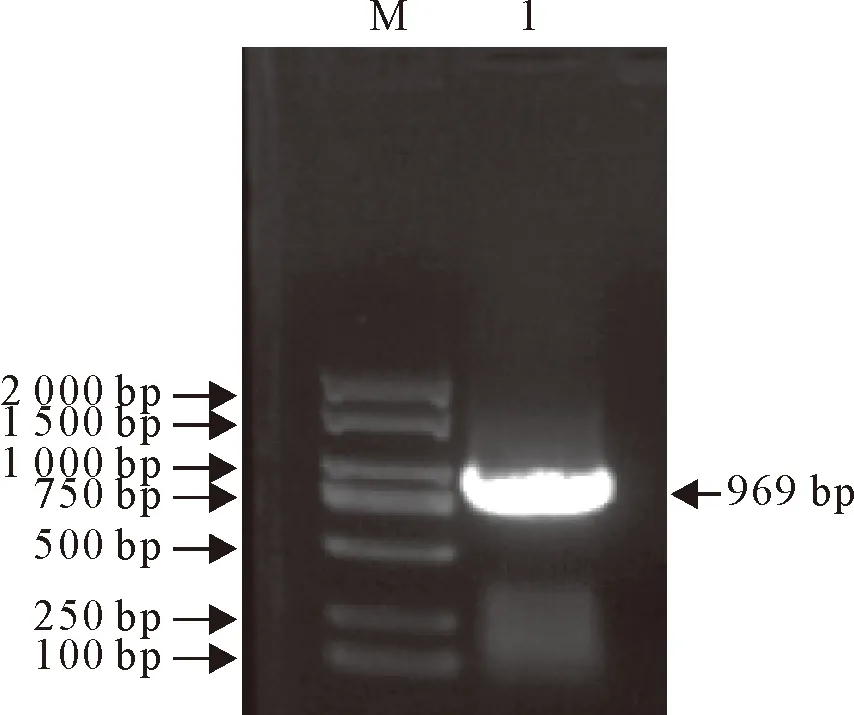
M.DNA标准DL 2000;1.绵羊IRF1的PCR扩增产物M.DNA Marker DL 2000;1.PCR product of sheep IRF1图1 绵羊IRF1 PCR扩增结果Fig.1 PCR amplification results of sheep IRF1
2.2 绵羊IRF1生物信息学分析
2.2.1 绵羊IRF1氨基酸序列与其他物种的比对分析 用绵羊IRF1氨基酸序列与山羊(XP 005682678.1)、猪(NP 001090882.1)、人(P10914.2)、马(XP 005599497.1)氨基酸序列进行比对,相似性分别为100%、91.61%、87.73%和89.44%。绵羊与上述几个物种IRF1 前117个氨基酸序列完全一致(图2)。

阴影标记的区域为同源性氨基酸,黑色阴影区代表氨基酸同源性为100%,灰色阴影区代表同源性为75%以上。The shaded areas are homologous amino acids,the black shaded areas represent 100% homology of amino acids,and the gray shaded areas represent more than 75% homology of amino acids.图2 绵羊IRF1氨基酸序列的多重比对Fig.2 Multiple alignment of the amino acids sequences of sheep IRF1
2.2.2 系统进化树构建 利用绵羊、山羊、牛、猪、白鳍豚、马、人、小鼠、大鼠、鸡、鸽子、斑马鱼等的IRF1氨基酸序列构建进化树。结果显示,哺乳动物IRF1、鸟类IRF1分为两大支,说明哺乳动物之间IRF1亲缘关系较近,而与鸟类IRF1亲缘关系较远;绵羊、山羊、牛IRF1聚为一支,绵羊等IRF1与小鼠、大鼠IRF1亲缘关系较远,在不同的分支(图3)。

图3 不同物种IRF1系统进化树分析Fig.3 Phylogenetic of sheep IRF1 sequences predicted by different species
2.2.3 绵羊IRF1理化性质 绵羊IRF1基因ORF为969bp,编码322个氨基酸。其中带负电荷氨基酸残基数(Asp+Glu)为44个,带正电荷氨基酸残基数(Arg+Lys)为39个,Ser、Pro、Glu、Leu含量比较高,分别为10.2%、9.0%、7.1%和7.1%(表1);分子式为C1596H2497N435O497S17,理论等电点为5.58,属于弱酸性蛋白;绵羊IRF1蛋白有一个潜在的N-糖基化位点,存在于第163位氨基酸,潜在值为0.602 1。此外,绵羊IRF1蛋白无信号肽和跨膜结构。

表1 绵羊IRF1氨基酸组成Table 1 Amino acid composition of sheep IRF1
2.2.4 绵羊IRF1磷酸化位点预测 使用NetPhos2.0 Server对绵羊IRF1磷酸化位点进行预测,结果显示该蛋白存在多个潜在的磷酸化位点,绵羊IRF1蛋白可能具有较高的磷酸水平(图4)。

图4 绵羊IRF1蛋白磷酸化位点预测Fig.4 Phosohorylation site prediction of sheep IRF1 protein
2.3 绵羊IRF1 真核表达载体构建和鉴定
利用限制性内切酶对重组质粒p3×Flag-CMV-14-IRF1双酶切鉴定,经琼脂糖凝胶电泳检测,发现2条条带(图5),其中大小约为6 310 bp的为p3×Flag-CMV-14载体条带,大小约为969 bp的是绵羊IRF1条带;进一步测序分析,测序结果与预测的绵羊IRF1 基因序列一致,表明成功构建p3×Flag-CMV-14-IRF1重组质粒。
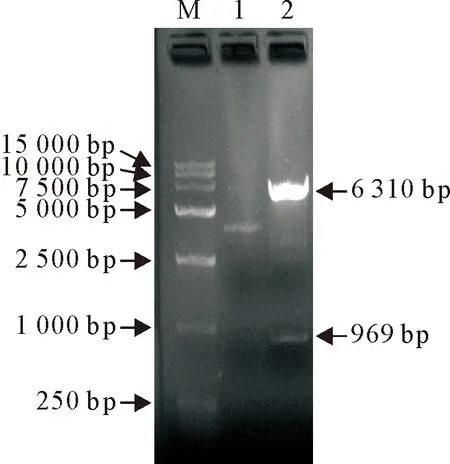
M.DNA标准DL 15 000;1.重组质粒p3×Flag-CMV-14-IRF1;2.重组质粒p3×Flag-CMV-14-IRF1 HindⅢ、EcoRⅠ双酶切M.DNA Marker DL 15 000;1.p3×Flag-CMV-14-IRF1 recombinant plasmid;2.p3×Flag-CMV-14-IRF1 recombinant plasmid digested by HindⅢ and EcoRⅠ图5 重组质粒p3×Flag-CMV-14-IRF1酶切图Fig.5 Enzyme digestion of recombinant plasmid p3×Flag-CMV-14-IRF1
2.4 IRF1重组蛋白的表达分析
绵羊IRF1真核表达质粒转染细胞,利用Western blot方法检测IRF1重组蛋白表达水平。结果显示p3×Flag-CMV-14-IRF1质粒在细胞中高效表达,绵羊IRF1大小为50 ku左右,与预期大小一致,可用于后续试验。
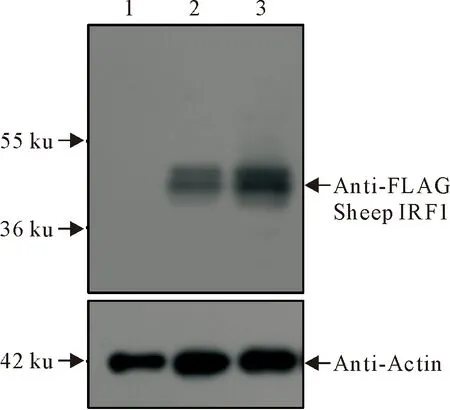
1.转染空载体(500 ng);2.转染p3× Flag-CMV-14-IRF1 (250 ng);3.转染p3× Flag-CMV-14-IRF1 (500 ng)1.Transfection of empty vector(500 ng);2.Transfection of p3× Flag-CMV-14-IRF1 (250 ng);3.Transfection of p3× Flag-CMV-14-IRF1 (500 ng)图6 绵羊IRF1蛋白过表达分析Fig.6 Analyzed over expression of sheep IRF1 protein by Western blot
3 讨论
干扰素调节因子家族在干扰素的产生中发挥重要的调控作用,其中IRF1参与宿主对病原微生物的天然免疫和适应性免疫,具有调控IFN-β表达的功能[7]。然而,绵羊的IRF1基因尚未克隆鉴定。本研究成功克隆了绵羊IRF1 ORF,对克隆的序列进行了生物信息学分析,并构建了绵羊IRF1的真核表达载体,通过质粒转染成功表达了绵羊IRF1重组蛋白。
IRF1具有和其他干扰素家族成员相同的结构特点,其N端编码DNA结合区域(DNA binding domain,DBD)的氨基酸在结构和功能上高度保守[11-12]。通过氨基酸序列比对发现,绵羊、山羊、人、马、猪的IRF1前117个氨基酸高度保守,其中,克隆的绵羊IRF1氨基酸序列与山羊的完全一致。系统进化树分析可见,哺乳类、鸟类、鱼类的IRF1处于不同分支。
在成功克隆绵羊IRF1 后,构建IRF1真核表达载体,转染哺乳动物细胞,初步探索IRF1蛋白特性。绵羊IRF1真核表达结果显示,IRF1蛋白显示分子量不同的两个条带,推测较大的条带是磷酸化的IRF1,这一结果与绵羊IRF1磷酸化预测结果相吻合,即在绵羊IRF1蛋白上预测到较多的磷酸化位点。另外,IRF1作为一种核转录因子,一般要经过磷酸化修饰后进入细胞核发挥功能。因此,本研究构建的绵羊IRF1真核表达质粒,可用于后续关于绵羊IRF1功能的研究。
IRF1在宿主抵御病原体方面发挥着重要作用。分支杆菌感染巨噬细胞可刺激IRF1表达,IRF1又激活下游免疫应答基因发挥抗分支杆菌的作用[13]。研究表明,猪繁殖与呼吸综合征病毒感染通过上调IRF1表达激活TNF-α启动子,从而促进猪肺部TNF-α高水平转录[14-15]。此外,肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)也可参与诱导IRF1和IFN-β的表达增加[16]。值得注意的是,MO感染绵羊诱导产生高水平的TNF-α,绵羊肺部IRF1上调表达[9]。那么,在MO感染中绵羊IRF1是否能激活TNF-α启动子促进其转录,需要进一步研究。
本研究克隆、分析了绵羊IRF1基因,并构建了绵羊IRF1真核表达载体,成功表达出了绵羊IRF1的重组蛋白,为探究MO感染中绵羊IRF1功能提供了材料。
