聚乙烯亚胺顺铂高分子偶联物的制备与表征
2022-10-12贾舟延贾奕扬宦梦蕾侯丽爽周四元张邦乐
贾舟延,贾奕扬,王 伟,宦梦蕾,侯丽爽,周四元,张邦乐
(空军军医大学药学系药剂学与药事管理学教研室,陕西 西安 710032)
顺铂作为重要的抗肿瘤生物烷化剂,对大多数实体肿瘤都有很好的临床治疗效果,其主要是通过进入细胞核与嘌呤碱基发生作用,从而损伤DNA导致肿瘤细胞凋亡[1-2]。但临床应用发现顺铂的肾、肝和胃肠道毒性较强[3],因此,化学家和药学家们对顺铂进行了药物负载与高分子偶联相关的新制剂研究工作[4-9]。上述研究在一定程度上提高了顺铂的治疗效果并降低了毒副作用,但大多载体对顺铂的载药率较低[7-9],导致其临床应用受限。
聚乙烯亚胺(polyethyleneimine,PEI),尤其是支化聚乙烯亚胺(branched polyethyleneimine,BPEI),富含大量的游离伯胺基团,作为载体在基因治疗和化学药物递送系统构建中发挥着重要的作用[10]。BPEI结构简单,富含的伯胺基团易于进行化学修饰,如果在BPEI表面偶联负载药物,可以很好地实现药物的负载和有效递送。
本文在分析顺铂类生物烷化剂应用现状的基础上,以BPEI为骨架,利用其富含的大量活泼氨基,将其与叶酸(folic acid,FA)连接在一起,利用FA受体在肿瘤细胞表面的高表达特性[11-13]以实现肿瘤细胞的特异性靶向治疗,制备得到具有肿瘤靶向的BPEI顺铂高分子偶联物(FA-BPEI-SS-Pt),从而实现顺铂的高负载化和靶向递送,提高其抗肿瘤效果,为顺铂类抗肿瘤生物烷化剂的临床应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验仪器 85-2恒温磁力搅拌器(巩义市英峪予华仪器厂);LABOROTA400旋转蒸发仪(德国Heidolph公司);AL104电子天平(瑞士Mettler Toledo公司);YE6K792096移液枪(德国Eppendorf 公司);ZMQS50F01 Milli-Q纯水机(法国Milli Pore公司);KH-300B超声清洗器(昆山禾创超声仪器有限公司);FD5-series冷冻干燥机(美国GOLD SIM公司);透析袋(截留Mr 100、1 000和7 000)(西安科昊生物工程有限公司);Thermofisher X2电感耦合等离子体质谱仪(美国Thermofisher X2公司);FTIR-8400S红外光谱测量仪(瑞士万通公司);AC200核磁共振仪(美国Varian公司);BIO-RAD酶联免疫检测仪(上海伯乐生命医学产品有限公司);BSC-1300ⅡA2生物安全柜(北京科伟永兴仪器有限公司);BIOFIL 96孔板(广州杰特生物有限公司)。
1.1.2 实验试剂 998 g/L顺铂、998 g/L硝酸银、990 g/L胱胺二盐酸盐购自上海萨恩化学技术有限公司;990 g/L FA购自上海安耐吉化学公司;990 mL/L三乙胺购自广东光华科技股份有限公司;990 g/L丁二酸酐购自上海国药集团化学试剂有限公司;995 mL/L 1,4-二氧六环购自天津市福晨化学试剂厂;990 g/L BPEI购自美国Sigma-Aldrich公司;990 g/L 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐、995 g/L N-羟基琥珀酰亚胺购自上海麦克林生化科技有限公司;998 mL/L甲醇购自天津高宇精细化工有限公司;995 g/L N,N′-羰基二咪唑购自美国Sun Chemical公司;2.5 g/L EDTA- 胰蛋白酶、青链霉素溶液(100X)购自北京索来宝生物科技有限公司;RPMI 1640培养基购自美国HyClone公司;胎牛血清购自上海依科赛生物科技有限公司;PBS粉末、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、二甲基亚砜(dimethyl sulfoxide,DMSO)均购自西安科昊生物工程有限公司。
1.1.3 实验细胞 人非小细胞肺癌细胞系A549由中国科学院细胞库提供。
1.2 方法
1.2.1 顺铂配合物的合成 水化顺铂的合成参照文献[14]的方法进行。将675 mg(2.23 mmol)顺铂加入225 mL Ⅲ级净化的超纯水中,在37 ℃避光条件下搅拌至完全溶解,然后冷却至室温。再加入758 mg(4.45 mmol)硝酸银,于室温下继续避光搅拌48 h,5 000 r/min离心30 min,重复2次后,用水系滤器(0.1 μm)对上述所得上清液进行过滤,制备得到水化顺铂溶液,避光保存备用。
在室温条件下,将499 mg(2.18 mmol)胱胺二盐酸盐溶解于25 mL甲醇中。冰浴冷却后,向上述溶液中加入446 mg(4.36 mmol)三乙胺并搅拌30 min。称取丁二酸酐202 mg(1.98 mmol)溶解于37 mL无水1,4-二氧六环中,将其慢慢滴入胱胺-甲醇溶液中,滴加时间30 min。滴加完毕后升温至室温,继续搅拌1.5 h。将反应液在旋转蒸发仪上减压蒸馏。除去有机溶剂后,加入77 mL 3 mg/L的Na2CO3溶液。用50 mL乙醚洗涤3次,收集水相,旋转蒸发除去残留的乙醚,得到丁二酸-胱胺连接物水溶液[15]。
将上述所得丁二酸-胱胺连接物水溶液于室温下缓慢滴加到200 mL的水化顺铂水溶液中,隔绝氧气条件下避光反应,48 h后将反应液减压浓缩到约10 mL后,移至透析袋中(截留Mr 100),用2 000 mL 超纯水透析3次,每2 h 换水1次,透析完成后冷冻干燥,得黄色粉末状顺铂配合物583 mg,收率为61.2%,熔点31 ℃。
1.2.2 FA修饰BPEI的合成 将100 mg(0.45 mmol)FA溶解于10 mL DMSO中,加入130 mg(0.68 mmol)1-乙基-(3- 二甲基氨基丙基)碳二亚胺盐酸盐和73 mg(0.68 mmol)N-羟基琥珀酰亚胺,于室温下搅拌4 h。500 mg BPEI溶于10 mL的DMSO中。将FA溶液缓慢滴入BPEI溶液中,滴加10 min,室温搅拌继续反应20 h。反应结束后,将其转移至透析袋(截留Mr 1 000)中,于2 000 mL 0.1 mol/L的碳酸钠-碳酸氢钠(1∶1)溶液中透析8次,每6 h换水1次。然后将其转移至2 000 mL纯水中,每6 h换水1次,在同样条件下透析4次。透析完成后冷冻干燥,得FA修饰的BPEI 432 mg,收率为72.1%。
1.2.3 FA-BPEI-SS-Pt的合成 将58 mg FA修饰的BPEI加入5 mL的60 ℃超纯水中,超声条件下使其完全溶解。称取85 mg(157 μmol)顺铂配合物加入10 mL的超纯水中,室温搅拌溶解,制得顺铂配合物水溶液,将其冰浴冷却后加入28 mg(174 μmol)羰基二咪唑,搅拌1 h后移去冰浴,升温至室温后,加入FA修饰的BPEI水溶液,于避光条件下继续室温搅拌24 h。将上述反应混合液转移至透析袋(截留Mr 7 000)中,用2 000 mL的超纯水透析4次,间隔2 h换水1次。透析后冷冻干燥,得FA-BPEI-SS-Pt 101 mg,收率为78.1%。
1.2.4 FA-BPEI-SS-Pt的靶向性研究 使用含有2 g/L FA的RPMI 1640培养液将A549细胞提前孵育2 h后,加入铂(Pt)浓度分别为0、1、4、16 mg/L的FA-BPEI-SS-Pt,以未加入2 g/L FA的RPMI 1640培养液作为对照组。再加入含100 mL/L血清的RPMI 1640细胞培养基使每孔体积至200 μL,继续孵育48 h。孵育结束后,每孔加入20 μL 5 g/L的MTT溶液(PBS配制),孵育4 h后终止培养,吸除孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,测定每孔A492 nm值,并计算细胞存活率:细胞存活率=[(实验组A492 nm值-溶媒背底A492 nm值)/(空白对照组A492 nm值-溶媒背底A492 nm值)]×100%。
1.2.5 FA-BPEI-SS-Pt的抗肿瘤活性评价 采用MTT法测定FA-BPEI-SS-Pt的抗肿瘤活性。取对数生长期的A549细胞,用含100 mL/L胎牛血清的RPMI 1640培养基配置成5×104个/mL的细胞悬液,取200 μL细胞液接种于96孔板。在37 ℃, 50 mL/L CO2的培养箱中孵育24 h 后,将FA-BPEI-SS-Pt和BPEI-SS-Pt均按照Pt浓度分别为0、1、2、4、8、16 mg/L进行给药,并设置复孔。用RPMI 1640培养液进行逐级稀释,每孔100 μL。给药完成后,再加入含100 mL/L胎牛血清的RPMI 1640培养基100 μL,对照组加入200 μL含100 mL/L胎牛血清的RPMI 1640培养基,孵箱中孵育48 h。孵育结束后,每孔加入20 μL 5 g/L的MTT溶液(PBS配制),孵育4 h后终止培养,吸除孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,测定每孔A492 nm值,并计算细胞存活率:细胞存活率=[(实验组A492 nm值-溶媒背底A492 nm值)/(空白对照组A492 nm值-溶媒背底A492 nm值)]×100%。
1.2.6 统计学分析 所有统计数据以¯x±s表示,各组实验数据通过GraphPad Prism 9.0软件进行相关统计分析,各组间指标比较采用多组间单因素方差分析,当组间比较有统计学差异时,采用LSD-t检验对特定的两组之间进行检验。P<0.05表示差异有统计学意义。
2 结果
2.1 顺铂配合物的合成与表征
在将丁二酸-胱胺连接物水溶液缓慢滴加到水化顺铂溶液中时,要注意避光隔绝空气来防止Pt2+的氧化,并且要用滴液漏斗缓慢地滴加,滴加时间应不少于30 min。顺铂配合物的红外吸收光谱(infrared absorption spectrum,IR)和核磁共振氢谱(hydrogen nuclear magnetic resonance spectroscopy,1H NMR)具体解析结果如下:IR(KBr压片)的波长为3 387、2 943、1 636、1 543、1 396、1 049、636 cm-1;1H NMR (D2O,400 MHz,ppm)的化学位移为3.52(t,2H,J=6.4 Hz),3.23~3.17(m,2H),2.85(t,2H,J=6.4 Hz),2.48~2.46(m,6H)。
经IR和1H NMR鉴定,所得产物与目标物的化学结构一致,可用于后续的合成反应。
2.2 FA修饰BPEI的合成与表征
在实验过程中,活化FA的羧基基团时,选用DMSO为溶剂使FA充分溶解与活化。FA与BPEI反应后将所得产物纯化时,采用碳酸钠-碳酸氢钠(1∶1)混合溶液为透析液使FA成盐,增加其水溶性并充分透析,保证了未反应FA的去除。IR和1H NMR的具体解析结果如下:IR(KBr压片)的波长为3 292、2 941、2 825、1 652、1 506、1 471、1 299、1 103、814、768 cm-1;1H NMR(DMSO-D6,400 MHz,ppm)的化学位移为8.64(s,1H),8.00(s,2H),6.66(s,2H),5.33(s,1H),3.52~3.38(m,378H),2.34(m,2H),2.15~1.97(m,4H);元素分析为C 46.72%,H 8.72%,N 22.90%。
经IR和1H NMR鉴定,FA连接于BPEI高分子材料上。由元素分析测定结果可知,FA修饰BPEI中FA的接枝率(m/m)为0.096。
2.3 FA-BPEI-SS-Pt的合成与表征
FA-BPEI-SS-Pt的IR和1H NMR具体解析结果如下:IR(KBr压片)的波长为3 271、2 835、2 827、1 645、1 606、1 506、1 472、1 394、1 045、814、766 cm-1;1H NMR(CDCl3,400 MHz,ppm)的化学位移为8.40(s,1H),8.15(s,2H),7.64(s,2H),6.68(s,1H),3.50~3.31(m,404H),3.23~3.17(m,26H),2.74(t,26H,J=6.0 Hz),2.38~2.29(m,78H),2.24(m,2H),2.15~2.12(m,4H);元素分析为C 32.51%,H 6.43%,N 14.37%。
经IR和1H NMR鉴定,顺铂配合物与FA修饰BPEI连接成功,形成FA-BPEI-SS-Pt。FA-BPEI-SS-Pt中顺铂的负载量通过电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry, ICP-MS)进行测定,所建立Pt的ICP-MS标准曲线为y=0.978x+1.508 9(R2=0.998 9),FA-BPEI-SS-Pt中负载顺铂的量为(34.66±0.11)%,远高于文献[4,7-9]报道的6.67%~15.21%,实现了顺铂的高负载化。
2.4 FA-BPEI-SS-Pt的靶向性研究
为进一步验证FA基团的引入对顺铂抗肿瘤活性的影响,采用加入FA的竞争性实验对其肿瘤靶向性进行了研究。实验结果(图1)表明,加入FA(孵育浓度为2 g/L)竞争肿瘤细胞表面FA受体时,并不会对细胞生长产生抑制或促进作用(Pt浓度为 0 mg/L),所选FA浓度不影响实验结果的判定。相比于未加入FA提前孵育组,Pt浓度为1、4、16 mg/L的各浓度组中加入FA提前孵育时的细胞存活率均增高,抗肿瘤活性明显减弱,这与加入底物FA后可抑制肿瘤细胞表面FA受体介导的入胞[11-13]、竞争性减弱FA-BPEI-SS-Pt的靶向作用、对肿瘤细胞的杀伤作用降低有关。
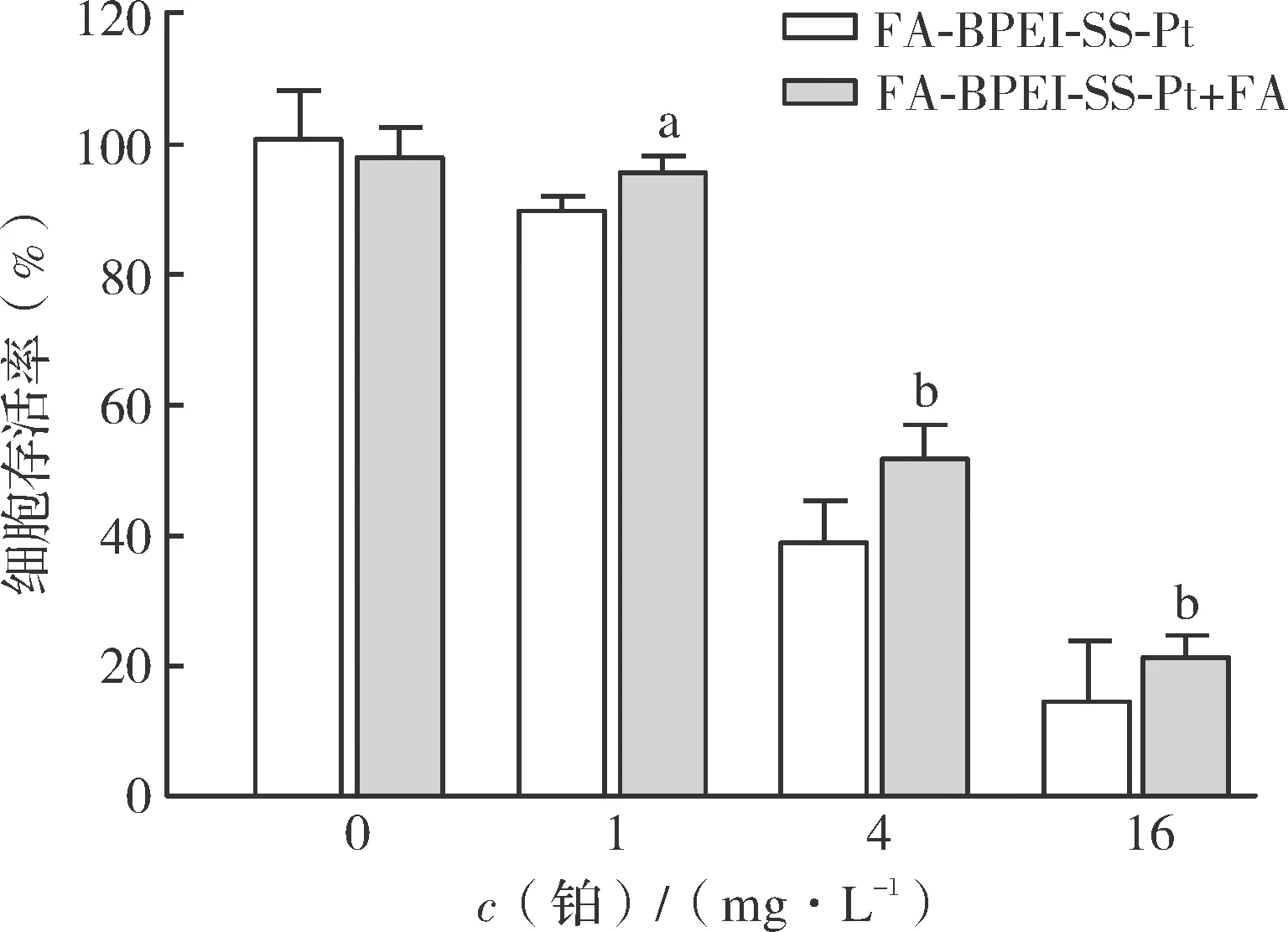
FA-BPEI-SS-Pt:FA修饰顺铂高分子偶联物组;FA-BPEI-SS-Pt+FA:加入FA提前孵育的FA修饰顺铂高分子偶联物组。FA:叶酸;BPEI:支化聚乙烯亚胺。 vs FA-BPEI-SS-Pt。图1 加入FA对FA-BPEI-SS-Pt的抗肿瘤活性的影响
2.5 FA-BPEI-SS-Pt的抗肿瘤活性评价
采用MTT法在A549细胞上对FA-BPEI-SS-Pt的抗肿瘤活性进行评价。溶媒以及BPEI-SS-Pt作为对照。研究结果表明,BPEI-SS-Pt和FA-BPEI-SS-Pt均具有较好的抗肿瘤活性,随着Pt浓度的升高,细胞存活率逐渐降低,呈明显的剂量依赖关系(图2)。经Graphpad Prism 9.0软件计算得出,BPEI-SS-Pt的IC50值为3.12 mg/L,FA-BPEI-SS-Pt的IC50值为2.91 mg/L。由于FA靶向基团的引入, FA-BPEI-SS-Pt的抗肿瘤作用增强,测试剂量下效果均优于BPEI-SS-Pt(P<0.01)。

Control:不加药物组;BPEI-SS-Pt:顺铂高分子偶联物组;FA-BPEI-SS-Pt:FA修饰的顺铂高分子偶联物组。FA:叶酸;BPEI:支化聚乙烯亚胺。图2 BPEI-SS-Pt和FA-BPEI-SS-Pt抗肿瘤活性测定结果
3 讨论
本文以顺铂、BPEI和FA为原料,设计合成得到以FA为肿瘤靶向基团的基于BPEI的FA-BPEI-SS-Pt。所设计路线操作简便,反应条件温和,制备得到的产物及其中间体的结构经IR、1H NMR和元素分析等鉴定,与所设计的目标分子结构一致。进一步研究表明,富含大量活泼氨基BPEI骨架材料的应用和FA肿瘤靶向基团的引入实现了顺铂的高负载化和FA介导的靶向递送,提高了其抗肿瘤效果,为顺铂类抗肿瘤生物烷化剂的新制剂研发奠定了基础。
