海南省药品上市许可持有人药物警戒体系现状及改进研究*
2022-10-12苗会青林丽君
苗会青,林 凯,林丽君
(1.海南省药品不良反应监测中心,海南 海口 570216;2.海南省海口市药品不良反应监测中心,海南 海口 570311)
2019年新修订的《药品管理法》,首次从法律层面提出“国家建立药物警戒制度”[1]。2021年12月1日我国开始实施《药物警戒质量管理规范》(GVP)[2],药品监管自此实现了从“药品不良反应(ADR)报告与监测制度”到“药物警戒制度”的跨越,意味着我国药品监管逐步迈向法治化、国际化、科学化。药物警戒与ADR不仅是名称上的不同,其范围、侧重点也存在较大差异。药物警戒的范围不仅包括ADR,还涉及用药错误、假冒伪劣药品、药物效力缺失、药物滥用和药物间相互作用等[3]。药物警戒是贯穿药品全生命周期的活动[4],风险管理是药物警戒活动中的关键和重点[5]。药品上市许可持有人(MAH)作为药物警戒责任的主体,也将面临巨大的挑战。ADR检查数据是评估MAH开展药物警戒活动主体责任有效落实的重要依据,也直接反映了其药品风险防控能力的高低。本研究中基于2019年至2021年海南省ADR检查数据,按照《海南省药品不良反应报告和监测检查要点》及当前药品安全性监测法律法规要求,分析在MAH药物警戒体系建设方面存在的问题,并提出相应的改进建议,为药物警戒在我国的实践及发展提供参考。现报道如下。
1 资料与方法
2015年,海南省在原国家食品药品监督管理总局发布的《药品不良反应报告与监测检查指南(试行)》基础上,制定了符合自身特点的《海南省药品不良反应报告和监测检查要点》,包括组织机构、人员管理、质量管理体系、个例ADR报告、药品群体不良事件报告、境外发生的严重ADR报告、定期安全性更新报告、评价及控制9大项(图4中以大项1~大项9指代)、38个内容、91项要点。2019年至2021年,海南省依照《海南省药品不良反应报告和监测检查要点》对84家次7 644个项目MAH开展ADR专项检查。对其在检查中出现的缺陷项从不符合项分布、具体问题等内容进行统计分析,采用Excel 2019版软件进行统计与分析。
2 结果
2.1 MAH基本情况
按《关于印发中小企业划型标准规定的通知》[6]中“工业行业”的划分标准,从业人员1 000人以下或营业收入4亿元以下的为中小微型企业(反之为大型企业)。其中,从业人员300人及以上(但少于1 000人),且营业收入2 000万元及以上(但低于4亿元)的为中型企业;从业人员20人及以上(但少于300人),且营业收入300万元及以上(但低于2 000万元)的为小型企业;从业人员20人以下或营业收入300万元以下的为微型企业。2019年至2021年,海南省ADR专项检查的84家次MAH以内资企业为主(85.71%),企业规模以中、小型为主(91.67%),集团公司性质以非集团和集团子公司为主(90.47%),开展药物警戒工作方式以MAH自己开展为主(95.24%)。详见图1。可见,内资企业、大中小型企业、集团或非集团企业等各类MAH均能通过MAH自己开展药物警戒,满足工作要求。

图1 MAH类型及委托开展药物警戒情况Fig.1 MAH types and commissioned pharmacovigilance
2.2 总体检查情况
MAH不符合项分布:2019年至2021年检查的84家次MAH中,仅1家次未发现不符合项目;MAH不符合项数量主要分布在1~5条(36家次,42.86%),6~10条(22家次,26.19%),11~15条(13家次,15.48%)。按企业规模统计,小型企业中11~15条、16~20条和20条以上不符合项的企业比例偏高(共占48.84%,占全部MAH的25.00%),明显高于中型企业;按企业类型统计,内资企业和外资/中资企业各不符合项分布差异不明显;按集团公司性质统计,非集团公司中11~15条、16~20条和20条以上不符合项的企业比例偏高(共占36.17%,占全部MAH的20.24%)。详见图2。

图2 MAH不符合项分布情况Fig.2 Distribution of MAH NCR items
不符合项具体问题分析:9个方面检查要点的7 644条检查项目中,84家次MAH共发现不符合项700条,平均每家MAH 8.3条,主要集中在质量管理体系、人员管理、组织机构3方面,(共占不符合项的71.14%)。详见表1(其中该大项不符合项数占全部不符合项数的比例为占比1,占本项检查项目数的比例为占比2)。不符合项中,MAH未制订个例ADR报告处理程序、工作考核程序及监督程序、ADR监测部门工作人员培训计划,未设立药品安全委员会等问题较突出。详见表2。
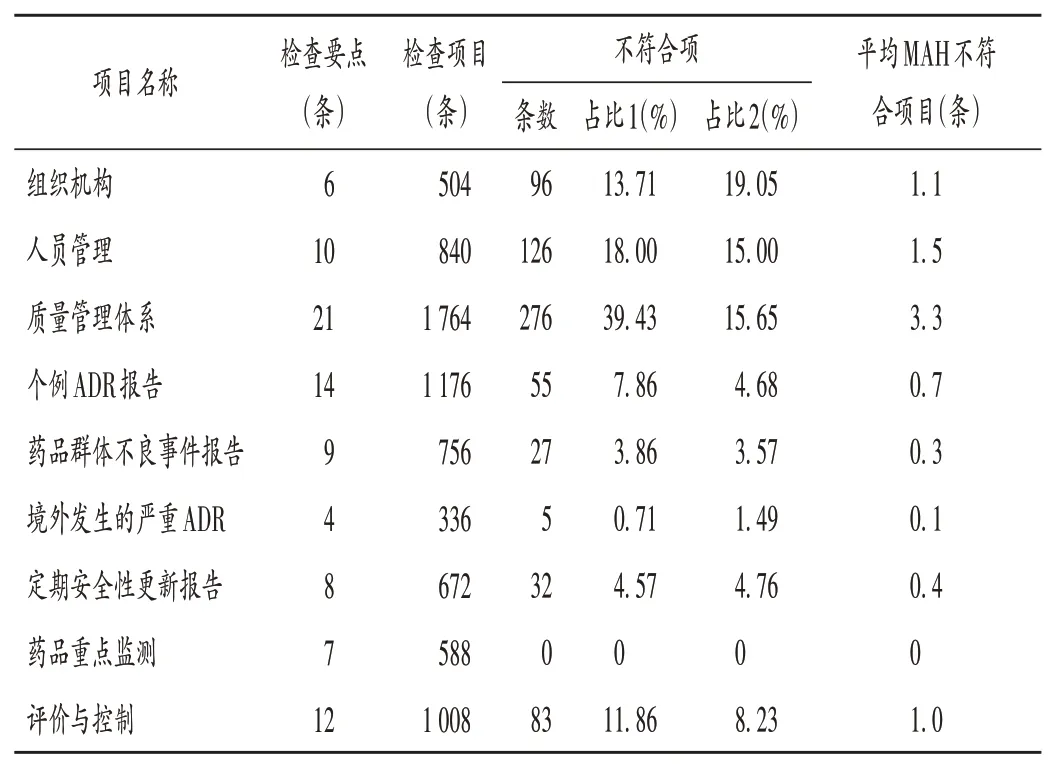
表1 2019年至2021年ADR检查不符合项情况Tab.1 NCR items of ADR inspection from 2019 to 2021

表2 2019年至2021年ADR检查不符合项具体内容Tab.2 The details of NCR items of ADR inspection from 2019 to 2021
2.3 年度检查结果比较
结果见图3和图4。由图3可见,2019年至2021年MAH不符合项总体呈降低趋势。2021年还出现了1家未出现不符合项的MAH,其余MAH不符合项集中在5项及以下,6项以上不符合项的MAH的比例越来越少。由图4可见,组织机构方面,不符合项占总缺陷项比例,从2019年的23.74%降至2020年的10.84%,到2021年比例略有上升,达11.24%;人员管理方面,在2020年升至18.89%,到2021年降至16.87%,基本与2019年持平;质量管理体系方面,从2019年的46.04%降至2021年的34.54%;个例ADR报告方面,呈先增加后减少的趋势,以2019年最低;药品群体不良事件报告与境外发生的严重ADR报告方面,均从2020年开始检查出问题,不符合项占比呈现随年度增加而增加的趋势,尤其是药品群体不良事件报告,占比从2020年的3.41%升至2021年的10.84%;定期安全性更新报告方面,先从2019年的2.88%升至2020年的5.57%,2021年又降至4.02%;评价与控制方面,占比不断升高,从2019年的5.04%升至2021年的13.65%,且其增长率在2020年最高。
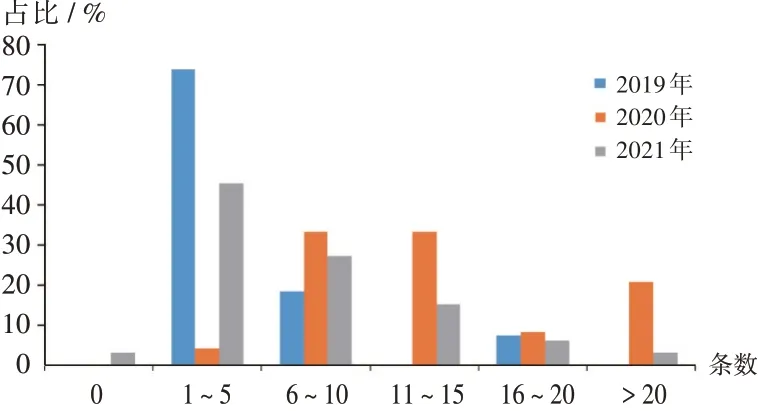
图3 2019年至2021年ADR检查MAH不符合项分布情况Fig.3 Distribution of MAH NCR items of ADR inspection from 2019 to 2021
3 问题及原因分析
3.1 MAH药物警戒体系构建尚不完善
MAH不符合项数主要集中在1~5条及6~10条;小型企业和非集团企业不符合项偏多,内资企业和外资/中资企业各不符合项分布差异不明显。不符合项数排名前3的大项依次为质量管理体系、人员管理、组织机构,此3项中不符合项占各自检查项目数的比例也位列前3,具体问题较多,表明上述3方面是MHA在执行ADR监测不达标的“重灾区”,也是MHA下一步贯彻、落实GVP时需要重视与重点改进的内容。可见,海南省MAH药物警戒体系虽初步成型,但体系建设能力参差不齐,且运行情况不均衡。
其主要原因为:1)MAH重视度较低,体系建设不完善或形同虚设,具体表现为未制订个例ADR报告处理、考核等相关程序或内容不完善等问题;2)组织机构不健全,具体表现为未设立药品安全委员会或明确职责等相关问题;3)不注重人员能力提升,具体表现为无人员培训计划或未开展人员培训等问题;4)体系运行不规范,具体表现为定期安全更新报告(PSUR)提交前未进行质量审核等问题。
3.2 MAH对ADR监测报告的重视力度不足
总体检查结果显示,虽然个例ADR报告、药品群体不良事件报告、境外发生的严重ADR报告3个方面在总体检查结果中占比较低,但在年度检查结果比较中发现,个例ADR报告不符合项占总缺陷项比例呈先升高后降低的趋势,但2021年的比例高于2019年,表明2019年至2020年MAH的ADR报告问题一直存在,且上报质量较低,MAH需加强该方面的人员培训。药品群体不良事件报告、境外发生的严重ADR报告在2019年未发现不符合项,从2020年开始,这两方面的不符合项占总缺陷项比例逐年上升,可能是因为MAH自主收集报告数量少。2019年至2021年,海南省MAH直报系统ADR数据结果显示,虽然近3年MAH报告ADR数量逐年增加,但98%以上的报告源于国家药品不良反应监测中心反馈。自主收集报告占比较低,且在ADR检查发现的不符合项中,个例ADR报告问题项占总不符合项比例也较低(<10%)。
MAH的ADR报告质量不高主要原因可能有:1)直报主动性不强,ADR数据依赖于国家药品不良反应监测中心反馈。陈孟基等[7]研究发现,MAH上报ADR工作中存在主体意识薄弱、刻意忽视ADR、不主动上报等问题。2)担忧心理主导,没有正确认识药品固有风险,将ADR与药品质量挂钩。3)报告途径不畅通,未建立与医师、药师、患者等有效的药品安全信息收集途径。
3.3 MAH风险评价与控制能力较弱
MAH的药物警戒风险管理主要从药品安全性研究、ADR数据信号检测及识别、风险计划的制订及风险沟通能力等方面进行评估。2019年至2021年,ADR检查的700条不符合项中,评价与控制不符合项占比相对较高(占总体的11.86%)。年度分析结果也显示,评价与控制方面的不符合项占比近3年来不断上升。
出现上述情况的原因主要是我国对风险评价与控制的认识不断加强。此外,GVP发布前,我国在药品风险评价与风险控制方面对MAH的监管及检查要点等指南较少,在客观上导致包括海南省在内的全国所有MAH对药品风险防控意识较薄弱;对于如何实施药物警戒风险防控,部分持有人的理念未转变,还停留在只要做好“上市后合格药品”层面监测的理念中,未正确认识药物警戒对于风险评价与控制能力的新要求。GVP正式实施后,《海南省药品不良反应报告和监测检查要点》已于2022年6月废止,随之发布实施了《海南省药物警戒检查要点(试行)》,海南省将根据新的检查指南制订出相应的检查要点,以适应GVP的要求,但所有的法律法规均有一定延续性和继承性,MAH如何借鉴以往检查中发现的缺陷内容,不断规范自身质量管理体系以满足GVP的要求,对海南省甚至全国的MAH都有着重要的参考价值。
4 对策与建议
4.1 认清法治化监测形势,提升主体责任意识
《药品上市许可持有人直接报告不良反事宜的公告》《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《药品管理法》等法律法规及指导文件的相继出台,表明国家已从法律层面明确了MAH是药物警戒活动的责任主体,2021年5月国家药品监督管理局发布的GVP也对MAH药物警戒工作在我国的具体实践进行了指导及规范。
因此,MAH应进一步提高认识,正确认识ADR监测与药物警戒的不同,快速转变监测理念,消除报告主体的报告顾虑,通过强化顶层设计、明确分工,落实好从研发到上市贯穿于药品全生命周期各部门职责。此外,监管部门应加强药物警戒专项检查力度,对落实不到位的MAH严格按照相应法律法规进行处罚,全面推动MAH药物警戒主体责任的落实。
4.2 加强科学化体系建设,提升体系运行适宜性
目前,海南省MAH药物警戒体系运行的有效性及适宜性不高。在实际工作中,质量管理体系文件缺乏指导性,与实际工作严重脱节。GVP从质量管理、机构人员与资源、监测与报告、风险识别与评估、风险控制、临床试验期间药物警戒及文件、记录与数据管理等方面对MAH进行了规范,2022年2月国家药品不良反应监测中心印发了《药物警戒体系主文件撰写指南》,指导MAH创建和维护药物警戒体系主文件,确保药物警戒体系的合规性及药物警戒活动的有序开展。
因此,建议MAH:1)规范文件特别是药物警戒主文件的管理,定期评估其适宜性及有效性,如通过开展内审及重大风险应急演练等对现有制度及程序的实操性及可行性进行自评,并及时更新及维护。2)强化组织机构建设,特别是药品安全委员会的权威性,其委员除了具有医学、药学、统计学、流行病学等相关专业背景外,也应具备研发、生产、监测等实操经验。如在法国,任何销售供人使用的药物或产品的公司或组织都必须建立药物警戒部门,以确保收集、记录和科学评估可能与药物治疗相关的不良事件信息,从而预防或最大限度地降低任何风险[8]。而且,药物警戒部门由1名在药物警戒方面有经验的合格人员永久负责。3)注重人员资质审核及能力培养,药物警戒负责人须具备一定职务、专业背景、工作经历及药物警戒工作年限,以满足岗位工作需要,且药物警戒部门应配备足够数量并具有医学、药学、流行病学或相关专业背景的专职人员,定期接受相关培训。
4.3 探索多元化收集途径,提升药品安全性信息质量
《国家药品不良反应监测年度报告》(2020)显示,来自MAH的ADR报告仅占总体的3.9%[9]。但在欧美国家,MAH是ADR报告的主体,美国食品和药物管理局(FDA)的ADR报告90%来源于MAH[10]。美国法律规定,药品或生物制品生产者、分销和包装者均必须定期向FDA报告ADR[11]。日本报告主要来源于企业的ADR和感染报告、医务人员的药品/医疗器械安全性信息报告,其中约64%ADR报告来自制药企业[12]。因此,我国MAH应快速转变监测理念,报告的收集不仅限于“上市后合格药品”的ADR,还应涉及其他与用药有关的有害反应。国内国外的、上市后经验的、上市后临床研究、上市后流行病学或监测研究、科学文献报道的,以及未发表的科学论文中符合报告要求的不良事件都应报告[13]。
因此,建议MAH:1)建立面向药师、医师、患者的有效ADR信息收集途径,搭建好临床药师医护患沟通的桥梁,成为ADR监测的良好践行者[14]。2)深化医疗机构科研合作,如基于医院电子病历数据开展药品安全性评价或开展处方事件监测等。3)建立投诉机制及反馈机制,电话、邮箱、网站等方式主动向公众收集ADR与药品相关信息。4)主动、定期在中国知网、万方等相关网站开展文献检索。5)开发人性化简易化报告途径。如西班牙创建的门户网站(www.notificaRAM.es)可便于患者直接报告ADR[15];英国曾推送一款用于移动ADR报告的“黄卡应用”;而芬兰的患者可通过普通邮件进行报告[16]。
4.4 顺应国际化监管要求,提升药品风险评估与控制能力
无论是药品管理法还是GVP,均对MAH的自觉能动性提出了要求,均强调其应“主动”开展研究[17]。我国加入国际人用药品注册技术协调会(ICH)后,意味着MAH今后将逐步转化和实施国际最高技术标准和指南。ICH指导原则中药物警戒相关规定主要集中,在E2系列指导原则中,包括针对临床试验和上市后药物警戒的全过程[18]。
建议MAH尽快对标ICH标准,主动开展风险的监测、识别、评估与控制,推动药物警戒研究活动与国际接轨,并配备MedDRA医学词典,并采用个例安全性报告(ICSR)的电子提交标准进行报告传输;借鉴欧盟、日本等国际先进风险管理经验,积极开展风险沟通;强化MAH之间的学术交流合作,借助科研院与专业研究机构的力量,主动开展上市后药品风险品种安全性研究。
