我国改良型新药研发与注册政策分析及建议
2022-10-12宗云岗
宗云岗
(国家药品监督管理局南方医药经济研究所,广东 广州 510080)
药品创新赋予医药企业持之以恒的发展动力,其需要技术、人才、资金、政策以及时间的积累,多数跨国制药企业经历了简单仿制、高端品牌、改良型和自主创新等几个发展阶段。目前,随着药品产业标准统一和升级、技术升级、产业转型、产业升级和竞争加剧,药品创新难度越来越大,研发投入资金占比急剧攀升,中小型医药企业的发展压力与日俱增,全球药物研发思路从“群体治疗”向“精准治疗”转变[1]。改良型新药在原有药物基础上进行改进,具有更好的临床应用效果,且大部分产品无须进行完整临床试验,因此具有较大的市场竞争优势,其优越的投入产出比越来越受到广大医药企业的重视。在此,通过综合评估全球和我国改良型新药的政策与市场竞争发展态势,为我国医药创新发展提供有益的参考。
1 全球改良型新药发展的基本状况
1.1 研发经济性优越
与新化学实体和创新生物药[2]相比,改良型新药的研发时间约短67%,研发成本约低99%,研发成功率提高约23%(见表1),尤其在临床要求上,通过改良其结构、配方及工艺、给药途径及适应证,使其有效性、临床优势、安全性及患者依从性通常更佳,因此具有较大优势[3]。

表1 改良型新药与新化学实体和创新生物药的研发投入产出对比Tab.1 Comparison of R & D input-output between improved new drugs and new chemical entities/innovative biological drugs
1.2 研发审批数量较多
以美国为例,修订后的《联邦食品、药品和化妆品法案》(FD&C Act)505部分为新药申请提供了3条路径:505(b)(1),即新分子实体药(创新药);505(b)(2),即改良型新药,包括新适应证,新配方、新剂型、新给药途径、新给药方案等;505(j),即仿制药。由表2可见,近10年来,美国食品和药物管理局(FDA)批准的新药中505(b)(2)构成比超60%,在开发新靶点越来越难、仿制药竞争越来越大的情况下,改良型新药正在成为一个较优选择,逐渐成为研发主力[4]。
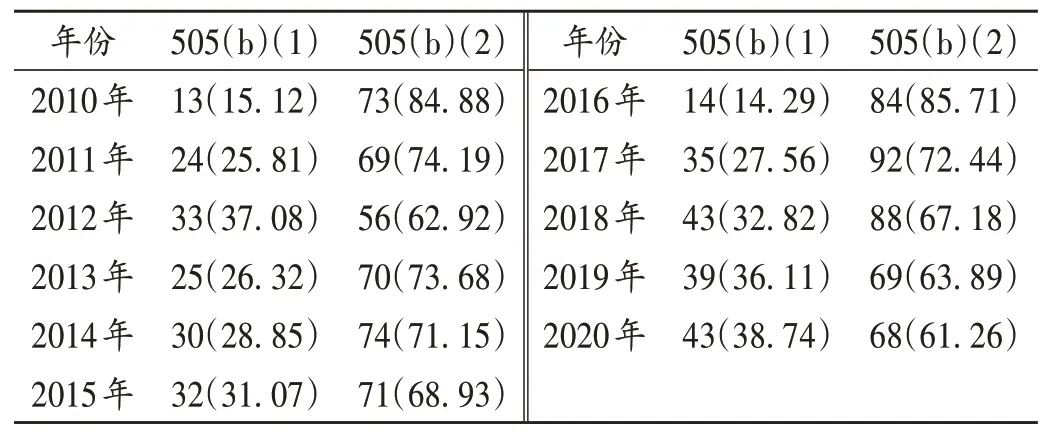
表2 2010年至2020年美国非仿制新药批准情况[个(%)]Tab.2 Application status of non-generic drug approvals in the United States from 2010 to 2020[n(%)]
1.3 临床优势明显
改良型新药是对已上市药品的升级改良,强调和注重临床“优效性”,不仅有助于提高药物临床效果,减少用药次数,增强患者的依从性,并且降低了药物的副作用,提高了安全性[5]。
1.4 发展潜力较大
随着世界经济发展、人口总量增长、人口老龄化程度提高、人们保健意识增强,以及全球医疗保障体制的不断完善,2021年全球新药市场销售额达9 616亿美元,同比增长8.0%。其中,改良型新药虽然销售比重偏小,但随着其性价比越来越受到青睐,市场发展潜力也将越来越大[6]。
2 我国改良型新药发展的基本状况
2.1 政策变化
众所周知,《药品注册管理办法》是我国药品注册管理的重要部门规章,在规范药品注册行为、引导药物研发、促进医药产业发展等方面发挥了重要作用,自2007年起其实施时间跨度已逾10年[7]。2015年,国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),深入推进药品注册分类改革工作。2017年,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[8],进一步强化药品注册分类相关制度。从2013年提出《药品注册管理办法》修正案小改,到2016年起草《药品注册管理办法(修订稿)》,调整为大改,其间经历了多次征求意见,直至2019年12月1日新修订的《药品管理法》实施,2020年7月1日新修订的《药品注册管理办法》实施[9],我国药品注册相关政策得以以法律法规的形式进一步固化和完善,药品注册管理形成相对完善的、以鼓励药品创新为主要特点的药品注册法规体系。相较于2007年版药品注册分类,新的化学药、中药和生物制品注册分类出现了新变化。对于改良型新药,主要表现为以下特点[10]。
进一步明确了市场地位:2016年起草的《药品注册管理办法(修订稿)》征求意见稿中,重新定义了新药及仿制药的概念,无论是化学药品,还是中药产品和生物制剂产品,均对改良型新药作出了理念相近的定义归类,给予其市场地位。
更加突出了临床优势:新版药品注册分类较大的一个特征是,改良型新药更加注重临床应用价值(见表3。表中2016年征求意见稿和2020年正式稿内容基本一致,与2007版相比有较大变化,相应条款不能完全对应,仅供参考)。化学药2.1类、2.2类、2.3类及生物制品2.1类均特别强调“具有明显临床优势”。因此,新剂型、新给药途径、新复方制剂、新适应证、新工艺成为改良型新药的主要研发方向。
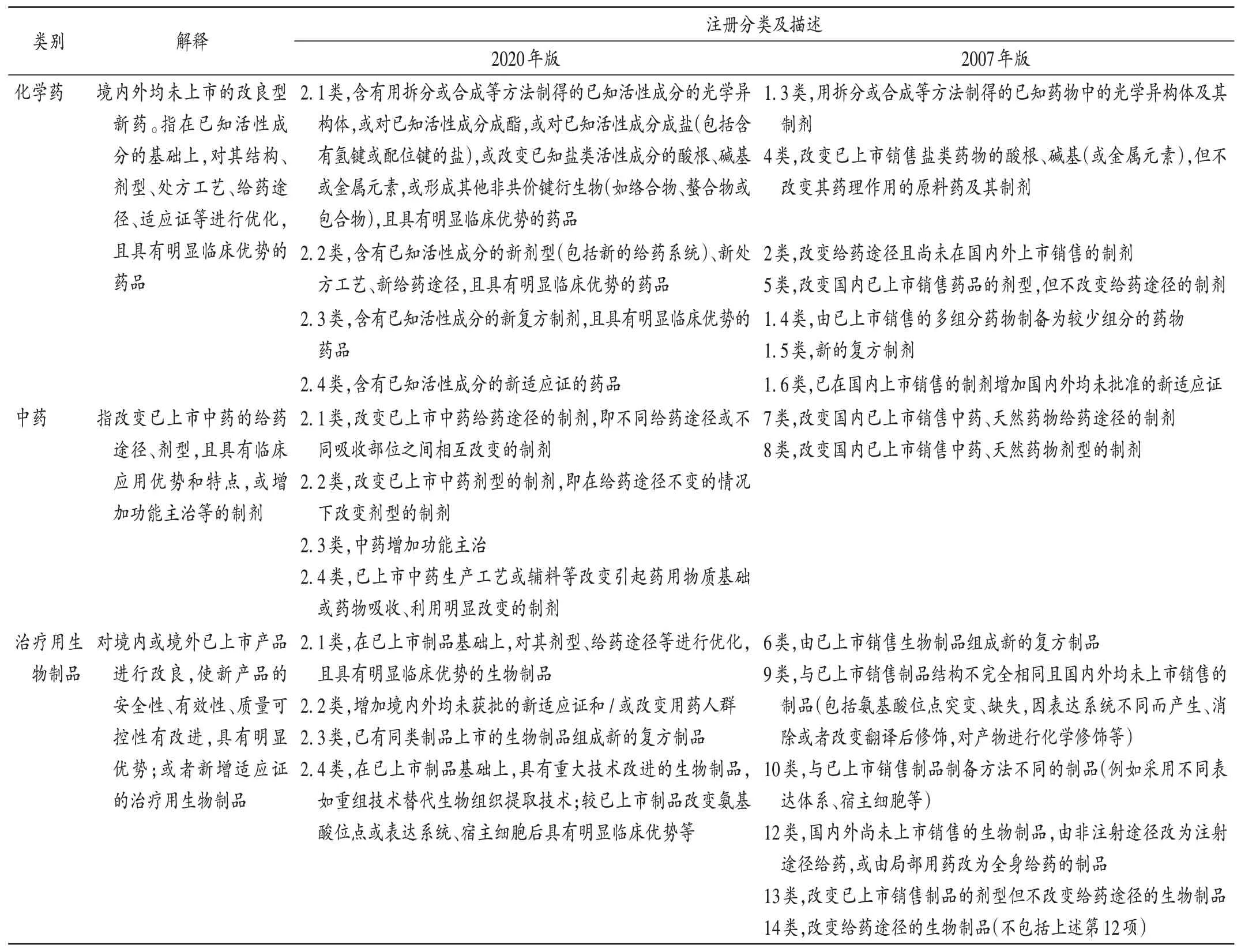
表3 2007年和2020年版《药品注册管理办法》改良型新药注册分类比较Tab.3 Comparison of the registration types of improved new drug in the 2007 edition and 2021 edition of Drug Registration Regulation
重新构建了医药企业转型赛道:相比于全新创新药的高研发难度,改良型新药具有成功率、回报、优效性高,风险低,生命周期长等优势,已成为全球新药研发的主流。在我国带量采购和鼓励药品创新等政策的影响下,改良型新药将持续被市场看好,有利于销售费用占比较高的制药公司转型为研发创新企业。
2.2 注册受理情况
受理号数量显著增加:自2016年改良型新药的定义发生变化以来,药品申报注册受理号数量开始呈较快速度的增长,2020年新版《药品注册管理办法》出台、实施前后,改良型新药注册受理号数量更是出现了较大幅度增长(见表4。注册分类按当年申报时分类定义,按注册受理号数量/件统计,表5同),表明随着药品注册政策利好,广大医药企业十分看重改良型新药的研发注册工作[11-20]。

表4 2012年至2021年改良型新药注册受理号数量统计(数量/增长率,件/%)Tab.4 Numbers of registration acceptance numbers of improved new drug from 2012 to 2021[number/growth rate(n/%)]
申请类型以申请临床为主:从近3年申请类型来看,无论是化学药品、治疗性生物制品,还是中成药改良型新药,申请临床的注册受理号数量均占60%~70%(见表5),表明在新政实施的政策利好形势下,医药企业对改良型新药的研发热情持续高涨。

表5 2019年至2021年改良型新药各类别申请类型构成比(%)Tab.5 Composition ratio of application types of improved new drugs by category from 2019 to 2021(%)
集中于抗肿瘤和免疫调节剂治疗领域:从近3年注册申报的品种来看,2019年涉及的品种为111个,2020年迅速增至209个,同比增长88.29%;2021年升至292个,同比增长39.71%(见表6,其中【化】指代学药类,【中】指中药类。注册分类按当年申报时分类定义,按注册品种数量统计,表7同)。从2021年排名领先的品种治疗领域来看,其与我国疾病谱的类型与变化相适应,符合当前改良型新药的主要研发方向。

表6 2019年至2021年改良型新药不同治疗领域申报品种数(个)Tab.6 Application numbers of improved new drugs in different therapy area from 2019 to 2021(n)
以注射剂型为主:从近3年注册申报的品种来看,常规剂型为主要剂型,且以注射剂、片剂、胶囊剂为主。而以新剂型为主的一些剂型如吸入剂、凝胶剂、喷雾剂、贴剂、膜剂等品种数量较少,表明对新剂型的开发力度和热度相对较低(见表7)。2022年5月9日国家药品监督管理局发布的《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》第28条表明,国家鼓励儿童用药品的研制和创新,支持药品上市许可持有人开发符合儿童生理特征的儿童用药品新品种、新剂型、新规格,对儿童用药品予以优先审评审批,并引入市场独占期政策。这为改良型新药研发中侧重儿童用药品新剂型的开发提供了更强的动力。
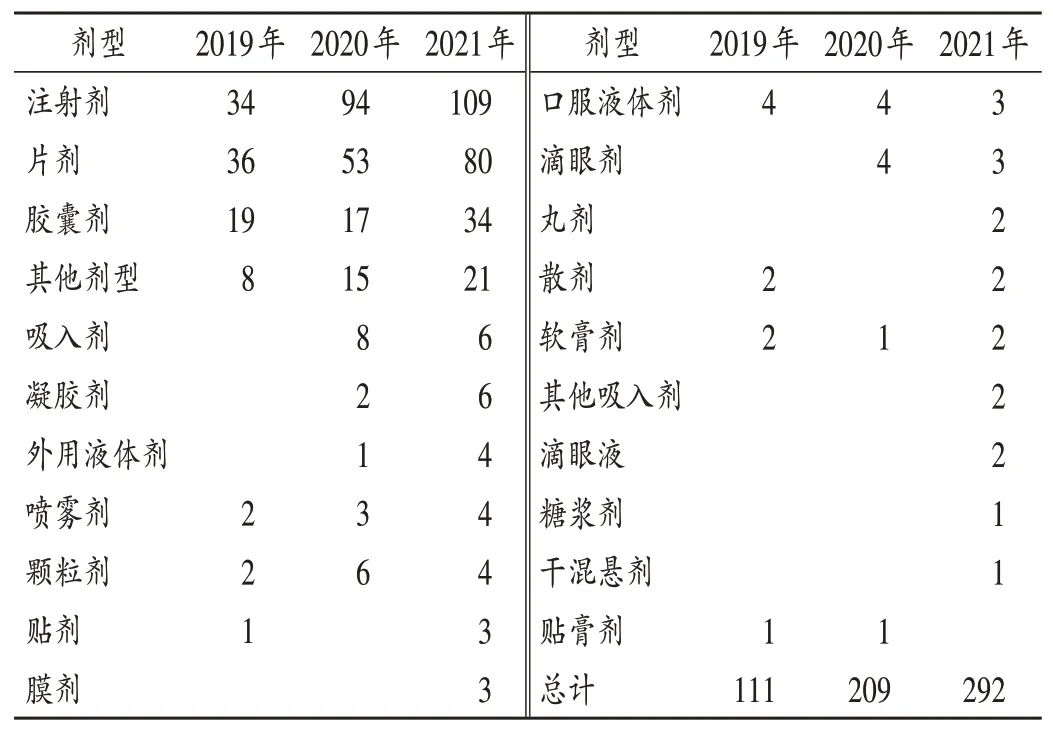
表7 2019年至2021年改良型新药各类剂型注册申报品种数量(个)Tab.7 Registration and application varieties of various dosageforms of improved new drugs from 2019 to 2021(n)
2.3 市场应用情况
近年来,随着国家药品注册制度的改革与优化政策引导,我国改良型新药市场发展势头强劲,具有较大的临床应用和市场发展潜力,并呈现以下特点。
“国内国外双驱并举”的竞争格局凸显:当前在我国改良型新药的注册审批申报环节中,集中分布了外资与国企两大企业群体且企业相对集中,其中外资企业包括罗氏制药、诺华制药、拜耳制药、强生制药、武田制药等,国企主要有恒瑞医药、正大天晴药业、齐鲁制药、江苏豪森制药等传统企业,以及百奥泰生物科技制药、上海复宏汉霖制药、信达生物制药等创新型企业。两大阵营的改良型新药研发已形成“双驱并举”的竞争局面。
上市品种销售呈快速增长势头:从2016年至2018年申请改良型新药注册并批准的部分产品的上市销售状况来看,其在医院市场的销售金额均呈快速增长趋势,部分增加适应证的产品在经历低增长期后又重现高增长态势;部分品种由于仿制产品的进入则显得增长乏力。
医保保障产品销售快速增长:同时也发现,从2016年至2018年申请改良型新药注册并批准的部分产品基本纳入了医保报销范畴,从而实现产品销售额的快速增长(见表8)。个别品种如糠酸氟替卡松维兰特罗粉吸入剂(Ⅱ)由于未进入医保,销售情况欠佳。

表8 2016年至2018年部分改良型新药市场销售额增长变化Tab.8 Growth of market sales of some improved new drugs from 2016 to 2018
3 我国改良型创新型新药的发展政策建议
当前,我国正处于从仿制药时代向科技创新含量更高的改良型新药、创新药转型的过渡期。在临床需求刺激改良型新药的开发应用,政策支持提高行业改良型新药的研发热情,新技术应用能更好地满足市场的差异化竞争需求三大因素促进下,我国改良型新药作为创新药的一个重要组成部分,市场发展前景良好,但同时也存在诸多影响因素制约改良型新药行业的市场发展速度和潜力。因此,我国改良型新药市场发展还需在“三医联动”机制下,通过加大国家产业政策扶持、药品审评审批机制引导、医保支付支持及医疗临床使用优先等措施,进一步激发和调动医药企业的研发热情。主要建议如下。
产业扶持政策方面:在国家创新机制方面出台相关鼓励和扶持政策[21],通过各地发展改革部门、工信部门、科技部门出台针对改良型新药的鼓励扶持措施,鼓励科技立项,激发研发热情,引导企业转型,营造创新氛围;鼓励和激励倾向于改良型新药“产、学、研、转、用”的研究与创新新模式,给予更强的药品知识产权保护力度,从而提高药品自主创新能力;建立多种形式的产业投融资和信贷渠道,如产业扶持基金、投资公司、私募基金等,以助力改良型新药的研发进程。
药监审评审批政策方面:进一步优化改良型新药的相关审评审批制度,优先纳入审评审批程序,出台针对性的指南建议,有利于改良型新药研发工作的开展[7];针对临床需要和市场需要的品类,如儿童用药的改良型新药的研发,进一步优化临床试验的相关政策,加快医药企业对儿童用药的研发进度;进一步优化中药改良型新药开发中针对中成药上市后二次开发中改工艺、增加适应证等方面的措施[22],鼓励药品上市许可持有人对已上市中药深入开展研究,优化生产工艺等,提高临床效果,进一步提升已上市中药的质量;增加改良型新药的市场独占保护期[23],进一步落实《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》第二十八条中针对儿童用药改良型的研发给予市场独占期的利好条款。
医保支付政策方面:将改良型新药及时纳入医保目录,保证患者能在最短时间内得到治疗,确保临床可及性;进一步优化改良型新药定价机制,给予医药企业一定的价格期限保护,促进医药企业在研发、转化、收益、再研发的轨道上良性循环。针对一些临床急需且为新剂型、新给药途径的改良型新药,在集中采购制度环节与其他产品能够有所区分,鼓励单独招标。
医疗临床使用政策政策方面:将改良型新药优先纳入临床用药指南,优先临床处方应用,提高其处方率,更多地惠及患者;完善改良型新药的临床试验政策,鼓励临床医师参与其中。
