马铃薯StNPR4基因的克隆与功能分析
2022-10-12李登高穆青慧张焱如
李登高 林 睿 穆青慧 周 娜 张焱如 白 薇
(内蒙古农业大学生命科学学院,呼和浩特 010018)
NPR1(non-expressor of pathogenesis-related genes 1)又称为NIM1或SAI1,最早被发现在植物的抗病防卫系统获得抗性(systemic acquired resistance,SAR)和诱导获得抗性(induced systemic resistance,ISR)中起重要作用,能够介导水杨酸(salicylic acid,SA)和茉莉酸/乙烯(jasmonic acid/ethylene,JA/ET)反应的交叉对话。NPR1 通常以寡聚体的形式存在于细胞质中,病原菌的侵染会使得植物体内SA含量升高,引起细胞内氧化还原状态发生改变,导致NPR1 解离成单体进入细胞核中,激活TGA转录因子,诱导(-)基因大量表达,启动防御反应。近些年的研究发现NPR1除了在响应生物胁迫方面发挥作用外,还参与了植物对非生物胁迫的响应,目前的研究表明NPR1在抵抗盐胁迫、氧化胁迫、干旱胁迫和低温胁迫的过程中也发挥重要作用。同时还有研究发现NPR1参与调控夜晚的生物钟基因(timing of CAB2 expression 1,TOC1)和早上的生物钟基因(late elongated hypocotyl,LHY)的表达,NPR1 通过调节抗病防御反应和昼夜节律中的互作,平衡植物在免疫反应和生长之间的物质及能量调度。
拟南芥()的NPR1 蛋白家族有6个成员,根据系统进化分析结果显示可分为3个分支,第1分支包含AtNPR1和AtNPR2;第2分支包含AtNPR3 和AtNPR4,第1 分支和第2 分支以正/负调控的方式在拟南芥抗病过程中发挥作用;第3 分支成员包括AtNPR5(又名AtBOP1)和AtNPR6(又名AtBOP2),参与控制叶和花生长发育的调控。NPR1 家族蛋白具有的典型结构域是2 个蛋白与蛋白互作结构域,BTB/POZ(Broad Complex,Tramtrack and Bric a brac/Pox virus and Zinc finger,BTB/POZ)结构域和锚蛋白重复序列(ankyrin repeats,ANK)。目前的研究认为AtNPR1 和AtNPR4 作为SA 的受体在植物免疫反应中发挥广泛作用。在其他植物中也有关于NPR1家族蛋白的鉴定挖掘和诱导表达研究。
马铃薯()是我国重要的主粮作物之一,由致病疫霉()导致的晚疫病及干旱、高温、低温和盐胁迫等非生物逆境导致的马铃薯减产是制约其产量的重要因素。因此,研究挖掘既能抗病又能抵抗非生物胁迫的基因,对马铃薯抗逆育种的研究具有重要的指导意义。本研究通过克隆马铃薯NPR1 家族蛋白中的成员之一的启动子和CDS 序列,进行生物信息学分析,研究其组织表达特异性,构建由其自身启动子驱动的双元表达载体,转化马铃薯获得转基因马铃薯,进一步研究其对SA、致病疫霉和高盐胁迫的响应,明确其在生物胁迫和非生物胁迫中发挥的功能。
1 材料与方法
1.1 材料
马铃薯双单倍体测序品种DM1-3516 R44 由美国农业部农业研究院(Argriculture Research Service of United States Department of Agriculture,USDA)提供,转化马铃薯所用品种底西芮由本试验室MS 培养基快繁保存,培养条件为16 h 光照24 ℃/8 h 黑暗20 ℃。马铃薯组织特异性研究所用品种为费乌瑞它,盆栽培养。致病疫霉HQK8-3由内蒙古农业大学刘惠荣教授提供。
1.2 方法
根据马铃薯数据库在线资源(http://solanaceae.plantbiology.msu.edu)下载马铃薯cDNA序列及基因组序列(Sequence ID:XM006366563)。在http://smart.embl-heidelberg.de 预 测 分 析StNPR4 蛋白质的二级结构及保守域。利用在线软件https://scansite4.mit.edu/4.0/#home 分析StNPR4 蛋白分子质量及其等电点信息。在MEGA 7.0 中使用NJ(Neighbor-Joining)方法进行Bootstrap,比对后的序列在http://www.phylogeny.fr 在线工具中获取保守序列,1 000 次重复检验,生成系统进化树。
在马铃薯盆栽苗开花期分别对根、茎、叶、花组织取样,液氮速冻,用Trizol 法提取RNA,用DNase(RNase free)去除DNA 并反转录成cDNA,反转录方法按照Tian 等的方法进行。以马铃薯的cDNA 设计上下游引物StNPR4q-F/R(ACTTCTTGAACACTGCATCC/CTAATGACTCCT -GTTCAGT),以基因为内参(ef1α-3ATTGGAAACGGATATGCTCCA/ef1α-4TCCTTACCTGAACGCCTGTCA),用qRT-PCR 方法分析马铃薯基因在不同组织的转录水平。组织特异性及所有的基因表达分析qRT-PCR 试验均在实时荧光定量PCR仪(LightCycler480,美国)进行。
将培养28 d的马铃薯DM试管苗用0.67 mmol·LBTH 处理8 h,提取RNA 反转录成cDNA。以cDNA 为模板PCR 克隆基因。PCR 反应条件:98 ℃5 min;94 ℃30 s,58 ℃30 s,72 ℃2 min,30 个循环;72 ℃延伸10 min,扩增产物经1%质量浓度的琼脂糖凝胶电泳检测,UVP 凝胶成像系统拍照。胶回收纯化目的条带,与pMD19-T载体用T4 DNA 连接酶在16 ℃下连接过夜,转化大肠杆菌DH5α 感受态细胞。经PCR 鉴定后筛选阳性克隆进行测序验证。
在马铃薯数据库(http://solanaceae.plantbiology.msu.edu)中BLAST 得到基因组序列,在起始密码子上游1 kB 处设计上游引物StproNPR4-F (TTCCGCGGACGCATATACTGTTTGGATGCACA)和下游引物StproNPR4-R(TTGGATCCTGGTGCAGGTGCATGTATCA),以基因组DNA 为模板进行PCR 扩增基因的启动子序列,PCR 反应体系条件及检测方法同上,利用酶切克隆的方式构建StproNPR4-NPR4-pOREO4 双元表达载体(见图1)。
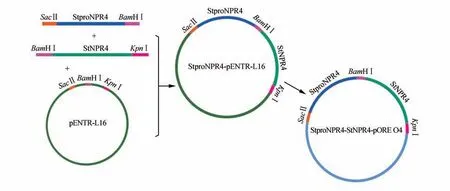
图1 StNPR4双元表达载体构建示意图Fig.1 Schematic diagram of construction for StNPR4 binary expression vector
将StproNPR4-NPR4-pOREO4 双元表达载体电击转化根癌农杆菌()EHA105感受态细胞,将PCR阳性菌株扩培后与马铃薯节间茎共培养,利用卡那抗性压力筛选转基因幼苗,待形成的愈伤组织长出小芽后转移至MS抗性培养基上继续培养至生根,快繁扩大培养。分别取愈伤长出的马铃薯及野生型对照提取DNA,利用NF-1(CTGAATGAACTGCAGGACGA)& NF-2(CCAGATCATCCTGATCGACA)为引物扩增新霉素转移酶基因进行转基因马铃薯鉴定,延伸时间为30 s,其余PCR条件同上。
提取转基因马铃薯总RNA,反转录成cDNA,以StNPR4q-F/R 为 引 物,以基 因 为 内 参(ef1α-3/ef1α-4),进行qRT-PCR 扩增,分析转基因和野生型对照的基因转录水平。qRTPCR 采用TaKaRa TB GreenPremix Ex Taq™Ⅱ试剂盒。反应体系为:cDNA 1.0 μL,正向引物0.4 μL,反向引物0.4 μL,TB Green Premix Ex Taq Ⅱ5.0 μL,ddHO;95 ℃10 min;95 ℃10 s,58 ℃30 s,72 ℃30 s,40个循环。
用0.67 mmol·L植物激素水杨酸类似物BTH诱导转基因马铃薯和野生型对照,以上述qRT-PCR方法检测BTH 诱导后转基因马铃薯和野生型对照的基因转录水平。在150 mmol·L的NaCl MS培养基上分别快繁100棵转基因马铃薯和野生型,检测在高盐胁迫中马铃薯的快繁生根率。
将致病疫霉菌饼接种在新鲜的黑麦培养基上,18 ℃,暗培养7~10 d(使疫霉菌扩散到整个培养基)收集游动孢子并调整至10cfu·mL。无菌转基因马铃薯试管苗和野生型对照均在玻璃组培瓶中快繁生长28 d,植株高约10 cm,分别用360 μL 孢子液均匀喷雾至整个植株,进行病原菌胁迫,2 d 后提取马铃薯与致病疫霉的混合DNA,分别以致病疫霉特异性引物PiO8-3-3F &PiO8-3-3R(CAATTCGCCACCTTCTTCGA & GCCTTCCTGCCCTCAAGAAC)(PiO8:=-3.325+17.30)和 植 物 特 异 性 引 物EF1αF & EF-1αR(TGAGGCAAACTGTTGCTGTC & TGGAAACACCAGCATCACAC)(EF1α:=-3.264+30.10)进行实时荧光定量PCR(qPCR)检测,从标准曲线计算致病疫霉相对马铃薯生物积累量,对转基因马铃薯和野生型进行抗病能力鉴定。
试验数据采用SPSS Statistics 26 及Microsoft Excel 2016 进行统计分析,采用Prism 8 进行图表绘制,采用检验等差分析方法进行试验组与对照组的显著性差异分析。
2 结果与分析
2.1 马铃薯StNPR4 cDNA 序列的克隆及生物信息学分析
以马铃薯cDNA 为模板,扩增的cDNA序列,获得了预期大小的片段(见图2:A),将目的片段克隆到pMD19-T 载体,质粒酶切和测序鉴定结果显示获得了正确的目的片段(见图2:B)。的CDS 序列为1 728 bp,通过与马铃薯数据库里的基因组序列比较,基因含有4 个外显子和3 个内含子(见图2:C),编码575 个氨基酸,蛋白质分子式为CHNOS,分子质量64.6 kDa,等电点为5.66。它的水溶液在280 nm处的消光系数约为27 235,蛋白的不稳定系数为44.6,为不稳定蛋白;脂肪系数是92.42,平均亲水系数为-0.345,具有亲水性。StNPR4 蛋白的二级结构预测分析结果显示螺旋占50.26%,延伸链占2.26%,无规则卷曲占47.3%。通过预测发现StNPR4蛋白不存在信号肽,不含跨膜结构域。StNPR4蛋白序列具有NPR1 典型的保守结构域,N 端具有参与蛋白间互作的BTB/POZ 结构(55~176 aa);C端具有2个与TGA 转录因子结合的ANK 锚蛋白重复序列(282~313 aa及317~346 aa)(见图2:D)。

图2 StNPR4基因CDS的PCR扩增、酶切鉴定和结构预测A.StNPR4 CDS PCR 扩增结果(M.DNA Marker;泳道1.扩增的StNPR4 CDS 片段);B.StNPR4 克隆载体的酶切鉴定(M.DNA marker;泳道1.StNPR4-pMD19-T载体双酶切鉴定;泳道2.StNPR4-pMD19-T质粒DNA(未酶切));C.StNPR4基因结构;D.StNPR4蛋白结构域Fig.2 PCR amplification,enzyme digestion and structure prediction of StNPR4A.PCR amplification of StNPR4 CDS(M.DNA Marker;1.StNPR4 CDS fragments);B.Enzyme digestion of StNPR4 cloning vector(M.DNA Marker;1.Double digestion of StNPR4-pMD19-T vector;2.StNPR4-pMD19-T vector);C.StNPR4 gene structure;D.StNPR4 protein structural domains
2.2 StNPR4蛋白的系统进化分析
将马铃薯StNPR4 与拟南芥、甘蓝型油菜()、辣椒()、番茄()和烟草()中的NPR1 家族蛋白进行系统进化分析,如图3 所示,在拟南芥NPR1 家族的6 个成员中,StNPR4 与AtNPR3 和AtNPR4 聚类到一个大支上,StNPR4 与同是茄科的番茄中预测的SlNIM1-2 同源性最高,说明与它们的亲缘关系最近。

图3 StNPR4系统进化分析与马铃薯(Solanum tuberosum)StNPR4 蛋白比对的蛋白家族来自拟南芥(Arabidopsis thaliana)、甘蓝型油菜(Brassica napus)、辣椒(Capsicum annuum)、番茄(Solanum lycopersicum)以及烟草(Nicotiana tabacum)Fig.3 Phylogenetic analysis of StNPR4Protein families aligned with potato(Solanum taberosum)StNPR4 proteins include Arabidopsis thaliana,Brasica napus,Capsicum annuun,Solanumn iyeopersicum and Nicotiana tabacum
2.3 StNPR4基因组织特异性表达分析
利用qRT-PCR 发现在马铃薯的根、茎、叶和花中均能检测到表达,如图4所示,在叶中的表达量显著高于其他3种组织,其表达量是根中的近5 倍,其次是在根中的表达量高于茎和花中的。

图4 马铃薯不同组织中StNPR4的相对表达量Fig.4 Expression pattern of StNPR4 in different tissues from S.tuberosum**P<0.01
2.4 StNPR4 的启动子序列的克隆及生物信息学分析
以马铃薯DM 1-3 516 R44 基因组DNA 为模板,PCR 扩增的启动子序列,获得了预期1 246 bp 的条带(见图5:A),将PCR 产物连接到pENTR-L16 载体,酶切和测序结果均显示获得了正确的启动子目的片段(图5B)。通过调取马铃薯数据库中基因上游-2000 bp的启动子区序列进行分析,发现具有MYB、WRKY转录因子结合位点及响应水杨酸、乙烯和脱落酸等参与生物胁迫和非生物胁迫的顺式作用元件。

图5 StNPR4启动子的PCR扩增及酶切鉴定A.StNPR4 启动子的PCR 扩增(M.DNA Marker;泳道1.StPRONPR4片段,1 246 bp);B.StNPR4启动子克隆载体的酶切鉴定(M.DNA Marker;泳道1.StPRONPR4-pENTR L16 双酶切鉴定;泳道2.StPRONPR4-pENTR L16载体)Fig.5 PCR amplification of StNPR4 promoter and enzyme digestion of the vectorA.PCR amplification of the StNPR4 promoter(M.DNA Marker;1.StPRONPR4 fragments at 1 246 bp;B.Enzyme digestion identification of StNPR4 cloning vector(M.DNA Marker;1.StPRONPR4 fragments at 1 246 bp;2.StproNPR4-pENTR L16 vector)
2.5 自身启动子驱动的StNPR4 双元表达载体的构建及转化马铃薯
将克隆到的的1 246 bp的启动子序列与CDS 首先连接到pENTR L16载体上,用Ⅱ和Ⅰ进行双酶切鉴定获得了正确大小的条带(见图6:A);再用Ⅱ和Ⅰ将目的片段切出连接到双元表达载体pORE O4 上,构建自身启动子驱动的表达载体,酶切鉴定正确(见图6:B)。利用农杆菌介导的方法转化马铃薯,得到5个转化株系,分别命名为3-2、5-2、7-2、9-2 和17-1(见图6:C)。
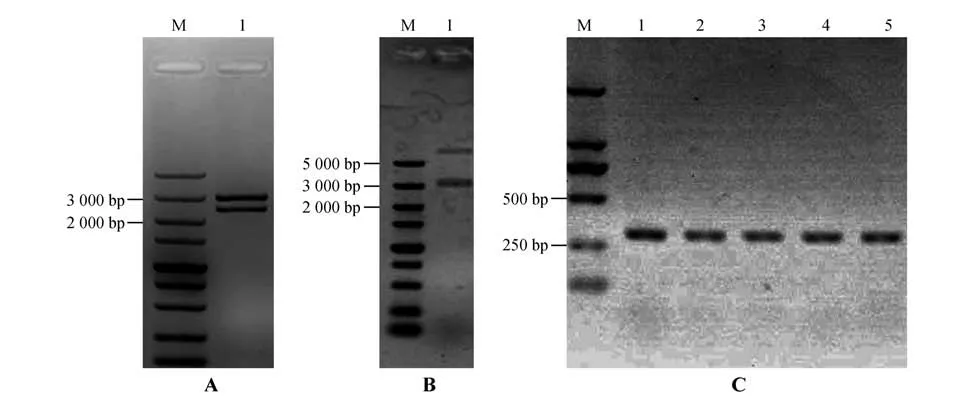
图6 载体酶切鉴定及转基因植株PCR鉴定A.StPRONPR4-StNPR4 pENTR L16 载体酶切鉴定(M.DNA Marker;泳道1.StPRONPR4-StNPR4 片段,30 21 bp);B.StPRONPR4-StNPR4 pORE O4 载体酶切鉴定(M.DNA Marker;泳道1.3 021 bp 的StPRONPR4-StNPR4片段);C.转基因马铃薯植株PCR 鉴定(M.DNA Marker;泳道1~5.StNPR4转基因株系PCR鉴定)Fig.6 Enzyme digestion identification of vectors and PCR identification of transgenic plantsA.Identification of StPRONPR4-StNPR4 pENTR L16 cloning vector by enzymatic digestion;M.DNA Marker;1.StPRONPR4-StNPR4 fragments at 3 021 bp;B.Identification of StPRONPR4-StNPR4 pORE O4 binary expression vector by enzymatic digestion;M.DNA Marker;1.StPRONPR4-StNPR4 fragments at 3 021 bp;C.PCR identification of different StNPR4 transgenic lines;M.DNA Marker;1-5.Different StNPR4 transgenic lines
2.6 StNPR4在马铃薯逆境胁迫中的功能研究
利用qRT-PCR 检测5 个转化株系在没有任何处理的情况下的表达量,发现转 基 因 马 铃 薯 品 系3-2、5-2、7-2 和9-2 中的表达量与对照野生型相比并无显著性差异,只有17-1 的表达量显著低于野生型和其余4 个转化株系(见图7:A)。用水杨酸的类似物BTH 处理后,发现野生型及5 个转化品系中的表达量均出现先升高后降低的模式,17-1 在各个检测的时间点内表达量都相对较低(见图8),这与图7A 的结果有一致性,因此后续的试验不再检测此品系。其余4 个转化品系在BTH 处理后的不同时间点表达量基本上都高于野生型,尤其5-2 在处理8 h 的表达量最高,说明转基因株系对BTH 的诱导更敏感。

图8 BTH诱导后StNPR4的表达量分析Fig.8 StNPR4 expression level after BTH treatment
用马铃薯晚疫病致病菌致病疫霉孢子处理后检测致病疫霉的相对生物量,发现在4个转基因品系中致病疫霉的相对生物量均极显著低于野生型,说明转基因株系明显增强了对致病疫霉的抗性(见图7:B)。
在加入150 mmol·LNaCl 的高盐培养基中快繁转基因株系,发现其生根率明显增加,与野生型相比有极显著差异,说明转基因株系对高盐胁迫有更好的适应性(见图7:C)。

图7 StNPR4转基因马铃薯的功能分析A.转基因马铃薯StNPR4 基因的表达量分析;B.转基因植株接种致病疫霉后病原菌相对生物量分析;C.150 mmol·L-1 NaCl 处理对转基因马铃薯快繁生根率的影响;*P<0.05,**P<0.01,对各试验组与对照组同一时间点表达量采用等方差t检验分析,下同Fig.7 Functional analysis of StNPR4 transgenic plantsA.StNPR4 expression level in transgenic lines;B.Relative biomass of pathogens after inoculation of transgenic lines with phytophthora infestans;C.Rooting rates of transgenic lines after treatment with 150 mmol·L-1 NaCl;* represents P<0.05,** represents P<0.01,and equal variance t-test was used to analyze each experimental group and the control group at the same time point,the same as below
3 讨论
植物的整个生命周期都面临着来自各种生物和非生物因素的环境选择压力,植物也因此发展出复杂的调控网络以应对各种胁迫。在植物对病原菌的抗性调节中,免疫调节因子的表达在时间和空间上与侵染压力相匹配,过量表达免疫因子对植物自身有潜在的危害,如生长减缓、植株变矮小、产量降低甚至死亡。在水稻中用组成型启动子过量表达的旁系同源物显著降低了转化植株的存活率,少数存活的转基因植株也没有表现出抗病性的增强;而用自身启动子驱动的双元表达载体转化植株后可以产生明显的抗病性。
本研究通过利用自身启动子驱动的双元表达载体转化获得转基因植物,发现在没有病原菌诱导时,其表达量与野生型并无明显差异,但当用SA 的类似物BTH 诱导后,其表达量显著升高,并且表现出对致病疫霉的抗性。Zavaliev 等发现NPR1 启动防御反应之后,细胞质中的NPR1会形成SINCs 凝聚体(salicylic acid-induced NPR1 condensates,SINCs),靶向调控逆境相关蛋白的泛素化和降解,从而在植物的免疫反应中促进细胞的存活,这表明NPR1可以在抗病和生长发育之间进行平衡。
研究结果表明转基因马铃薯在盐胁迫压力下的生根率显著高于对照,StNPR4 很可能在马铃薯的盐耐受性中起正调控作用,这暗示了基因家族在非生物胁迫中发挥作用。这一发现在其他物种中也得到了佐证。越来越多的研究表明NPR1 也参与了非生物胁迫。在低温诱导下,细胞质中的NPR1寡聚体释放出单体NPR1,进入细胞核中与热激转录因子HSFA1互作参与冷驯化的调控。Seo等发现在高盐胁迫下NPR1会快速转运至叶绿体中,作为分子伴侣和抗氧化剂直接起作用,可以减弱逆境导致的光合能力的下降;Jayakannan 等的 研 究 显 示 拟 南 芥 中 依 赖NPR1 的SA 路径对增强盐和氧化胁迫的耐受性是必需的;Divi 等的研究表明NPR1 是油菜素内酯介导的耐热和耐盐中的关键组分。
NPR1 介导获得的抗性是广谱的,可赋予植物对细菌、病毒和真菌的多重抗性,故而成为在植物抗病育种应用中一个受到广泛关注的基因。目前已有研究在水稻()、小麦()、番茄()、大豆()、烟草()、棉花()、胡萝卜()、油菜()、柑橘()、苹果()和香蕉()中过量表达NPR1,均表现为抗病性增强,有些物种甚至表现出对食草昆虫斜纹夜蛾()的抗性。本研究通过由自身启动子驱动的表达载体转化获得转基因植物,发现增强了马铃薯对致病疫霉的抗性,并且提高了在高盐胁迫下的生根率,这样的转基因表达策略既可以确保植物抗病性又可以保证植物的正常生长,对后续抗病基因的应用也是一个很好的启示。
尽管目前对基因家族在非生物胁迫的研究中有了一定进展,然而对其具体的作用机制和确切功能依然未知。有研究表明AtNPR1 在转基因水稻中对盐胁迫和干旱胁迫起负调控作用,并 且Hao 等的 研 究 发 现NPR1 突 变 体npr1-1 表现出对盐胁迫更高的耐受性,在拟南芥中异位表达来自桑树()的和增加了对干旱和盐胁迫的敏感性。这些发现都表明了在非生物胁迫过程中基因家族在不同物种中发挥不同的功能,其作用机制还有待进一步研究。
