去甲肾上腺素抑制小鼠真皮微血管内皮细胞CXCL10和CCL17表达
2022-10-11姚伯昕许凌晖许天星郭燕妮
姚伯昕, 许凌晖, 许天星, 郭燕妮
机体在应激状态下,交感神经释放去甲肾上腺素(norepinephrine,NE)。关于神经内分泌网络调控免疫系统的具体机制尚未完全明确。真皮血管受交感神经支配,且在皮肤炎症中处于关键地位,推测NE可能通过血管内皮细胞调节皮肤炎症反应。本课题组前期工作[1]发现,经NE处理的小鼠真皮微血管内皮细胞(primary dermal microvascular endothelial cells,pDMECs)可促使抗原呈递后CD4+T淋巴细胞向Th17分化。CXCL9、CXCL10 和CXCL11为Th1型趋化因子,CCL17和CCL22为Th2型趋化因子,分别趋化Th1和Th2细胞。研究发现,CXCL10和CCL17与多种炎症性皮肤病相关,白癜风、斑秃、银屑病性关节炎患者的皮损或血清的CXCL10表达明显升高[2-4],而CCL17则在特应性皮炎、荨麻疹、大疱性天疱疮等有较高表达[5-7]。本研究拟在前期研究的基础上进一步研究NE对小鼠pDMECs CXCL10和CCL17表达的影响,探讨NE对皮肤炎症反应的调控机制,以期为临床治疗炎症性皮肤病提供可能的理论依据。
1 材料与方法
1.1 材料
1.1.1 动物和细胞系 6~12周的雌性BALB/c小鼠[许可证号:SCXK(沪)2019-0012,上海斯莱克实验动物有限公司],SPF级,体质量18~22 g。小鼠适应性喂养1周后开始实验,饲养环境设定室温20~22 ℃、湿度40%~70%,维持12 h光/暗循环,充分供应饮水及饲料。实验前一天,小鼠颈背部用电动剃刀去毛。细胞系:BALB/c小鼠pDMECs细胞(中国科学院细胞库)。动物研究获动物实验伦理委员会批准。
1.1.2 试剂和仪器 内皮细胞完全生长培养液(上海普迈生物科技有限公司);胎牛血清(美国Gibco公司);鼠趋化因子CXCL10和CCL17引物序列(上海擎科生物科技有限公司);Trizol试剂(批号:15596-026,美国Invitrogen公司);HiScript Reverse Transcriptase逆转录试剂盒(批号:R101-01/02)及SYBR Green Master Mix荧光染料(批号:Q111-02)(美国VAZYME公司);CXCL10、CCL17 ELISA试剂盒(批号:E-EL-M0021c、E-EL-M0012c,武汉伊莱瑞特生物科技股份有限公司);非选择性β肾上腺素受体拮抗剂普萘洛尔(propranolol,Prop)及α肾上腺素受体拮抗剂酚妥拉明(phentolamine,Phent)(美国Sigma公司)。电热恒温培养箱(ICV-450,日本ASONE公司);多功能酶标仪(Flexstation3,美国Molecular Devices公司);实时荧光定量聚合酶链反应(real time fluorescent quantitative polymerase chain reaction, qRT-PCR)仪(QuantStudio 6,美国ABI公司);PCR仪(EDC-810,北京东胜创新生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 pDMECs接种于25 mL培养瓶中,以含有5%胎牛血清的内皮细胞完全生长培养液培养,于37 ℃、体积分数为0.05的CO2条件下进行培养,待细胞融合至80%时胰酶消化传代,取3~4代pDMECs用于实验。以5×104mL-1浓度接种于24孔板,每孔1 mL。37 ℃孵育过夜后,进行分组实验。
1.2.2 ELISA法检测不同浓度NE干预后CXCL10 和CCL17的表达 pDMECs共分为6组,依次为未加刺激剂的对照组、LPS组(1 μg/mL LPS)、LPS与不同浓度NE(10-8、10-7、10-6和10-5mol/L)共孵育组(先加入NE,1 h后加入LPS)。48 h 后收集上清液,采用ELISA法检测细胞上清液中CXCL10和CCL17的表达,参照ELISA试剂盒说明书操作。
1.2.3 ELISA法检测肾上腺素受体拮抗剂封闭受体后CXCL10和CCL17的表达 α肾上腺素受体拮抗剂组:将pDMECs分为5组,依次为未加刺激剂的对照组、LPS组(1 μg/mL LPS)、LPS+NE组(10-5mol/L NE)、LPS+NE+Phent组(10-5mol/L Phent)及LPS+Phent组,先加入Phent封闭1 h后再加入NE。48 h后收集上清液,采用ELISA法检测上清液中CXCL10和CCL17的表达。β肾上腺素受体拮抗剂组:将pDMECs分为5组,依次为未加刺激剂的对照组、LPS组(1 μg/mL LPS)、LPS+NE组(10-5mol/L NE)、LPS+NE+Prop组(10-5mol/L Prop)及LPS+Prop组,先加入Prop封闭1 h后再加入NE。48 h后收集上清液,采用ELISA法检测上清液中CXCL10和CCL17的表达。
1.2.4 qRT-PCR检测小鼠真皮CXCL10和CCL17 mRNA的表达 BALB/c小鼠随机分为4组,对照组(NE处理组、未处理组)和模型组(NE处理组、未处理组),每组5只。NE处理组颈背两侧皮肤皮内注射含1 μg NE的PBS 100 μL,未处理组以同样的方式仅注射PBS。注射15 min后,模型组小鼠颈背两侧皮肤皮内再注射含0.5 μg LPS的PBS 100 μL,对照组以同样的方式仅注射PBS。24 h 后切取注射部位约0.5 cm2的皮肤组织,切取深度以达到真皮全层为宜。PBS漂洗后,真皮侧在下置于含0.5 U/mL的蛋白酶(dispase)和0.38%胰蛋白酶(trypsin)的PBS中。漂浮45 min后取出皮肤,PBS漂洗,刮除表皮。取真皮低温充分匀浆后,通过Trizol法提取真皮组织中的总RNA,根据HiScript Reverse Transcriptase逆转录试剂盒说明书合成cDNA,再添加SYBR Green Master Mix进行qRT-PCR扩增。反应程序:95 ℃预变性10 min→95 ℃ 变性15 s→60 ℃退火60 s,共40个循环。以β-actin为内参,根据2-ΔΔCt法进行相对定量。引物序列由上海擎科生物有限公司合成(表1)。

表1 引物序列
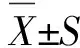
2 结 果
2.1 不同浓度NE对pDMECs表达CXCL10和CCL17的影响 与对照组比较,LPS组pDMECs细胞上清液中CXCL10和CCL17表达均明显升高[(91.118±5.360)和(60.014±1.690)pg/mL](P<0.001,图1);与LPS组比较,经不同浓度(10-8、10-7、10-6、10-5mol/L)NE处理,随着浓度增加,CXCL10表达逐渐降低[(77.787±2.388)、(63.788±3.681)、(52.089±1.802)、(37.942±3.470)pg/mL](P<0.05),呈剂量依赖性;经不同浓度(10-7、10-6、10-5mol/L)NE处理,随着浓度增加,CCL17表达也逐渐降低[(49.617±2.988)、(42.465±2.274)、(37.664±1.843)pg/mL](P<0.05),也呈剂量依赖性。两组均以10-5mol/L NE浓度下降最显著,后续以此浓度为实验浓度。台盼蓝染色进行细胞活力研究,加入NE培养48 h后不影响pDMECs的活力,排除趋化因子表达的降低为细胞死亡的结果(数据未显示)。
NE:去甲肾上腺素;LPS:脂多糖。A:NE抑制LPS诱导的CXCL10表达,呈剂量依赖性;B:NE抑制LPS诱导的CCL17表达,呈剂量依赖性。与对照组比较,###:P<0.001;与LPS组比较,☆:P<0.05,☆☆:P<0.01,☆☆☆:P<0.001。图1 不同浓度NE对LPS诱导pDMECs CXCL10和CCL17表达的影响Fig.1 Different concentrations of NE on LPS-induced CXCL10 and CCL17 expressions by pDMECs
2.2 Phent或Prop封闭受体对CXCL10和CCL17表达的影响 与对照组比较,各LPS组pDMECs细胞上清液中CXCL10和CCL17表达均明显升高(P<0.001)。与LPS组比较,LPS+NE组两个指标表达均明显降低(P<0.01),LPS+Phent组和LPS+Prop组无明显变化(P>0.05),LPS+NE+Phent组仍明显降低(P<0.05),而LPS+NE+Prop组则无明显降低(P>0.05)。具体见表2和图2。
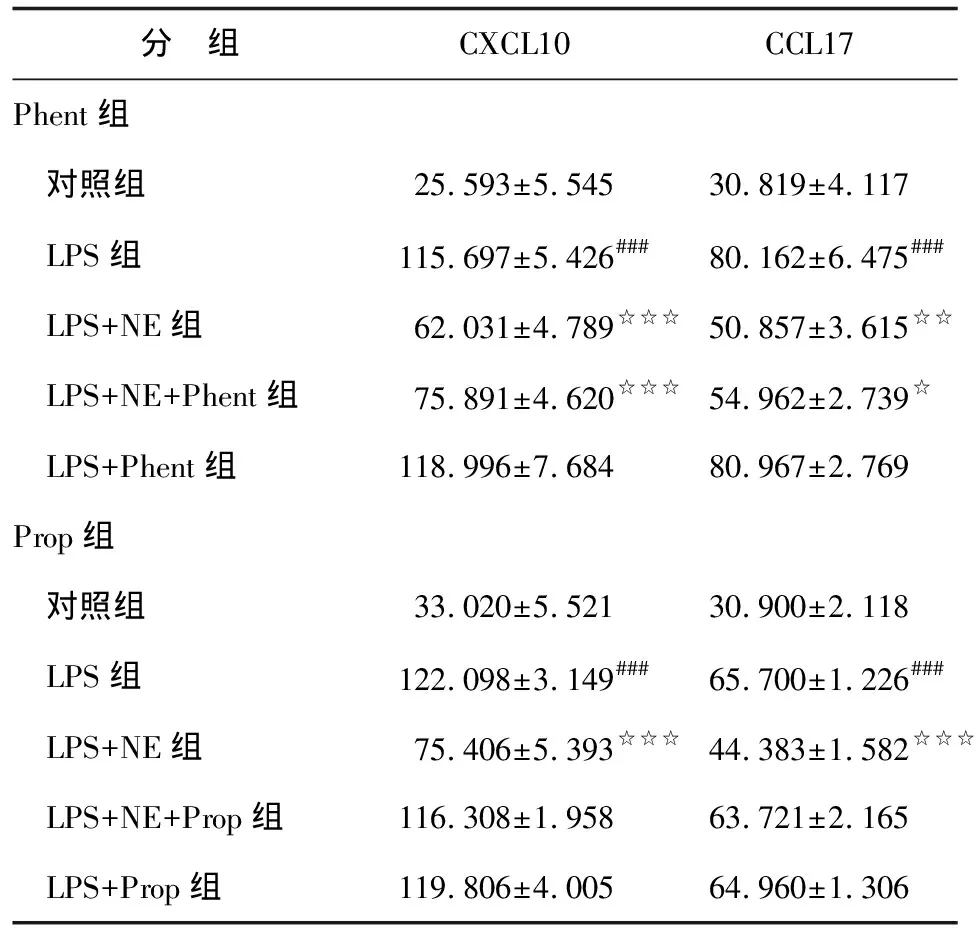
表2 Phent或Prop封闭受体对NE抑制CXCL10和CCL17表达的影响
2.3 NE对BALB/c小鼠皮肤CXCL10和CCL17 mRNA表达的影响 NE处理组小鼠皮肤真皮CXCL10 和CCL17 mRNA的表达水平均较仅注射PBS组明显降低[(1.755±0.295),(1.323±0.112)](P<0.05,图3)。
3 讨 论
神经免疫系统是一个复杂的网络,已证实降钙素基因相关肽、血管活性肠肽、P物质、垂体腺苷酸环化酶激活肽和儿茶酚胺等神经递质是神经系统和免疫细胞间强有力的调节因子。应激状态下,交感神经末梢分泌儿茶酚胺,尤其是NE。肾上腺素受体分为α肾上腺素受体和β肾上腺素受体,广泛表达于皮肤各种细胞,如角质形成细胞、血管内皮细胞[8-9]、朗格汉斯细胞等。本课题组之前的研究[1]也证实了小鼠pDMECs 表达α肾上腺素受体和β肾上腺素受体。真皮血管内皮细胞受交感神经支配,且表达肾上腺素受体,这为本研究提供了理论及解剖学基础。皮肤血管内皮细胞在皮肤的炎症反应中起关键性作用,可以产生各种细胞因子和趋化因子参与炎症反应[10]。趋化因子通过与白细胞上的受体结合,定向调节白细胞的粘附和迁移,招募白细胞至炎症部位而发挥功能。LPS在体内可激活单核巨噬细胞、内皮细胞和上皮细胞等,合成和释放TNF-α、IL-6等多种细胞因子和炎性介质,常用于炎症相关研究[11-12]。李敏等[13]研究表明,LPS处理24 h后,人皮肤微血管内皮细胞外促炎症因子IL-1β、IL-6和TNF-α 含量明显升高。本研究选择LPS诱导小鼠pDMECs,探讨NE对pDMECs趋化因子CXCL10和CCL17表达的影响。
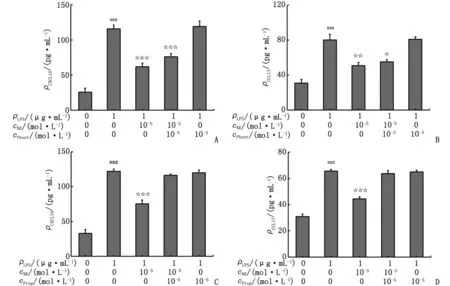
NE:去甲肾上腺素;LPS:脂多糖;Phent:酚妥拉明;Prop:普萘洛尔。A:预先Phent封闭后加入NE,CXCL10表达仍降低;B:预先Phent封闭后加入NE,CCL17表达仍降低;C:预先Prop封闭后加入NE,CXCL10表达无明显降低;D:预先Prop封闭后加入NE,CCL17表达无明显降低。与对照组比较,###:P<0.001;与LPS组比较,☆:P<0.05,☆☆:P<0.01,☆☆☆:P<0.001。图2 Phent或Prop封闭受体对NE抑制CXCL10和CCL17表达的影响Fig.2 Effects on NE-induced suppression of CXCL10 and CCL17 by Phent or Prop
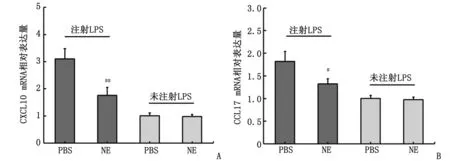
NE:去甲肾上腺素;LPS:脂多糖。A:LPS诱导的BALB/c小鼠,皮下注射NE,真皮CXCL10 mRNA的相对表达量减少;B:LPS诱导的BALB/c小鼠,皮下注射NE,真皮CCL17 mRNA的相对表达量减少。LPS诱导的NE组与PBS组比较,#:P<0.05,##:P<0.01。图3 BALB/c小鼠真皮CXCL10和CCL17 mRNA的相对表达量Fig.3 The relative expressions of CXCL10 and CCL17 mRNA in the dermis of BALB/c mice
本研究存在一定局限性:动物实验未能确定NE在体内作用的相关靶细胞,且未能同步行小鼠皮肤病理检查以观测皮肤炎症改变;未深入探讨NE调节趋化因子表达的具体作用机制。这些不足在今后的研究中应进一步完善。
综上所述,NE可通过皮肤血管内皮细胞β肾上腺素受体,抑制炎症趋化因子CXCL10和CCL17的表达,从而发挥抗炎作用。炎症性皮肤病发病率高,影响患者生活质量,抗炎药物市场需求大,近年不断出现新型外用抗炎药,如钙调磷酸酶抑制剂、JAK抑制剂[19-20]、PDE-4抑制剂[21]等。本研究为开发新型神经免疫调节及抗炎药物(特别是外用药物)提供可能的新方向。
