臭椿酮抑制急性骨髓性白血病细胞恶性生物学行为的研究
2022-10-11徐奔覃锐向航许京淑廖子龙向金平
徐奔,覃锐,向航,许京淑,廖子龙,向金平
恩施土家族苗族自治州中心医院血液科,湖北 恩施445000
急性骨髓系白血病(acute myeloid leukemia,AML)是一种髓性白细胞异常增殖的血液肿瘤,具有高度异质性,死亡率较高。目前,临床治疗AML多采用化疗、干细胞移植等方法,虽然可以一定程度上缓解疾病进程,但AML易复发、患者预后差等问题仍然是影响患者生命安全和生活质量的关键[1-2]。因此,在临床上需要深入探究AML的发病机制以寻找更有效的低毒药物和潜在靶点,改善患者预后,降低死亡率。
肿瘤的发生、发展涉及细胞基因组学的改变,微小RNA(microRNA,miR)作为一种非蛋白编码单链RNA,可通过转录及转录后调控介导基因的表达,在肿瘤细胞基因组学改变过程中发挥着关键作用[3-4]。miR-449a是miR-449家族的一员,其在非小细胞肺癌、乳腺癌、宫颈癌等多种肿瘤中表达下调,能够调节癌症相关基因表达,被认为是一种肿瘤抑制因子[5-7]。已有研究证实[8],miR-449a能够调节白血病细胞分化、增殖、凋亡等生物学过程,miR-449a在AML发病、治疗中可能发挥着重要作用。臭椿酮(ailanthone,AIL)是从传统药用植物臭椿中提取的具有抗肿瘤、抗炎、抗疟疾、抗过敏等生物活性的单体化合物。有文献报道[9],AIL对乳腺癌、前列腺癌、胃癌、肝癌等多种肿瘤细胞的生长具有抑制作用,然而,AIL对AML细胞的作用效果尚未完全明确。本研究旨在揭示AIL对AML细胞恶性生物学行为的影响,并分析其作用机制是否与调控miR-449a相关,以期为AML的治疗研究提供参考。
1 材料与方法
1.1 材料
人AML系HL-60细胞株(中国科学院上海生命科学院细胞库);AIL(纯度>98%,瑞芬思生物科技有限公司);胎牛血清、RPMI-1640培养基(美国Gibco公司);细胞计数试剂盒(cell counting kit-8,CCK-8)(日本同仁化学研究所);Matrigel基质胶(上海尚善生物科技有限公司);Transwell小室(美国Millipore公司);RNA提取试剂盒与反转录试剂盒、LipofectamineTM2000转染试剂(美国Thermo Fisher Scientific公司);AnnexinV-FITC/PI凋亡检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);miR-449a mimic质粒、mimic对照质粒、miR-449a inhibitor质粒、inhibitor对照质粒(广州锐博生物科技有限公司);兔抗磷脂酰肌醇3-激酶(phosphatidylinositol-3-hydroxykinase,PI3K)、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、蛋 白 激 酶B(protein kinase B,AKT)、磷酸化AKT(phosphorylated AKT,p-AKT)单克隆抗体、鼠抗β-肌动蛋白(β-actin)单克隆抗体(美国Cell Signaling Technology公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG(H+L)和HRP标记的山羊抗鼠IgG(H+L)(美国Santa Cruz公司)。
1.2 方法
1.2.1 细胞培养HL-60细胞株置于RPMI-1640培养基(含10%胎牛血清和1%青霉素和链霉素)中,在37℃,5 % CO2的恒温培养箱中传代培养,细胞每2~3 d更换1次培养液,取处于对数生长期的细胞开展实验。
1.2.2 细胞转染与分组 用不同浓度(0.2、0.4、0.8、1.6、3.2 μmol·L-1)的AIL处理对数生长期的HL-60细胞24 h,检测细胞增殖情况以筛选AIL适宜浓度用于后续实验研究。将miR-449a mimic质粒、mimic对照质粒转染至未经任何处理的HL-60细胞中,分别记为miR-449a mimic组、mimic NC组;将miR-449a inhibitor质粒、inhibitor对照质粒转染至未经任何处理的HL-60细胞,并用适宜浓度的AIL处理细胞24 h,记为AIL+miR-449a inhibitor组、AIL+inhibitor NC组,以未经任何处理的细胞作为阴性对照组(Control组)。转染过程严格按照LipofectamineTM2000转染试剂说明书操作。
1.2.3 CCK-8法检测细胞增殖抑制率 取对数生长期的HL-60细胞,以5×104cell·mL-1浓度接种于96孔板贴壁培养,用不同终浓度(0.2、0.4、0.8、1.6、3.2 μmol·L-1)AIL处理细胞,同时按照1.2.2的方法设置分组,每组设置5个复孔,于37℃条件下培养24 h后,每孔加入10 μL CCK-8溶液,继续孵育4 h,使用酶标仪在450 nm波长下测定每个孔的吸光度(OD450)值,按公式(1)计算细胞增殖抑制率。实验重复3次。

1.2.4 划痕实验检测细胞迁移能力 将经过相应处理的HL-60细胞以1×106cell·mL-1浓度接种于6孔板培养至细胞贴壁生长后,每组设置5个复孔,用200 μL移液器枪头垂直划线,分别干预0和24 h后在倒置显微镜下观察细胞迁移情况,按公式(2)计算细胞迁移率。实验重复3次。
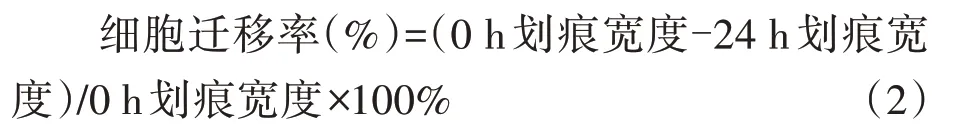
1.2.5 Transwell小室法检测细胞侵袭能力 预先用Matrigel基质胶活化Transwell小室1 h。收集经过处理的HL-60细胞,用无血清培养基稀释为5×108cel·lmL-1的细胞悬液,Transwell小室上室加入400 μL细胞悬液,下室加入RPMI-1640完全培养基600 μL,Transwell小室在细胞培养箱中培养24 h后,取出Transwell小室,用无菌棉签轻轻擦去上室未侵袭细胞,用甲醇固定,0.1 %结晶紫染色5 min,随机选取5个视野,计算细胞侵袭数。实验重复3次。
1.2.6 Annexin V-FITC/PI双染法检测细胞凋亡率 将经过处理的HL-60细胞以5×105cell·mL-1浓度接种于6孔板培养24 h,每组设置5个复孔,用500 μL结合缓冲液重悬细胞,分别加入5 μL Annexin V-FITC染液和5 μL PI染液,室温下暗室孵育15 min。在流失细胞仪上分析细胞凋亡情况,按公式(3)计算细胞凋亡率。实验重复3次。细胞凋亡率=凋亡细胞数/细胞总数×100%(3)
1.2.7 qRT-PCR法检测细胞中miR-449a mRNA表达水平 收集处理过的HL-60细胞悬液,加入Trizol试剂提取总RNA,用紫外分光光度计检测总RNA纯度和浓度。按照反转录试剂盒将RNA反转录合成cDNA,根据qRT-PCR荧光定量试剂盒说明书配置反应体系,进行qRT-PCR实验。引物 序 列 为:miR-449a上 游 引 物:5′-CTCGCTGGCAGTGTATTGTTAG-3′,下游引物:5′-TATCGTTGTACTCCAGACCAAGAC-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下 游 引 物:5′-AACGCTTCACGAATTTGCGT-3′。循环条件为:95℃30 s,60℃30 s;72℃30 s,共40个循环。以U6为内参基因,相对表达量采用2-△△Ct法计算。实验重复3次。
1.2.8 Western blot法 检测PI3K/AKT信 号 通路相关蛋白表达水平 收集处理过的HL-60细胞悬液,用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。蛋白样品用SDS-PAGE凝胶电泳分离,电转膜至PVDF膜,室温下在含0.5%脱脂奶粉的TBST缓冲液封闭2 h,TBST洗膜3次,加入PI3K、p-PI3K、AKT、p-AKT一抗(1∶1 000),4℃孵育过夜,TBST洗膜3次,加入对应HRP标记的二抗(1∶2 000),室温下孵育2 h,加入ECL试剂显影,凝胶图像处理系统分析蛋白条带灰度值。实验重复3次。
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析,实验结果以均数±标准差(±s)表示,对计量资料进行正态性检验,满足正态性且组间方差齐,采用单因素方差分析(one-way ANOVA)比较组间差异性,进一步两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 AIL对HL-60细胞增殖的影响
CCK-8结果显示(图1),与Control组比较,不同浓度AIL处理HL-60细胞24 h后,细胞增殖抑制率均显著升高(P<0.05),且随着AIL浓度增加,细胞增殖抑制率呈浓度依赖性增加,差异具有统计学意义(P<0.05)。AIL处理HL-60细胞24 h的半数抑制浓度(IC50)为(0.78±0.06)μmol·L-1,基于此,本研究后续细胞迁移、侵袭和凋亡实验选择0.6、0.8、1.0 μmol·L-1作为AIL处理HL-60细胞的浓度。
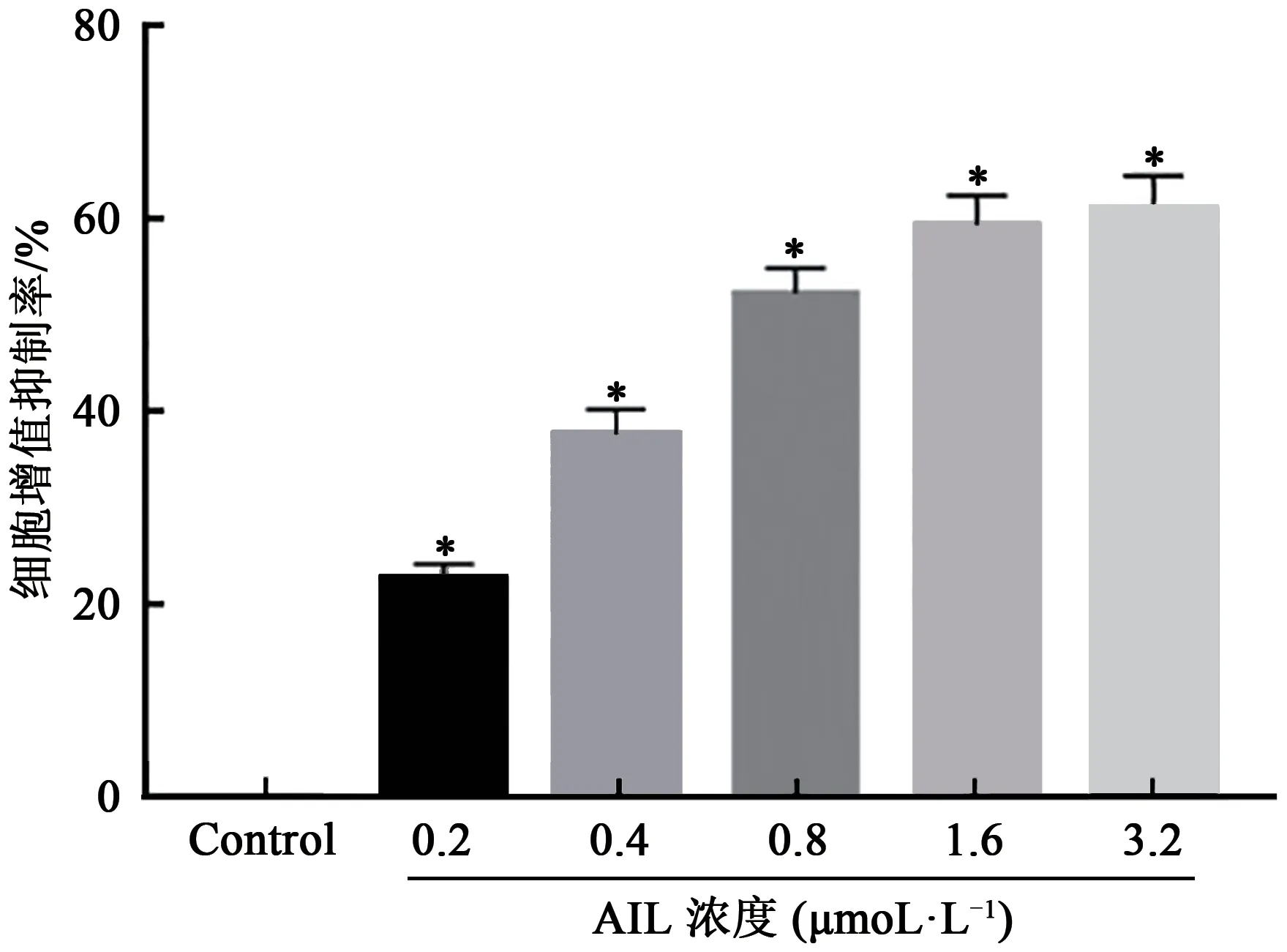
图1 AIL对HL-60细胞增殖的影响视图Fig.1 Effect of AIL on proliferation of HL-60 cells
2.2 AIL对HL-60细胞迁移、侵袭能力和凋亡的影响
划痕实验结果显示(图2A),与Control组比较,0.6、0.8、1.0 μmol·L-1AIL组HL-60细胞迁移率均显著降低(P<0.05)。Transwell小室法结果显示(图2B),与Control组比较,0.6、0.8、1.0 μmol·L-1AIL组HL-60细胞侵袭数均显著降低(P<0.05)。流失细胞术结果显示(图2C),与Control组比较,0.6、0.8、1.0 μmol·L-1AIL组HL-60细胞凋亡率均显著升高(P<0.05)。上述结果提示AIL抑制HL-60细胞迁移和侵袭,并诱导细胞凋亡。鉴于AIL对HL-60细胞生物学行为的作用随浓度增大而增强,因此,本研究选择1.0 μmol·L-1的AIL浓度作为转染后HL-60细胞的作用浓度。
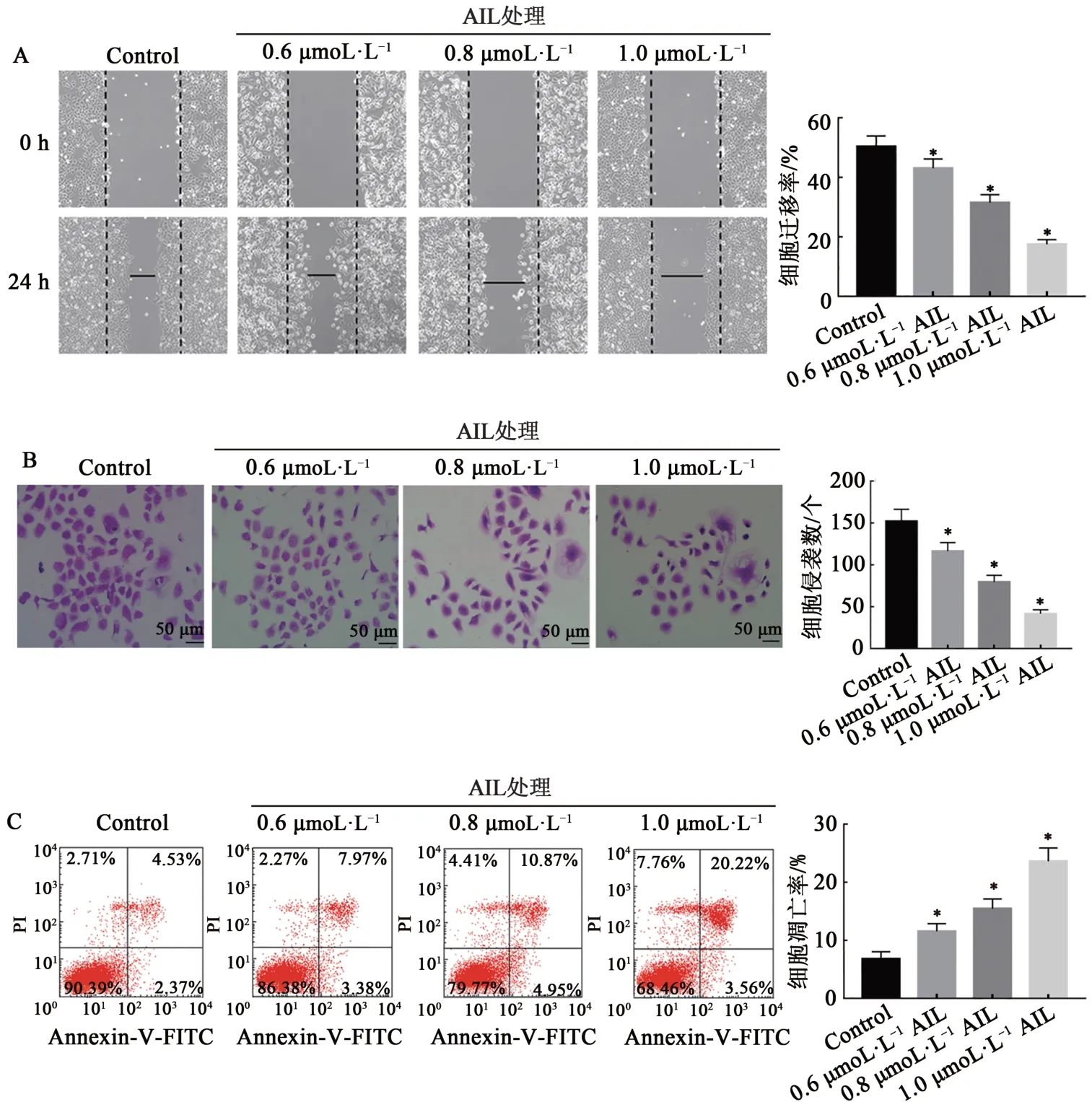
图2 AIL对HL-60细胞迁移、侵袭能力和凋亡的影响Fig.2 Effects of AIL on migration,invasion and apoptosis of HL-60 cells
2.3 AIL对HL-60细胞miR-449a mRNA表达水平的影响
qRT-PCR检测结果显示(图3),与Control组比 较,0.6、0.8、1.0 μmol·L-1AIL组HL-60细 胞miR-449a mRNA表达量均显著升高(P<0.05)。结果表明AIL能够上调HL-60细胞miR-449a的表达。
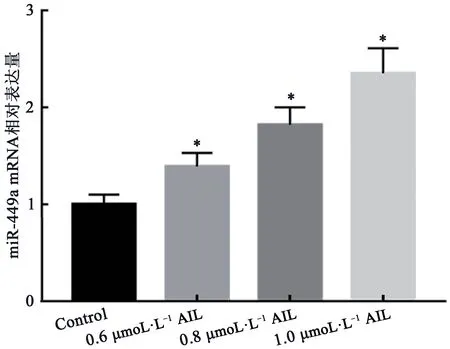
图3 AIL对HL-60细胞miR-449a mRNA表达水平的影响Fig.3 Effect of AIL on miR-449a mRNA expression in HL-60 cells
2.4 过表达miR-449a对HL-60细胞增殖、凋亡、迁移和侵袭的影响
qRT-PCR检测结果显示(图4A),与Control组比较,mimic NC组HL-60细胞中miR-449a mRNA表达量无显著性变化(P>0.05);与mimic NC组比较,miR-449a mimic组HL-60细 胞 中miR-449amRNA表达量显著升高(P<0.05)。提示转染效果良好。CCK-8实验(图4B)、划痕实验(图4C)、Transwell小室法(图4D)及流失细胞术(图4E)结果显示,mimic NC组HL-60细胞增殖抑制率、凋亡率、迁移率及侵袭数目与Control组比较,差异无统计学意义(P>0.05);与mimic NC组比较,miR-449a mimic组HL-60细胞增殖抑制率、凋亡率均显著升高,迁移率及侵袭数目均显著降低(P<0.05)。结果提示过表达miR-449a抑制HL-60细胞增殖、迁移、侵袭,并诱导细胞凋亡。
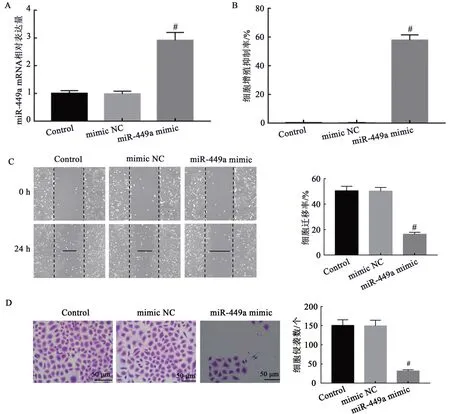

图4 过表达miR-449a对HL-60细胞增殖、凋亡、迁移和侵袭的影响Fig.4 Effects of overexpression of miR-449a on proliferation,apoptosis,migration and invasion of HL-60 cells
2.5 抑制miR-449a表达逆转AIL对HL-60细胞增殖、凋亡、迁移和侵袭的影响
qRT-PCR检测结果显示(图5A),与Control组比较,AIL组HL-60细胞中miR-449a mRNA表达量显著升高(P<0.05);AIL+inhibitor NC组HL-60细胞中miR-449a mRNA表达量与AIL组细胞miR-449a mRNA表达水平相当,差异无统计学意义(P>0.05);与AIL+inhibitor NC组比较,AIL+miR-449a inhibitor组HL-60细 胞 中miR-449a mRNA表达量显著降低(P<0.05)。结果提示转染效果良好。CCK-8实验(图5B)、划痕实验(图5C)、Transwell小室法(图5D)及流失细胞术(图5E)结果显示,与Control组比较,AIL组HL-60细胞增殖抑制率、凋亡率均显著升高,迁移率及侵袭数目均显著降低(P<0.05);AIL+inhibitor NC组HL-60细胞增殖抑制率、凋亡率、迁移率及侵袭数目与AIL组比较,差异无统计学意义(P>0.05);与AIL+inhibitor NC组比较,AIL+miR-449a inhibitor组HL-60细胞增殖抑制率、凋亡率均显著降低,迁移率及侵袭数目均显著升高(P<0.05)。结果提示抑制miR-449a表达能够逆转AIL抑制HL-60细胞增殖、迁移、侵袭及诱导凋亡的作用。
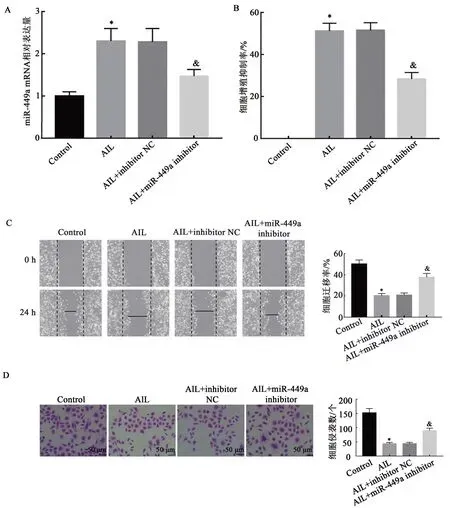
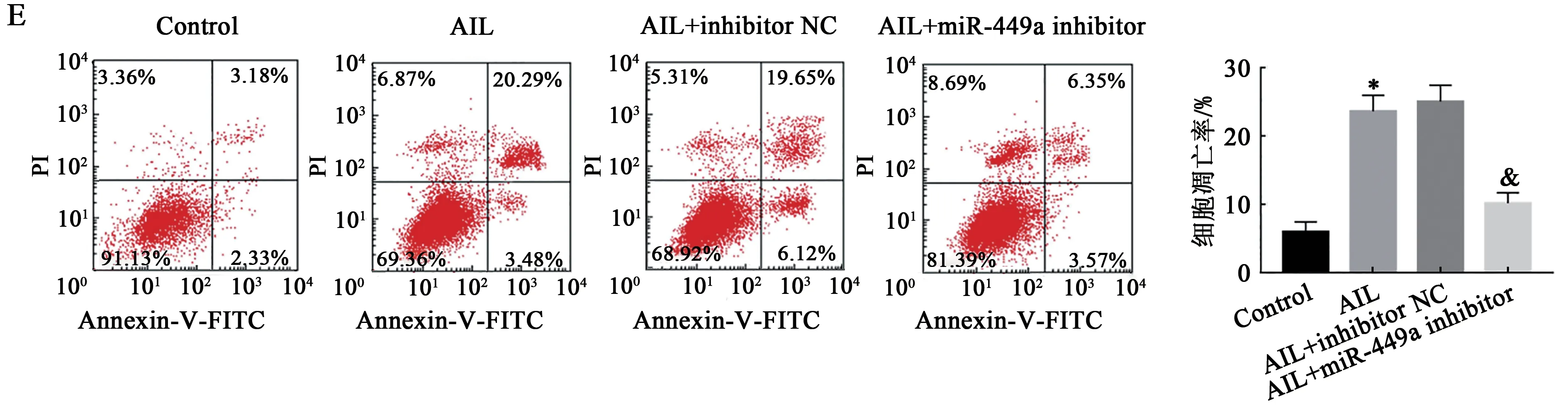
图5 抑制miR-449a表达逆转AIL对HL-60细胞增殖、凋亡、迁移和侵袭的影响Fig.5 Effects of inhibition expression of miR-449a reverses the effects of AIL on proliferation,apoptosis,migration and invasion of HL-60 cells
2.6 抑制miR-449a表达逆转AIL对HL-60细胞PI3K/AKT信号通路相关蛋白的表达
Western blot法检测结果显示(图6),与Control组 比较,AIL组HL-60细 胞p-PI3K/PI3K和p-AKT/AKT比值均显著降低(P<0.05);AIL+inhibitor NC组HL-60细胞p-PI3K/PI3K和p-AKT/AKT比值与AIL组比较,差异无统计学意义(P>0.05);与AIL+inhibitor NC组比较,AIL+miR-449a inhibitor组HL-60细 胞p-PI3K/PI3K和p-AKT/AKT比值均显著升高(P<0.05)。提示抑制miR-449a表达逆转AIL抑制HL-60细胞PI3K/AKT信号通路的作用。
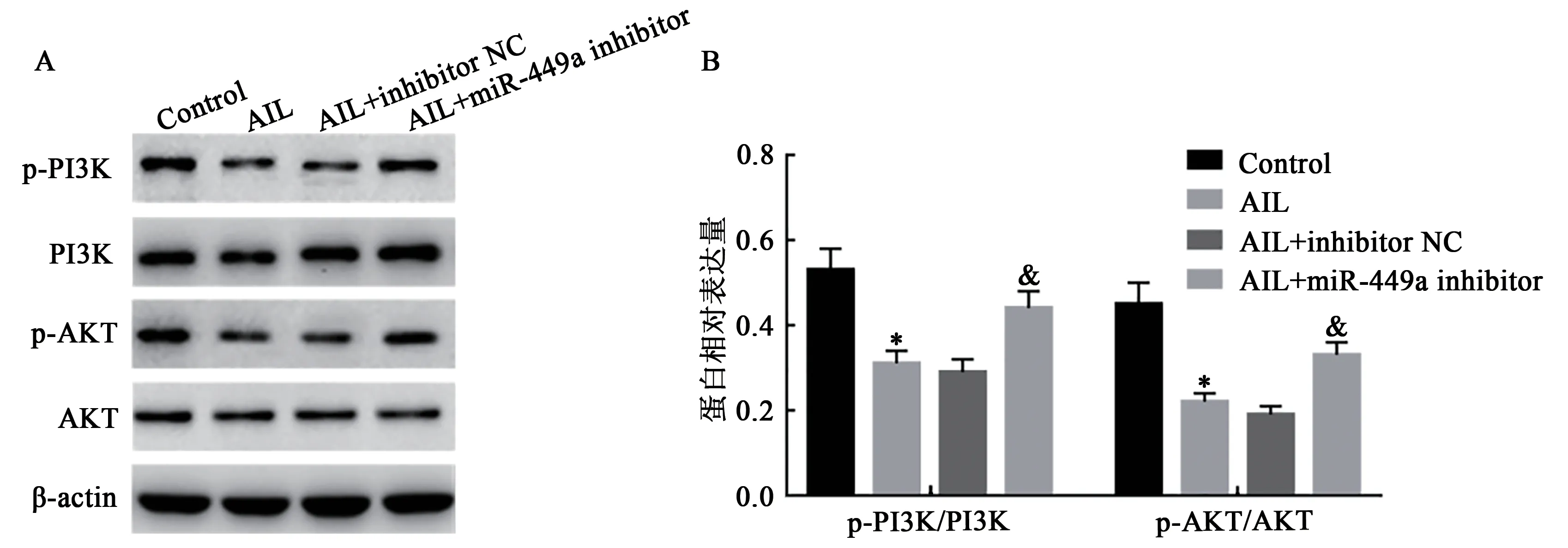
图6 抑制miR-449a表达逆转AIL对HL-60细胞PI3K/AKT信号通路相关蛋白的表达Fig.6 Effects of inhibition expression of miR-449a reverses the regulatory effect of AIL on the expression of PI3K/Akt signaling pathway related proteins in HL-60 cells
3 讨论
AML是血液系统患者死亡的主要原因之一,近年来,针对AML的治疗已经取得了一定进展,但仍无法彻底根治该疾病,因此,明确AML的发病机制,寻找新的治疗策略势在必行[10]。现代中医药研究证实,中药活性成分提取物在恶性肿瘤的防治中具有多靶点作用、毒性小等优势[11]。AIL是一种来源于中草药臭椿的天然活性化合物,大量研究表明AIL可通过多种途径发挥抗肿瘤作用。肝癌细胞中AIL可通过诱导细胞周期阻滞和细胞凋亡阻止细胞生长[12];黑色素瘤细胞中AIL通过调控PI3K/AKT信号通路和线粒体介导的凋亡信号通路分别诱导细胞周期阻滞和细胞凋亡[13];研究还发现,AIL通过上调miR-148a表达及抑制AMPK和Wnt/β-catenin信号通路的活化抑制乳腺癌细胞的增殖、迁移和侵袭[14];AIL通过下调miR-21和阻断Ras/Raf/MEK/ERK及mTOR途径抑制人前庭神经鞘瘤细胞增殖,诱导细胞凋亡和自噬[15]。上述研究结果表明,AIL可通过介导多种信号转导通路和基因靶点调控肿瘤细胞增殖、转移、细胞周期阻滞、凋亡和自噬。本研究以不同浓度AIL处理白血病HL-60细胞发现,AIL对HL-60细胞具有增殖抑制作用,且增殖抑制作用随AIL浓度增加而增强。本研究进一步检测AIL对HL-60细胞迁移、侵袭和凋亡的影响,发现AIL能够显著抑制HL-60细胞迁移、侵袭并诱导细胞凋亡,说明AIL具有显著的抗AML活性。
人体内多种miR表达异常和肿瘤发生、发展及转移密切相关[16]。miR-449家族分布于5号染色体细胞分裂周期基因20B(cell division cycle gene 20B,CDC20B)的第二个内含子上,该区域(5q11.2)是癌症的强易感性位点,人体miR-449表达异常可能引起肿瘤的发生及发展。miR-449a是miR-449家族的一员,在肿瘤生长、增殖以及分化中发挥着重要作用。相关研究指出,miR-449a可抑制肿瘤生长、侵袭和转移,并通过多种途径促进细胞凋亡和分化[17]。miR-449a在骨肉瘤中表达下调,并通过调控B细胞淋巴瘤/白血病-2(BCL2)促进细胞凋亡[18]。肝癌中miR-449a通过下调Calpain 6和POU2F1的表达促进细胞凋亡[19]。非 小 细 胞 肺 癌 中miR-449a通 过 靶 向HMGB1介导的NF-κB信号通路抑制肿瘤细胞的生长、迁移和侵袭[20]。本研究中,不同浓度AIL处理HL-60细胞后,细胞中miR-449a mRNA表达显著上调,说明AIL对HL-60细胞中miR-449a表达具有促进作用。进一步调控miR-449a表达发现,过表达miR-449a可抑制HL-60细胞增殖、迁移、侵袭并诱导细胞凋亡,而抑制miR-449a表达可减弱AIL抑制HL-60细胞增殖、迁移、侵袭及诱导细胞凋亡的作用,提示AIL可能是通过上调miR-449a表达发挥抑制HL-60细胞增殖、迁移、侵袭,诱导细胞凋亡的作用。与Zhang等[21]研究结果一致,AIL上调miR-449a抑制急性骨髓性白血病的生长、迁移和侵袭。
PI3K/AKT信号通路是细胞内参与细胞增殖、凋亡、血管生成等过程的重要信号转导通路。已有研究证实[22],PI3K/AKT信号通路是miR-449a下游信号通路之一,miR-449a可通过调控PI3K/AKT信号通路在细胞生物学行为中发挥重要调控作用。同时,PI3K/AKT信号通路的激活与AML的发生具有密切相关性[23]。本研究检测PI3K/AKT信号通路蛋白发现,AIL作用于HL-60细胞后PI3K/AKT信号通路中p-PI3K/PI3K和p-AKT/AKT比值降低,表明AIL抑制HL-60细胞中PI3K/AKT信号通路活化,而抑制miR-449a表达逆转AIL对HL-60细胞PI3K/AKT信号通路的抑制作用。这提示,AIL抑制HL-60细胞增殖、迁移、侵袭和诱导凋亡的作用可能与调控miR-449a表达、抑制PI3K/AKT信号通路活化有关。
综上所述,本研究证实AIL通过上调HL-60细胞中miR-449a的表达发挥抑制细胞增殖、迁移、侵袭,诱导细胞凋亡的作用,其作用机制可能与调控PI3K/AKT信号通路的活化有关。本研究为治疗AML提供了可选药物和潜在治疗靶点。但本研究实验内容有限,AIL对AML的抗癌作用仍需在动物实验中进一步验证。
