TET酶的生物学功能及相关机制的研究进展
2022-10-11曾雨冰何学佳刘帆裴培王珊
曾雨冰,何学佳,2,刘帆,3,裴培,王珊*
1.首都儿科研究所,儿童发育营养组学北京市重点实验室,北京100020;
2.北京大学首都儿科研究所教学医院,北京100020;
3.北京协和医学院研究生院,首都儿科研究所,北京100020
DNA甲基化可以调控基因的表达及沉默,参与胚胎发育及多种疾病的发生发展,是表观遗传修饰相关研究中最为广泛的一类。胞嘧啶(cytosine,C)以S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)为供体,可在DNMT的催化下将甲基转移到胞嘧啶的C-5位上,形成5-甲基胞嘧啶(5-methylcytosine,5mC)[1],从而完成DNA的甲基化过程。但DNA甲基化状态并非持续不变,5mC可通过氧化脱氨反应,产生G/T错配,被胸腺嘧啶DNA糖苷酶(thymine DNA glycosylase,TDG)选择性识别,随后通过碱基切除修复(base excision repair,BER),恢复胞嘧啶形式,实现DNA去甲基化[2]。
DNA甲基化在胚胎发育过程中需要经历2次重编程。第一次发生在配子首次重编程后。受精后,DNA甲基化会被全部擦除,到植入前的囊胚期,胚胎的DNA甲基化水平降至最低水平,此后,又重新建立表观遗传标记和印记;第二次发生在受精卵植入前期,父母来源的基因组均会经历相应的重编程过程,清除原有的表观遗传学修饰,再重新发生新的甲基化,形成正常发育的全能型胚胎[3-5]。10-11易 位 蛋 白(ten-eleven-translocation protein,TET)酶家族在DNA去甲基化过程中起到了关键的调控功能,它普遍存在于多数动物及低等真核生物中,且在原生生物及真菌中也有发现[6]。研究发现,在小鼠胚胎干细胞(mouse embryonic stem cell,mESCs)分化过程中,TET酶积极参与、介导DNA去甲基化过程,如TET1与转录抑制因子SIN3A结合,激活Lefty1,进而抑制Nodal信号通路[7];TET3通过激活Sfrp4、抑制Wnt通路调节神经外胚层和心脏中胚层分化倾向[8]。此外,TET酶介导的DNA去甲基化还参与多条代谢相关通路[9-12],以及维持机体内的动态平衡。
1 TET酶的分类与结构
TET酶属于2-氧戊二酸酯依赖性双氧合酶(2-oxoglutarate-dependent dioxygenases,2-OGDDs)家族。2003年,Lorsbach等[13]首次在混合系白血病(mixed lineage leukemia,MLL)患者体内发现了TET1。目前TET酶家族共发现3个同源蛋白,分别命名为TET1、TET2、TET3。
人源TET酶是分子量在180~230 kD之间的大分子蛋白,此外还存在较短的TET酶变体[9,14]。TET家族成员均具有保守的C端结构域,包含一个富半胱氨酸的结构域(cysteine-rich domain,CD)和一个双链β螺旋(double-stranded beta-helix,DSBH)结构域。DSBH结构域通过对Fe2+和α-酮戊二酸(alpha-ketoglutaric acid,α-KG)进行结合氧化5mC,CD稳定DSBH与5mC之间的整个催化反应结构[15]。TET1和TET3的N端包含DNA结合的CXXC结构域,该结构域可结合非甲基化的CpG二核苷酸;TET2由于染色体倒位缺乏CXXC结构域,由邻近基因IDAX编码;由于不同的启动子和/或可变剪接,从而产生了一些TET酶亚型,由于这些亚型缺乏与其相关的CXXC结构域,因此 具 有 组 织/细 胞 类 型 特 异 性(图1)[14,16]。2013年,徐彦辉等[15]解析了TET2-DNA复合物的晶体结构,为探究TET酶介导5mC氧化机制提供了结构基础。
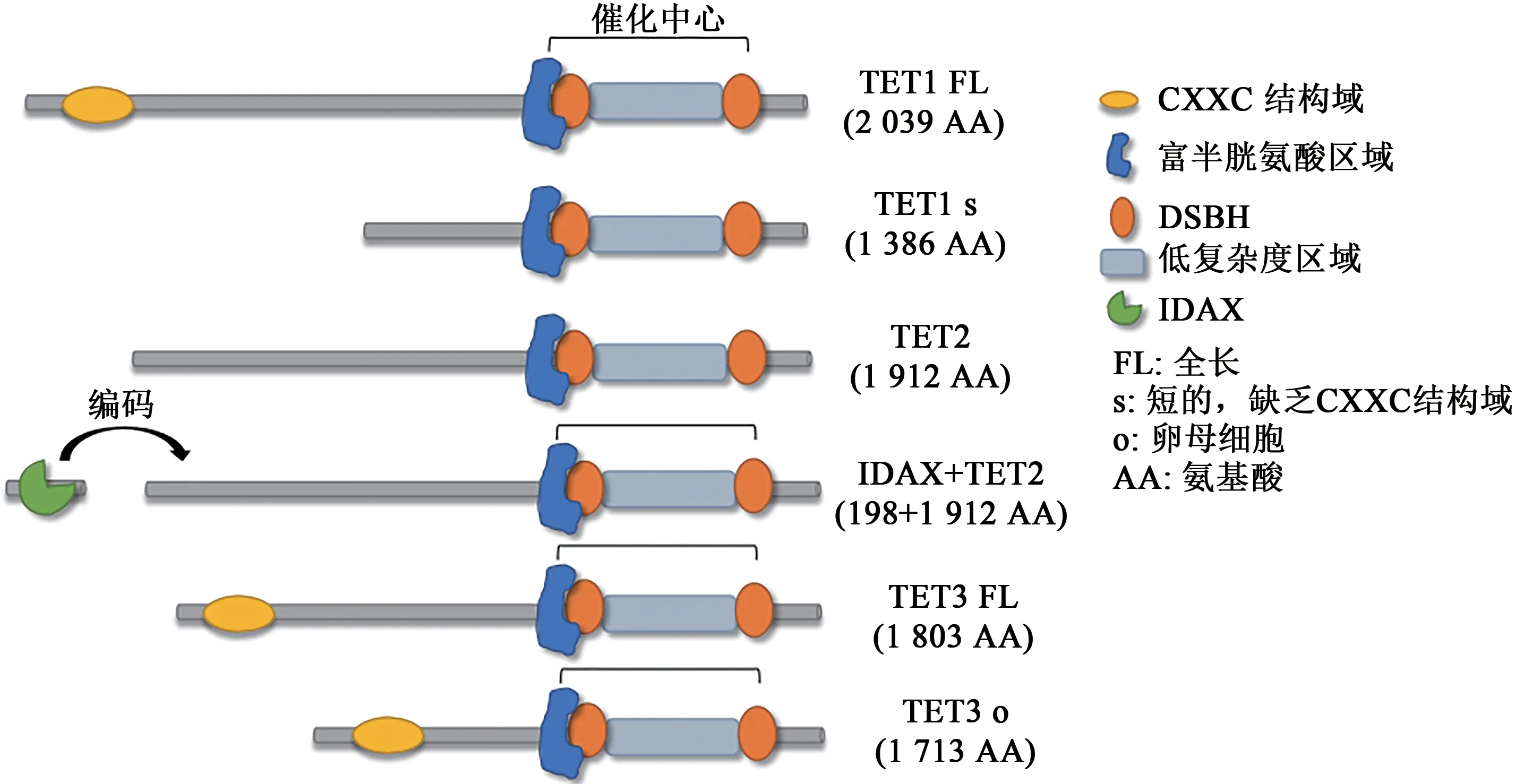
图1 TET酶结构示意图[14]Fig.1 The structure of TET enzymes[14]
2 TET酶介导的DNA去甲基化机制
2009年,有研究发现,TET1可促使5mC氧化为5-羟 甲 基 胞 嘧 啶(5-hydroxymethylcytosine,5hmC)[17]。DNA去甲基化分为DNA被动去甲基化及DNA主动去甲基化两种模式。①DNA被动去甲基化:指DNA复制过程中,由于DNMT1受抑制无法完成子链的甲基化,DNA甲基化状态无法维持,导致DNA甲基化被动稀释(passive dilution)[18]。②DNA主动去甲基化:是由TET酶将DNA序列中的5mC多次氧化,依次转变为5hmC、5-甲酰基胞嘧啶(5-formylcytosine,5fC)和5-羧基胞嘧啶(5-carboxylcytosine,5caC),最终5hmC被TDG选择性识别,通过BER,逆转为未修饰的胞嘧啶[19]。TDG-BER途径可能导致DNA链断裂,使基因组完整性受损,但在敲除TDG基因的小鼠受精卵中,其5mC去甲基化未受影响[20-21]。5hmC也可通过胞苷脱氨基酶(activation induced deaminase,AID)转化为5-羟甲基尿嘧啶,再依次经过TDG识别切除和BER途径完成去甲基化[19]。
3 TET酶的中间产物5hmC特点及分布情况
TET酶介导DNA主动去甲基化过程中,将5mC脱氢加氧,依次转变成5hmC、5fC和5caC,5hmC的羟甲基和5fC的甲酰基分别通过与头蛋白(noggin,NOG)的1-羧酸酯和胞嘧啶的N4环外氮形成氢键,因此,5hmC的羟基和5fC的羰基朝向相反的方向。生化分析表明,TET2的底物偏好是由TET2介导的氧化中氢提取效率不同引起的,5hmC和5fC在催化腔内的约束构象可能会阻碍它们选择有利的取氢方向,降低催化效率。因此,TET酶在进化上被调节为对5hmC反应较弱,并促进5hmC的生成,作为一个潜在的调节功能的稳定标记[22]。
5hmC的分布具有组织或细胞特异性。研究表明,5hmC在脑、肝、肾和结直肠组织中含量较高,在肺组织中含量相对较低,在心脏、乳房和胎盘中含量极低[23],在神经元细胞中浓度最高[24]。不同神经元细胞类型中5hmC含量也存在差异,有研究证实,大脑中5hmC较5mC的总水平相对较高,其中额叶皮层组织中5hmC含量最为显著[25]。当组织或细胞处于疾病状态时,如与正常结直肠组织相比,5hmC在结直肠肿瘤组织中含量显著下降[23];在肝细胞癌早期,5hmC含量已表现出明显下降的趋势[26]。
4 TET酶在疾病中的作用
TET酶参与调节DNA去甲基化过程,产生相应的表观遗传效应,可以促进或抑制机体发育及生物进程。TET基因过表达的情况下,5mC和5hmC的水平均可能由于底物耗竭而降低[27]。以下对TET酶在血液系统、神经精神系统、实体肿瘤等疾病中的作用进行分析。
4.1 TET酶异常在血液系统疾病中的作用
TET酶最早在血液系统疾病中被报道,研究表明,在MLL中存在TET1突变[28]。2009年,Tahiliani等[17]确定TET1为MLL基因的融合伙伴,并通过氧化5mC转变为5hmC,但其在白血病中的确切作用尚不清楚。2013年,有研究发现,TET1是MLL融合蛋白的直接靶点,MLL融合蛋白结合到TET1的启动子区,并直接促进其在人和小鼠造血干细胞或祖细胞中的表达,在MLL重排白血病中显著上调,导致5hmC水平整体增加(图2)[29]。

图2 MLL重排白血病中MLL融合蛋白结合TET1的作用模式图[29]Fig.2 Diagram of MLL fusion protein binding to TET1 on MLL-rearranged leukemia[29]
TET2在造血干细胞(hematopoietic stem cells,HSCs)及其祖细胞中高表达,随着分化的进行TET2水平下降。TET2参与造血干细胞的自我更新、谱系的承诺和造血细胞向特定谱系的最终分化[30]。TET2能调节甲基化驱动的基因沉默,进而控制基因表达。TET2缺失可造成造血干细胞或祖细胞突变,导致多种血液系统疾病的发生[31-32]。有研究报道,在急性髓系白血病(acute myeloidleukemia,AML)中存在WT1、TET2、IDH1和IDH2的互斥性突变[33]。此外,与TET2表达正常的髓系恶性肿瘤相比,除Apc、Nf1、Flt3、Cbl、Notch1、Mll2基因发生突变外,TET2突变导致的髓系恶性肿瘤会产生更多的突变事件。研究表明,在TET2突变的情况下,Notch1基因上有4个杂合突变,通过单细胞靶向外显子组测序发现,在Notch1上选定的13个位点中有7个明显突变频率更高[34]。另有研究报道,TET3维持5hmC表观遗传标记、早期骨髓祖细胞程序、关键葡萄糖代谢和STAT5A信号通路基因的表达,TET3在AML中被发现过度表达,因此,TET3消耗会阻碍AML细胞中的己糖激酶(hexokinase,HK)活性表达和L-乳酸(L-lactate)产生[35]。
4.2 TET酶异常在神经系统疾病中的作用
大量研究表明,5hmC在中枢神经系统中含量丰富,其表达水平与动物年龄呈正相关[23,36]。TET酶通过调控神经发育相关基因5hmC的水平,可以影响神经系统的正常发育和功能[37-38]。
Rudenko等[39]研究发现,敲除小鼠的TET1可使皮质和海马中调控神经元活动的基因Arc、Npas4、c-Fos、Egr2等失调,引起突触可塑性改变、记忆消退中特定的认知损伤,导致空间学习和记忆障碍;将TET1/2双敲除后,会导致围产期小鼠致死率上升,并伴有外脑畸形、脑出血、生长迟缓[40];TET1/2/3三重敲除后,会导致小鼠神经中胚层及外胚层分化失调[8]。此外,在人胚胎干细胞中进行TET1/2/3三重敲除后,可影响神经发育相关的转录因子Pax6去甲基化[41]。
TET酶介导的DNA去甲基化与相对应的DNA甲基化过程的动态调节对胚胎神经系统发育起到了重要作用。Pax3作为参与神经管形成最重要的基因之一,其表达抑制可导致小鼠神经管畸形(neural tube defect,NTD)发生[42];发育基因GLI2启动子区DNA甲基化程度增高可增加NTD的发生风险[43]。
TET酶损伤的相关疾病大多与神经精神系统相关。前期研究通过对抑郁样行为小鼠模型进行慢性社会失败应激处理,并检测小鼠脑中伏隔核TET1表达量的改变,发现仅应激敏感小鼠会出现TET1表达量的降低[44];研究发现,早发性阿尔兹海默症和额颞叶痴呆患者中存在TET2功能突变[45]。最近有研究发现,TET3突变是智力障碍和颅面异常遗传综合征的致病基础[46]。
4.3 TET酶异常在实体肿瘤中的作用
DNA甲基化及去甲基化失衡会导致多种实体肿瘤的发生发展。TET酶突变导致基因功能丧失和5hmC含量降低是肿瘤发生的重要原因。研究发现,异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)家族中的IDH1和IDH2突变常发生在胶质瘤(gliomas)和AML中,其突变可产生2-羟基戊二酸(2-hydroxyglutarate,2-HG),而2-HG占据了α-酮戊二酸(α-ketoglutarate,α-KG)的活性位点,导致α-KG的活性丧失,进而抑制α-KG的依赖性双加氧酶,包括TET酶家族,导致全基因组组蛋白和DNA甲基化的改变[47](图3)。TET3表达异常会导致神经胶质瘤5hmC水平整体降低,TET3 mRNA水平升高有助于产生更好的预后[48]。此外,在乳腺癌、黑色素瘤和胃癌等多种肿瘤中,均存在TET酶表达异常的现象[49]。

图3 突变IDH1/2调控TET酶模式图[47]Fig.3 Diagram of regulation of mutant IDH1/2 on TET[47]
在儿童肿瘤中,胶质母细胞瘤(glioblastoma)、肝母细胞瘤(hepatoblastoma,HB)等实体肿瘤同样与TET酶关系紧密,引起DNA甲基化和DNA去甲基化失衡,均会促进此类肿瘤的发生发展。研究表明,在胶质母细胞瘤中TET2与5hmC表达均下调,但在肝母细胞瘤中,TET和5hmC均升高,说明TET和5hmC在HB和成人肿瘤中的致瘤机制不同[50-51]。有学者推测,在胚胎发育过程中,TET酶高度表达并抑制分化,进一步推测HB的发生可能是由于分化早期肝脏分化受阻所致[52-53]。
近年来,借助于液体检验技术的快速发展,人们有能力在外周血检测到不同组织的细胞游离DNA(cell-free DNA,cfDNA),这对许多疾病的早期发现和及时干预起重要作用[54]。TET酶介导的DNA去甲基化中间产物5hmC,含量较高且具有较高的稳定性[55],可被考虑作为肿瘤诊断及预后评判的金标准之一[26,56]。虽然有研究表明,小鼠胚胎干细胞中TDG的缺失可导致5caC蓄积至易于检测的水平[57],但相较于5hmC的天然稳定性,其存在明显不足;并且结合上述关于TET在不同疾病中的变化,可以合理推测,5hmC检测技术也可在肿瘤转移及复发中发挥重要作用。但目前通过cfDNA检测5hmC来诊断疾病尚存在许多不足,其实用性证据也仍需进一步验证[58-59]。
5 展望
本文综述了DNA甲基化及去甲基化过程和TET酶在这一过程中发挥的调控功能,并归纳了目前TET在多种疾病中的调控作用,以及其在表观遗传学中的主要研究进展。虽然近年来,人们对DNA去甲基化的机制和功能进行了大量的研究,但仍有一些问题亟待解决:①尽管TET酶已被证实是通过调控DNA甲基化和去甲基化平衡参与调控生长发育和多种疾病,但在生长发育、疾病发展的不同阶段是否起到相同作用及机制尚未阐明;②TET酶及DNA去甲基化过程的中间产物作为潜在的生物标志物,灵敏度、特异性和实用性证据有待证实;③DNA甲基化及去甲基化过程具有非常复杂的机制,由许多不同的物质与TET酶共同调节,但该调控机制及TET酶在其中发挥的作用尚未完全阐明。未来可通过相应的研究阐明上述问题,进一步揭示DNA去甲基化过程,以及TET酶的相关作用机制,进而为疾病诊疗及降低出生缺陷发病率提供新思路。
