油菜双单倍体诱导育种技术研究进展
2022-10-11杨美翠赵诗慧高源石浩然李云龚万灼杨进王继胜邹琼陶兰蓉康泽明唐蓉郭世星付绍红
杨美翠,赵诗慧,高源,石浩然,李云,龚万灼,杨进,王继胜,邹琼,陶兰蓉,康泽明,唐蓉,郭世星,付绍红*
1.成都市农林科学院,成都611130;
2.四川农业大学农学院,成都611130;
3.四川农业大学玉米研究所,成都611130
油菜是世界上主要的油料作物之一,也是我国第一大油料作物。油菜不仅提供人们生活所需的食用油还提供优质的动物饲料蛋白。全球油菜种植主要分布在加拿大、中国、欧洲、澳大利亚、印度等区域。2021年我国油菜种植面积和总产量位居全球第二,占全球油菜种植面积和总产量的20%左右,仅次于加拿大。但由于国内强劲的消费需求,以及国内油菜籽价格明显高于进口,导致我国油菜籽的进口量位居高位,成为油菜籽的主要进口国[1]。我国油菜种植面积增加和单产提高是满足消费需求的两个重要途径。我国油菜单产提高得益于油菜杂种优势的利用和优质高产杂交种的推广应用,从2010年的1 775.1 kg·hm-2提高到2021年的2 104.5 kg·hm-2,年均增长1.5%,单产已高于2 038.5 kg·hm-2的世界平均水平[2],但远低于欧洲油菜平均单产水平。据不完全统计,我国油菜种植品种中杂交种已占到年种植面积的90%以上。因此,持续加强油菜资源创新、优势基因聚合和杂种优势利用对推动我国油菜产业的发展具有重要的作用。
油菜双单倍体诱导技术是近年发展起来的一种快速选育油菜新品种的技术方法,此技术中双单倍体诱导系比单倍体诱导系显示出更大的优势。最早规模化应用的诱导系是玉米单倍体诱导系,利用有性杂交获得单倍体后代,然后人工染色体加倍获得纯系,等位基因纯合的纯系组配杂交种。通过双单倍体诱导技术选育的新品种更具有杂种优势,且杂交种纯度、一致性均能得到保证。油菜双单倍体诱导系作为父本给油菜及十字花科作物母本授粉,能直接获得母本双单倍体后代,省去了染色体人工加倍的环节,加速了育种进程。在甘蓝型油菜中利用此特性可快速选育杂种优势利用的三系亲本,改良品种[3-4]。同时,利用油菜双单倍体诱导系诱导种间及远缘杂交后代,不仅解决了种间及远缘杂交后代结实率低的问题,而且保留了种间及远缘杂交后代丰富的遗传变异,在很大程度上促进了种质资源的创新[5]。因诱导系作为父本诱导时,父本染色体消失,母本染色体加倍而形成双单倍体。利用此特性,油菜双单倍体诱导系被用来介导基因编辑,获得了不含转基因元件的突变双单倍体植株,且克服了基因编辑对于遗传转化的依赖性[6]。此方法的应用能够扩大基因编辑的应用范围,提高基因编辑的效率。
综上,油菜双单倍体诱导技术在杂种优势利用、资源创新和强优势基因聚合的品种改良上都显示出较大应用价值。因此,本文对油菜双单倍体诱导系育种技术从发现到应用的相关研究进行阐述,以期为以后油菜双单倍体诱导系育种技术的进一步研究和应用提供理论依据。
1 油菜双单倍体诱导系的发现
在诸多作物选育和纯系获得的方法中,选育效率和限制因素各不相同,各有优缺点。研究者们一直致力于寻找一种效率高、操作简便、限制因素少的方法,以快速提高油菜的选育效率。Fu等[7]首次在油菜中报道了两个人工合成的异源八倍体甘蓝型油菜(Brassica napus,AAAACCCC,2n=8x=76)Y3380、Y3560,当其作为父本授粉于四倍体甘蓝型油菜(Brassica napus,AACC,2n=4x=38)时,可直接诱导后代产生表型特征和遗传特征与母本一致的植株,其双单倍体诱导率为30%~90%。后来的研究发现该八倍体油菜不仅能诱导四倍体甘蓝型油菜[8]、四倍体芥菜型油菜(Brassica juncea,AABB,2n=4x=36)[9],还能诱导二倍体白菜型油菜(Brassica rapa,AA,2n=2x=20)[10]。因此,华中农业大学傅廷栋院士将其命名为“油菜双单倍体诱导系”。相比单倍体诱导系,该诱导系能直接一步诱导母体获得双单倍体,省去了诱导后代染色体加倍的环节,在一定程度上节约了时间和人力成本,提高了育种效率,具有较大的应用潜力。
油菜双单倍体诱导系[7]是经过种间杂交和染色体加倍人工合成的异源八倍体。通过甘蓝型油菜F009(母本)与白菜型油菜YH(雅安黄,父本)种间杂交,杂交F1利用染色体加倍处理获得稳定遗传的早代稳定系P3-2(F3)[11]。以P3-2为母本与杂交F1(1325×香港菜心)杂交获得聚合杂交种F1,以P3-2为母本与杂交F1(4247×1356)获得聚合杂交F1,用秋水仙素加倍处理获得八倍体Y3380和Y3560。利用这两个八倍体给质不育、核不育、F1杂交材料以及常规稳定材料授粉,发现后代材料均出现不同程度的稳定株系。通过田间表型、流式细胞术、SNP芯片技术手段证实,这些杂交或测交后代的表型、倍性、基因型均与母本一致,经反复验证该现象能稳定获得。利用7个不育系验证该双单倍体的诱导效率在30%~90%,存在一定母体基因型互作效应,且在诱导后代中发现了1%左右的单倍体[7,12]。
2 油菜双单倍体诱导系的表型、遗传特性及诱导机制
油菜双单倍体诱导系是世界上首次报道的人工合成八倍体油菜,同四倍体甘蓝型油菜比较,属于多倍体,其表型特征具有特异性。八倍体油菜因染色体经过了人工加倍,其倍性高,且属同源染色体加倍,遗传容易出现倍性分离或染色体遗传不稳定。但经过十余年的自交和人工选育仍然能获得八倍体,其遗传稳定性和表型特征对多倍体的进化研究具有一定价值。
2.1 油菜双单倍体诱导系的遗传学特性
油菜双单倍体诱导系从来源上是异源八倍体,从加倍过程来看是同源个体的加倍,通过体细胞荧光原位杂交观察其染色体组成得以证明。通过有丝分裂、减数分裂观察诱导系及其自交后代的染色体数目和染色体行为,并检测了诱导系花粉的发育情况,证明其存在一系列异常行为。此外,分析诱导系Y3380和Y3560及其亲本P3-2的甲基化模式,证明了其八倍体的遗传事实和不同于正常四倍体的表型和遗传特性。以上结果及遗传学表现详见表1。

表1 油菜双单倍体诱导系的遗传学特性Table 1 Genetic characteristics of double haploid induction lines in rapeseed
研究观察到诱导系的减数分裂行为异常,此异常行为是造成自交后代染色体数减少以及混倍体产生的重要原因。在自交后代中出现了1%~3%的混倍体异常现象,在混倍体植株中发现染色体数目有差异的不同细胞,且这些细胞的染色体数目不存在整倍关系。同时,发现混倍体的有丝分裂和减数分裂都表现出了一定的染色体异常行为,而这些异常行为造成了非整倍体花粉的产生[13-14],这可能是诱导系花粉具有诱导能力的关键。
2.2 油菜双单倍体诱导系的表型特征
八倍体的双单倍体诱导系和四倍体甘蓝型油菜在外观上大致相同,但在具体表观上存在一定的差异[13]。八倍体油菜相比四倍体油菜,生育期延长,植株矮壮,叶片大、厚且卷曲,主序短,一次分枝数少,角果粒数少,角果短,且单株角果数只是四倍体的三分之一;花器官较大,花粉粒更大、更多;部分花粉萌发孔不对称地分布在花粉壁上,超过98%的花粉粒因为花粉壁突变而导致花粉萌发孔从3个增加到4个,少数花粉粒甚至有5个及以上的花粉萌发孔,且花粉粒的体外萌发和花粉管的伸长较四倍体更快,这可能与萌发孔的数量更多有关。同时,八倍体油菜花粉活性能到达90%以上,种子发芽率高达93%。总体而言,八倍体油菜能正常生长和发育,这可能是八倍体植株能得以正常繁殖的关键。
2.3 油菜双单倍体诱导系诱导的胞质效应
油菜双单倍体诱导系作为父本对不同母本存在诱导效率差异,诱导过程与母本的基因型、胞质类型存在互作效应[16-17]。当母本细胞质基因一致,发现诱导效果受到核基因的影响。当母本核基因相同时,诱导差异主要受到细胞质基因影响。通过诱导系对相同核基因的波里马细胞质不育系0933A(pol胞质)、萝卜胞质不育系萝0933A(Ogura胞质)以及保持系0933B(Nap胞质)进行诱导,发现0933B(Nap胞质)作为母本的诱导效果最好,萝0933A(Ogura胞质)作为母本的诱导效果最差。诱导后代SNP纯度检测结果显示,波里马胞质0933A(pol胞质)作为母本时诱导后代的SNP位点纯合率最高,都高于母本且没有父本基因的渗入。而萝卜胞质0933A(Ogura胞质)的诱导后代SNP位点纯合率均低于母本,但存在部分父本基因的渗入现象。可育胞质0933B(Nap胞质)诱导后代SNP位点纯合率基本不变,与母本相近。由此可知,诱导系的诱导效率与母本胞质类型存在明显的胞质效应互作关系,波里马胞质诱导的效果比萝卜胞质更稳定;诱导系诱导的胞质效应为利用诱导系同步选育不育系和保持系奠定了基础。
2.4 油菜双单倍体的诱导机制
对油菜双单倍体诱导机制进行研究,向诱导系中转入标记基因(epsps-cp4),并在受精及胚胎发育过程中跟踪该基因,通过诱导后代的多态性分子标记、荧光原位杂交、SNP分析等大量的实验发现,授粉早期胚胎中95%左右的胚胎能检测到标记基因,随着胚胎的发育,标记基因会不断地丢失,同时伴随胚胎的大量死亡,最后形成的种子中不含有标记基因,且对应的父本染色体也发生了专一性的丢失。因此,可以推断授粉过程中诱导系花粉的精细胞进入母本胚囊,与卵细胞融合受精后形成合子,在合子有丝分裂过程中,父本染色体发生专一性丢失,丢失过程中可能通过同源交换或转座子跳跃存在部分父本基因渗入到母本基因组的现象,之后合子单倍体基因组发生早期加倍现象,加倍后的合子继续发育成完整胚胎,最终形成双单倍体后代[14,18]。但父本的染色体有可能丢失不完全,发生父本染色体渗入现象;或者父本染色体丢失未完成就发生加倍,容易形成部分染色体片段杂交的情况。Zhao等[19]在玉米诱导系诱导获得单倍体的研究中,发现授粉诱导一周的单倍体胚内大多数父本染色体消失;同时,在一个单倍体里发现有44 bp父本染色体片段的插入。Li等[20]在玉米诱导系诱导的后代中,发现渗入的DNA来自诱导系,染色体消除可能是玉米单倍体诱导的原因。
在油菜双单倍体诱导系机理的进一步研究中,发现非整倍体影响诱导系的诱导能力。混倍体双单倍体诱导系相比八倍体诱导系,降低了F1代的父本渗入率和杂交位点率,使后代不易渗入父本基因。这可能是由于混倍体油菜在减数分裂四分体时期易形成核外染色体,增加了非整倍体配子产生概率,而非整倍体配子不稳定,在后期雌雄配子融合过程中,更加容易发生染色体的丢失,从而导致F1代父本渗入率降低[14]。由此可知,非整倍体配子能够提高诱导系的诱导能力,且花粉产生非整倍体配子可能是油菜具有诱导能力的重要原因。同样地,在玉米单倍体诱导机制研究中也有相似的推断。Li等[21]研究玉米单倍体发现诱导系花粉三核阶段具有高频率的非整倍体,认为单倍体诱导可能和花粉的非整倍体有关联。在玉米和油菜中都发现非整倍体的雄配子对诱导有促进作用,那么八倍体油菜产生诱导现象是由于父本的倍性造成的非整倍体配子,还是由功能基因控制的?通过试验发现,Y3380、Y3560的诱导能力来自它们共同的亲本P3-2(早代稳定系)[8,11],该亲本具有7.8%的诱导能力,而染色体加倍提升了诱导效果,其他与P3-2无亲缘关系的六倍体或八倍体几乎无诱导能力,或有诱导能力但自身不能自交繁殖,存在明显的结实障碍[14],说明油菜双单倍体高诱导能力可能是基因遗传和染色体加倍的共同作用结果。
3 油菜杂种优势利用中获得纯系的途径
优质、多抗、优势基因聚合的亲本选育和等位基因的纯合,是培育强优势杂交种的前提,也是油菜杂种优势利用的关键。油菜杂交育种获取纯系的方法一般包括常规选育、小孢子离体培养和种间远缘杂交诱导单倍体等。近年来发现的油菜双单倍体诱导系在获得油菜纯系上显示出巨大的优势,对促进油菜杂种优势利用具有巨大的推动作用。
3.1 常规选育
传统的纯系选育是连续世代的近交,主要有系谱法和单粒传法。系谱法从杂种第一次分离世代开始选株,然后分别种成株行,形成系统,以后各世代均在所选优良系统中选择优良单株,直到选出性状优良一致的系统。在选择的过程,选中的单株及系统都予以编号,这有利于考察株系的历史和亲缘关系。但系谱法每一代都需要进行选择,费时费力,工作繁琐,至少五代以上等位基因才能达到纯合状态。
相比系谱法,单粒传法是一种简单且有效的近交繁殖选育方式,经过系谱法改良而来[22],其每个世代的每个单株只选择一粒种子繁殖下一代。作为一种快速世代改良方法,单粒传法避免了自交世代的选择,一般在第六代之后出现最有利于选择的一代,才开始选择[23],这使得选育工作简单又省时省力。由于前期没有选择,得到群体的每个单株可追溯到每一个株系的原始单株。但是这样的选择易受到限制,容易漏选优异变异,且到了后期,工作量巨大。
这样的连续世代近交能增大基因重组的频率,增加选到最佳重组组合的机会。但如果目的基因存在连锁,在连续世代的选择过程中,可能会丢失有利基因。此外,这样的近交系选育耗时耗力,选育年限长、效率低、盲目性大。
3.2 油菜小孢子离体培养
目前,作物杂交亲本等位基因的快速纯合常用体外单倍体培养技术。体外单倍体培养技术主要包括花药培养和小孢子离体培养。1964年,Guha和Maheshwar[24]利用花粉培养首次得到单倍体毛曼陀罗(Datura innoxiaMiller)植株。1982年Lichter[25]首次报道用甘蓝型油菜(Brassica napus)离体小孢子获得单倍体。通过花粉小孢子离体培养获得的单倍体,经过人工加倍就能获得双单倍体(DH系/纯系)。相比小孢子离体培养,花药培养产胚率低,易受花药壁等体细胞组织影响。Siebel和Pauls[26]在甘蓝型油菜中进行了花粉培养和小孢子离体培养的比较,发现小孢子离体培养的产胚率是花粉培养的2~10倍,小孢子离体培养的效率更高。小孢子离体培养是应用最普遍的体外单倍体获取途径,在小麦(Triticum aestivum)、大麦(Hordeum vulgare)、烟草(Nicotiana tabacum)和油菜等作物上得到了广泛应用。
相比传统的选育需要6~8年才能获得纯系,小孢子离体培养产生的单倍体经过秋水仙素处理,即可获得纯系,在很大程度上节省了时间,加速了育种进程。但同时,小孢子离体培养也受到了一些限制[27-28],如供体植株的生长条件、供体植株基因型、小孢子的发育阶段、培养基的组成成分、培养条件、培养环境和预处理等因素均会影响胚状体发育和单倍体的产生。同时,秋水仙素具有毒性,在操作上也受到一定的限制。这些因素致使小孢子培养的诱导率、染色体加倍效率低。此外,小孢子培养会受到环境和基因型的限制,应用普及受限。
3.3 油菜种间远缘杂交
在植物中可以通过种间杂交,获得母体单倍体,该方法在小麦和大麦中发现并得到了较好的应用。Symko[29]用球茎大麦(Hordeum bulbosum)作为父本给大麦授粉,获得了大麦单倍体。Gupta和Fedak利用芒颖大麦草(Hordeum jubatum)和小黑麦(Triticosecale wittmack)杂交,得到大麦草单倍体[30]。Bains等[31]将小麦和玉米杂交,通过胚挽救法得到了小麦单倍体。在油菜中母体单倍体的产生也早有发现和研究,在1928年Noguchi[32]和Mohammad等[33]在油菜等芸薹属(Brassica)植物中观察到孤雌生殖现象。Olsson等[34]和Ramanujam等[35]在甘蓝型和白菜型油菜田中找到了孤雌生殖来源的天然单倍体。Stringnm等[36]研究了油菜单倍体自然发生的频率,发现甘蓝型油菜的孤雌生殖发生频率为0~0.364%。四川大学罗鹏教授用远缘花粉授粉,特别是同属异种花粉授粉的方式,诱发孤雌生殖单倍体,诱发频率较高。该团队选用白菜型鄱阳油菜花粉给甘蓝型胜利油菜授粉,其诱发频率为1.25%,并利用获得的单倍体加倍选育得到了油菜纯合自交系“3529”“9316”,利用“3529”自交系与“奥罗”“非洲12”杂交组配出了强优势组合[37]。但该方法诱导效率极低,在生产上少有成功应用的报道,限制了育种家利用该技术开展广泛育种实践的可能。
3.4 单倍体诱导基因
1958年,Coe[38]首次报道了玉米单倍体诱导系Stock6,其诱导率在1%~2%之间。之后在Stock6基础上进行改良,在玉米中衍生出了CAUHOI、WS14、RWS和MHI等[20]一批优质的高诱导率诱导系,并广泛应用于玉米自交系的选育中。近年来,经过国内外科学家的不断努力,已经成功克隆了诱导玉米单倍体的相关功能基因(MATL/ZMPLA1/NLD和ZmDMP)[39-40],同时在拟南芥(Arabidopsis thaliana)中也发现可以促进单倍体发生的关键基因CENH3[41]。Li等[42]利用带有绿色荧光蛋白的CRISPR/Cas9载体敲除甘蓝型油菜Westar中4个与玉米DMP具有相同结构域的BnaDMP基因以创制甘蓝型油菜单倍体诱导系,产生的BnaDMP突变体在T0、T1和T2代的单倍体诱导率达到2.53%。
母本体内和体外产生的单倍体,需加倍为双单倍体形成纯系。单倍体加倍的方式有人工加倍和自然加倍两种,自然加倍发生的频率很低。Wu等[43]在单倍体诱导系CAUHOI做父本诱导玉米时,在诱导后代中发现了早期双单倍体植株(自然加倍),但其自然加倍频率极低,不超过0.1%。
4 油菜双单倍体诱导系在油菜品种选育中的作用
4.1 快速选育甘蓝型油菜保持系、恢复系
利用油菜双单倍体诱导系可快速选育恢复系和保持系。首先,确定甘蓝型油菜恢复系和保持系选育的目标性状,将至少两个具有目标性状的甘蓝型油菜杂交或聚合杂交,根据目标性状要求进行回交或多代回交,形成杂交后代、聚合杂交后代或回交后代。然后用诱导系诱导这些杂交或回交后代,得到的诱导后代再自交,即可获得稳定系。此稳定系再与核不育系或质不育系进行测交。若测交后代全可育则得到的稳定系为恢复系;若测交后代全不育,则得到的稳定系为保持系。利用此诱导系已获得波里马细胞质不育恢复系C2859、核不育恢复系C2994、波里马细胞质质不育保持系B4653、萝卜细胞质不育恢复系C4707,此外,还利用所选育的波里马细胞质不育恢复系C2859与蓉A0068配组,选育了双低优质甘蓝型油菜旺成油8号[3,44]。
4.2 快速同步选育甘蓝型油菜胞质不育系和保持系
在研究中发现,油菜双单倍体诱导系诱导nap胞质纯合母本,其诱导后代会同时出现表型基本一致的可育和不育株,利用60K SNP芯片分析该不育和可育单株,其遗传相似系数超过90%,最高可达98%,推测可育和不育是保持系和不育系的关系,并自交和姊妹交,同步选育出了保持系和不育系[45]。通过重测序和线粒体染色体组装,线粒体共线性分析不育系和保持系转化的原因,发现原有的保持系线粒体发生了重排,导致其从可育变成了不育。诱导系诱导杂合母本具有相似的结果。这一现象的发现为油菜快速同步选育保持系和不育系提供了新途径,也为种质资源的创新提供了新模式。
先用已知待改良的甘蓝型油菜细胞质保持系或不育系作母本与其他具有优良性状的甘蓝型油菜杂交或测交,再用油菜DH系对产生的F1代进行授粉诱导,产生核基因纯合的F2代单株。然后筛选具有优良品质的F2代单株并自交,得到的F3代出现育性分离,并从中筛选出遗传相似系数大于95%的可育与不育株,进行姊妹交。当姊妹交后代全不育及完全可育后代不再分离不育单株时,则得到核基因一致的不育系和保持系。当完全可育单株后代依旧分离为不育和可育后代时,则重复进行多个单株的成对姊妹交,直到不再分离。这样不仅能快速同步选育新品种,也可最快在2~4代左右获得稳定、纯合的保持系与不育系[4],但如果用诱导系诱导杂合的不育单株,出现了优良的不育系,没有成对等位的保持系保持不育状态,也可用高诱导能力的诱导系作为万能保持系,以使保持多个不育的不育状态并维持核基因组的遗传稳定性[46]。
4.3 在种间及远缘杂交获得甘蓝型油菜育种资源中的应用
油菜及十字花科作物远缘杂交可产生大量的遗传变异,是种质资源创新的有效途径。远缘杂交存在生殖障碍现象,包括杂交不亲和、杂种不育。有研究发现,甘蓝型油菜与白菜型油菜杂交,产生三倍体的甘白杂交后代,此杂交后代表现出自交不结实或结实率低等现象[5]。经过油菜双单倍体诱导系诱导甘白杂交F1代,得到的诱导后代为四倍体甘蓝型油菜,其拥有大量来自白菜型油菜的遗传特性且遗传稳定。该诱导过程利用种间或远缘杂交中杂交F1代雌配子遗传稳定性强于雄配子的普遍自然现象,借助诱导系的诱导实现母体卵细胞的加倍,使孤雌生殖获得稳定遗传后代。诱导系诱导使种间杂交后代快速达到纯合稳定状态,缩短了育种年限,避免了因分离世代长且不稳定而丢失有益变异的问题。因此,诱导系诱导可使种间杂交后代快速得到遗传稳定纯系,并保留了亲本丰富的遗传变异,拓宽了种间杂种后代的遗传距离[5,47],对油菜及十字花科作物的遗传改良具有极大的促进作用。
4.4 油菜双单倍体诱导系在基因编辑中的应用
依赖转基因的基因编辑技术是研究基因功能以及作物性状改良的重要工具。其中CRISPR/Cas9系统被广泛应用于许多作物中精确修饰重要的农艺性状[48]。基于诱导系作为父本授粉诱导时,父本染色体在受精后选择性消失的诱导作用机制,出现了单倍体诱导系介导的CRISPR/Cas9编辑系统(HI-Edit system)[49],CRISPR载体导入到单倍体诱导系,诱导系作为父本授粉诱导需要改良的母本,就得到了性状被改良且没有Cas9载体的单倍体。Li等[50]首次利用油菜双单倍体诱导系介导的CRISPR/Cas9基因编辑系统对油菜及甘蓝基因进行直接修饰。此方法利用农杆菌介导构建基因编辑载体,然后将基因编辑载体遗传转化到油菜双单倍体诱导系Y3380中,此转基因诱导系作为父本给甘蓝和甘蓝型油菜授粉,父本染色体在受精后消失,基因编辑元件随着染色体消失而消除,之后母本染色体加倍,最后得到不含转基因元件的突变的双单倍体植株,编辑效率最高可达12.97%。此方法不仅绕过了自交多代获得纯合体的过程,且对重要的育种材料进行直接或批量基因编辑而不依赖于受体的遗传转化效率,这为CRISPR/Cas9基因编辑系统在多种植物的应用提供了新思路[6,50]。但利用此方法获得的编辑后代没有实现突变体位点的等位基因纯合,推测编辑过程发生在母本染色体加倍之后。
5 展望
诱导系诱导母体产生单倍体或双单倍体,对作物育种特别是等位基因的快速纯合具有巨大的作用。首次报道的诱导系是玉米单倍体诱导系Stock6[38],诱导率仅为2%。迄今为止,由Stock6衍生出了许多高诱导率的单倍体诱导系,诱导率可达到16%~30%[51]。单倍体诱导技术已成为玉米工程化、规模化育种的重要技术手段,科学家经过不断地努力已挖掘到两个诱导相关的功能基因,即玉米花粉特异性磷脂酶A基因MATRILINEAL(ZMPLA1)和编码DUF679结构域的ZmDMP基因,现已将这两个基因的应用拓展到了其他作物上。此外,在模式植物拟南芥中开发了一种着丝粒介导染色体消失产生单倍体的方法。表2为单倍体诱导系和双单倍体诱导系的作用机制及应用。
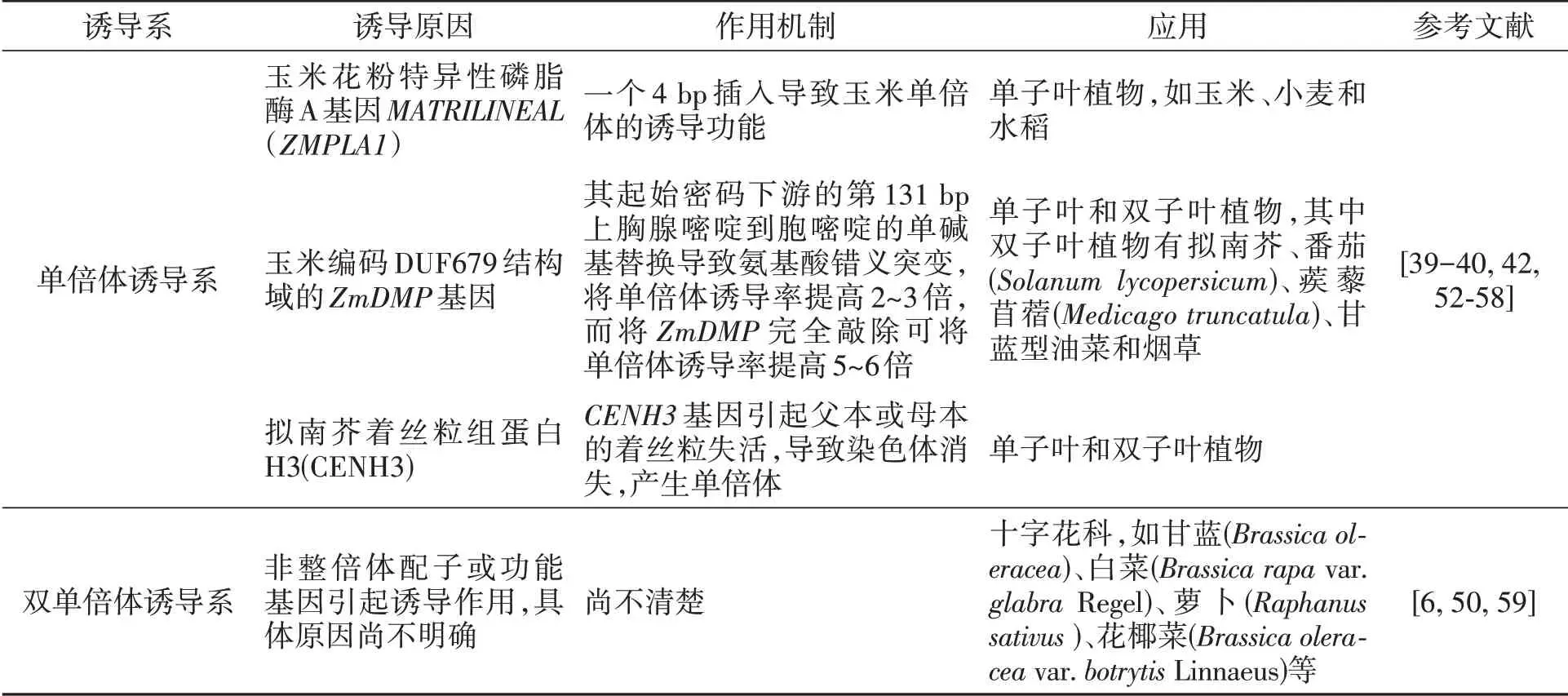
表2 诱导系的作用机制及应用Table 2 Mechanism and application of induction lines
除玉米之外,单倍体诱导系在其他作物包括双子叶作物上也得到了应用。但对于像甘蓝型油菜这样的多倍体植物,由于基因冗余现象,很难利用基因编辑技术对ZmDMP和CENH3基因进行编辑而实现高水平的母本诱导,因此需要开发更多的具有诱导能力的功能基因。
在油菜上报道的双单倍体诱导系Y3380、Y3560,其诱导率达30%~90%。此诱导系可直接省去染色体加倍的环节得到纯系,在一定程度上缩短了育种时间,促进了育种进程,具有非常大的应用潜力。油菜双单倍体诱导系,除在甘蓝型油菜直接应用外,在十字花科作物也得到了应用,这是目前唯一的直接利用花粉实现跨作物诱导的应用。目前,双单倍体诱导系正在更多作物上进行应用探索。同时,相关双单倍体诱导的功能基因的定位和克隆研究也正在进行之中,为未来的油菜、十字花科及其他作物应用该基因奠定了基础。
