高水分挤压温度对绿豆蛋白结构的影响
2022-10-11张俊杰郑嘉琛谢宜桐罗文江刘丹怡韩建春
张俊杰,郑嘉琛,谢宜桐,罗文江,张 媛,何 熙,刘丹怡,韩建春,
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.哈尔滨酷豆食品科技有限公司,黑龙江哈尔滨 150028;3.北京银星通达科技开发有限公司,北京 100088;4.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028)
肉类是人类重要的食品资源,然而人口增加以及肉类生产导致环境变化和自然资源的枯竭使得人造肉作为肉类替代品成为趋势。人造肉是动物肉的健康替代品,不含胆固醇,脂肪含量低,蛋白含量高,更加满足现代人对健康饮食的需求。高水分挤压是生产人造肉的一种技术,它主要以植物蛋白为原料,生产出具有肉类纤维、口感和风味的组织化植物蛋白(Texturized vegetable protein,TVP)。目前,国内外市场上主要的产品是低水分挤压技术生产的植物组织化蛋白产品,比如辣条、豆干等。由于高水分挤压技术对原料、设备要求较高,市场上还未出现成熟的产品,对TVB 产品的开发仍然停留在试验阶段。
绿豆富含蛋白质、淀粉、维生素,是我国重要的食用豆类作物。目前,我国对绿豆利用主要是制取绿豆淀粉,而绿豆蛋白(Mung bean protein,MBP)粉作为加工副产物,常被用做动物饲料或丢弃,造成了蛋白资源的浪费。绿豆蛋白约占绿豆(干重)的25%~28%,含有丰富的必需氨基酸,如赖氨酸、亮氨酸。MBP 具有多种生理活性,如抗癌、抗氧化和抗增殖。MBP 表现出优异的功能特性,是各种食品加工中有潜力的原料。经超声处理过的绿豆蛋白具有良好的溶解性和稳定性,可以作为高蛋白饮料的原料。乔宁等将绿豆蛋白添加到熟制速冻水饺中,改善了速冻水饺的品质和储藏性能。Fhb 等研究了加水量对组织化绿豆蛋白结构和流变学性质的影响,认为49.3%的加水量有利于改善产品的特性。在高水分挤压过程中,通过改变螺杆转速、喂料量、挤压温度等工艺参数可以得到不同质地的产品。挤压温度是蛋白质形成纤维结构的重要因素,决定了蛋白质变性的剧烈程度。目前,用大豆蛋白、豌豆蛋白和谷朊粉通过高水分挤压生产的TVP 较为常见,而关于绿豆蛋白在高水分挤压生产TVP 的研究很少。
绿豆蛋白比其它植物蛋白有较多优点,以其作为食品原料开发新产品的潜力巨大,并且植物蛋白组织化机理尚未完全阐明,特别是在挤压过程中蛋白质之间发生的相互作用和蛋白质结构改变的机制。因此本试验以绿豆蛋白粉为原料,研究不同高水分挤压温度对组织化绿豆蛋白结构的影响,旨在为高水分组织化绿豆蛋白产品开发以及植物蛋白组织化形成机理提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
绿豆蛋白粉(蛋白质含量70.8%,脂肪0.6%、碳水化合物19.3%) 哈尔滨哈达淀粉有限公司;SDSPAGE 凝胶制备试剂盒、彩虹245plus 广谱蛋白Marker、考马斯亮蓝G-250、EDTA、牛血清蛋白北京索莱宝科技有限公司;Tris、Gly(甘氨酸) 北京博奥拓达科技有限公司;DTNB(5,5-二巯基-2,2-二硝基苯甲酸) 上海源叶生物科技有限公司;磷酸二氢钠、磷酸氢二钠、尿素等试剂均为国产分析纯。
FMHE36-40 高湿挤压设备 湖南富马科食品工程技术有限公司与黑龙江省绿色食品科学研究院联合创制;ALPHA 1-2 LD plus 冷冻干燥机 德国Christ 公司;Nicolet is50 傅里叶变换红外光谱仪赛默飞世尔科技(中国)有限公司;F-7100 荧光分光光度计 日本日立公司;3-18K 高速冷冻离心机Sigma 公司;SDS-PAGE 电泳仪 美国Bio-Rad 公司;TU-1810 紫外可见光分光光度计 北京普析通用仪器有限责任公司;S-3400N 钨灯丝扫描电子显微镜 日本日立公司。
1.2 实验方法
1.2.1 样品制备 以绿豆蛋白粉为原料,挤压参数:固体喂料量6.5 kg/h、液体喂料量190%、螺杆转速180 r/min,挤压温度从温区2 到温区6 以及温区9、温区10 保持不变,分别设置为50、80、100、120、130、120、120 ℃,控制温区7、温区8 的温度同步变化(文中的挤压温度指温区7、8 温度),各水平设置为130、140、150、160 ℃。将挤压出的组织化绿豆蛋白(Texturized mung bean protein,TMBP),迅速冷却,真空包装密封,放入4 ℃冰箱中保存。各取一部分TMBP 冷冻干燥,研磨后过80 目筛,于-20 ℃冰箱中保存备用。在挤压温度为130、140、150、160 ℃条件下得到的TMBP 分别编号为:TMBP-130 ℃、TMBP-140 ℃、TMBP-150 ℃、TMBP-160 ℃。
1.2.2 化学作用力的测定 根据Wang 等的方法。取0.2 g MBP 和TMBP 冻干粉分别与10 mL 的0.05 mol/L NaCl(A)、0.6 mol/L NaCl(B)、0.6 mol/L NaCl+1.5 mol/L 尿素(C)、0.6 mol/L NaCl+8 mol/L尿素(D)溶液混合,振荡均匀后,4 ℃冰箱静置2 h,于10000×g 离心15 min,取上清液测定其吸光度。用双缩脲法测定上清液中蛋白质含量。离子键、氢键、疏水相互作用的大小用公式(1)~(3)计算:

式中:A、B、C、D 分别表示A、B、C、D 溶液上清液中蛋白质含量(mg/mL)。
1.2.3 巯基、二硫键含量的测定 根据张媛等的方法。总巯基的测定:将75 mg MBP 和TMBP 冻干粉分别溶于15 mL Tris-Gly-Urea 缓冲液(0.086 mol/L Tris、0.09 mol/L Gly、8 mol/L Urea 和0.04 mol/L EDTA,pH8.0)中,加入0.1 mL Ellamn 试剂(0.2 g DTNB 溶于50 mL Tris-Gly-Urea 缓冲液),混匀,避光1 h,4 ℃下10000 g 离心15 min。取上清液测蛋白含量。另取上清液,412 nm 条件下用紫外分光光度计测其吸光度(A)。
游离巯基的测定:将75 mg MBP 和TMBP 冻干粉分别溶于15 mL Tris-Gly 缓冲液(0.086 mol/L Tris、0.09 mol/L Gly 和0.04 mol/L EDTA,pH8.0)中,加入0.1 mL Ellamn 试剂(0.2 g DTNB 溶于50 mL Tris-Gly 缓冲液),混匀,避光1 h,4 ℃下10000 g 离心15 min。取上清液测蛋白含量。另取上清液,412 nm 条件下用紫外分光光度计测其吸光度(A)。
根据公式(4)计算巯基含量:
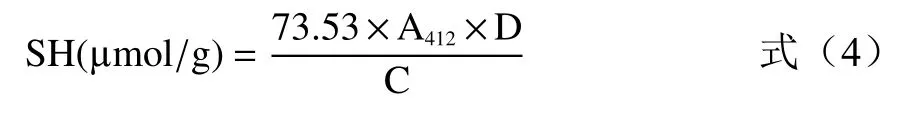
式中:SH 为巯基含量;73.53—Ellamn 试剂摩尔消光系数;D 为稀释倍数;C 为蛋白含量(mg/mL)。
根据公式5 计算二硫键含量:
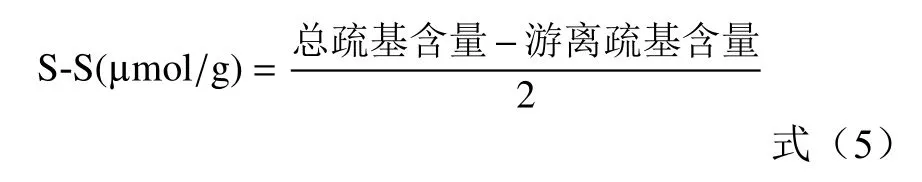
式中:S-S 为二硫键含量。
1.2.4 傅里叶变换红外光谱 根据Brishti 等的方法,用傅里叶变换红外光谱仪对冻干的样品在波长范围4000~500 cm,分辨率为4 cm,扫描次数32 次。利用Omnic 8.0 和Peakfit 4.12 软件进行光谱图分析,经过基线校正、平滑处理、去卷积、对酰胺Ⅰ区(1700~1600 cm)的二阶导数进行Gaussian 曲线拟合,通过各子峰面积百分比,计算出样品二级结构组成。各子峰与二级结构关系:1615~1640 cm为-折叠,1641~1649 cm为无规则卷曲,1650~1659 cm为-螺旋,1660~1688 cm为-转角。
1.2.5 内源荧光光谱 根据Qi 等的方法。将MBP和TMBP 冻干粉溶于磷酸钠缓冲液(33 mmol/L,pH6.75)中,制备蛋白质分散体(10 mg/mL),经 8000 g离心15 min,收集上清液并用一次性针头滤器(0.45 μm)过滤。荧光分光光度计在激发波长为295 nm、扫描速度为1200 nm/min、激发和发射狭缝宽度为5 nm 的条件下,记录300~450 nm 范围内的发射光谱。
1.2.6 SDS-PAGE 测定 根据王超的方法。将MBP 和TMBP 冻干粉过80 目筛,分别取2 mg 溶于1 mL 上样缓冲液中,然后在沸水浴中加热10 min,8000 g 离心10 min。进样时取上清液10 μL,浓缩胶5%、分离胶13%,电压采用浓缩胶80 V 和分离胶120 V 进行电泳。
1.2.7 扫描电镜观察 根据杨竺红的方法并做适当的修改。将新鲜的TMBP 样品切片后,用戊二醛固定,在用pH6.8 磷酸缓冲液冲洗、乙醇脱水、置换、干燥处理后,将样品固定在样品台上,然后镀膜,最后用扫描电子显微镜将样品放大1500 倍后,观察其表观形态。
1.3 数据处理
本研究采用软件SPSS 22.0 和Origin 2019 对实验数据用进行分析与作图,三次重复独立试验结果表达形式为平均值±标准差(Means±SD),用SPSS 22.0 进行差异显著性分析,<0.05 表示差异显著。
2 结果与分析
2.1 化学作用力的测定
如图1 可知,三种化学作用力由大到小依次为:疏水相互作用>离子键>氢键。疏水相互作用的可溶性蛋白含量均大于9 mg/mL,明显高于氢键和离子键,表明在这三种化学作用力中疏水相互作用是维持组织化蛋白空间结构的主要作用力。蛋白高水分挤压处理后,疏水相互作用显著增加(<0.05),挤压过程促进了蛋白质疏水性基团的暴露,导致了蛋白疏水相互作用的增强。随着温度的升高,TMBP 中疏水相互作用先增加后减小,可能是过高的温度使得蛋白质空间结构发生变化,更多的疏水基团暴露并发生聚集,疏水基团再次被包埋在蛋白内部,结构变得更加复杂,进而导致蛋白疏水相互作用的降低。离子键在高水分挤压处理后,含量显著增加,随着挤压温度的升高,离子键含量呈先上升后下降的趋势,但变化不显著。离子键可以维持TMBP 的三级结构,变化趋势与疏水相互作用变化趋势相同,离子键含量的减少,说明蛋白质发生了聚集,验证了疏水相互作用下降的原因。高水分挤压后氢键的含量显著增加,是因为高水分挤压处理使得大量的水分子存在于组织化蛋白网络结构中,有利于水分子之间、水分子和蛋白质之间氢键的形成。在130 和140 ℃疏水相互作用含量较高,有利于蛋白组织化。
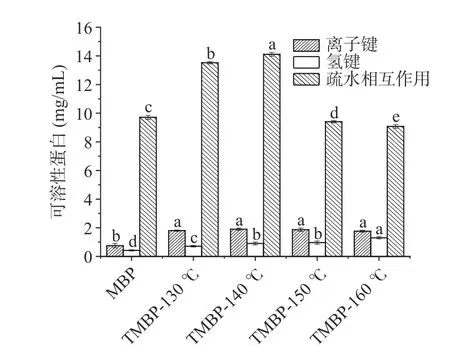
图1 挤压温度对化学作用力的影响Fig.1 Effect of extrusion temperature on chemical force
2.2 巯基、二硫键含量的测定
在挤压过程中,分子内和分子间的巯基和二硫键相互转化,影响着蛋白质的构象和稳定性。挤压温度是影响组织化蛋白构象变化的重要原因之一,由表1 可知,随着挤压温度的升高,游离巯基含量先显著降低(<0.05),可能是由于巯基发生了氧化反应形成了硫氧化物以及蛋白质和蛋白质之间发生了聚集。随着挤压温度的增加,总巯基含量先显著上升(<0.05),游离巯基含量先显著降低(<0.05),表明隐藏在蛋白质内部的巯基暴露并且与游离巯基间相互交联形成新的二硫键,从而导致二硫键含量先显著上升(<0.05)。随着二硫键含量的增加,游离巯基的含量降低,表明巯基二硫键之间发生交换反应,形成了新的二硫键。当温度继续升高,新形成的二硫键会被破坏,导致了游离巯基含量的增加。可知,不同温度处理会导致组织化蛋白的巯基暴露程度不同,通过巯基、二硫键的相互转化以及巯基氧化所导致蛋白质不同程度的聚集,影响着蛋白质结构。在130 ℃时,二硫键含量最高,有利于蛋白质组织化。

表1 MBP 和TMBP 的巯基、二硫键含量Table 1 Sulfhydryl group and disulfide bond contents of MBP and TMBP
2.3 傅里叶红外光谱分析
傅里叶红外光谱常用来表征蛋白质结构和构象,4000~400 cm范围内的红外光谱是由于化学键的拉伸和弯曲运动吸收能量产生的。图2 显示了TMBP 和MBP 的傅里叶红外光谱。所有光谱都在3500~3000 cm范围内显示出一个宽峰,说明有淀粉存在,同时峰的存在也与游离和结合的O-H 和NH 基团有关。TMBP 与MBP 相比,在3269.24 cm处的吸收峰降低,说明淀粉结构遭到破坏。在2990~2850 cm附近的峰通常与蛋白质侧链中的CH拉伸有关。在红外光谱中,有典型的蛋白质条带:酰胺Ⅰ带(1700~1600 cm)、酰胺Ⅱ带(1580~1500 cm)、酰胺Ⅲ带(1400~1200 cm)。
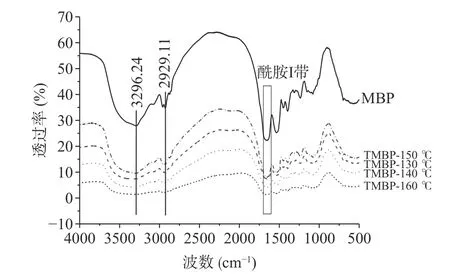
图2 MBP 和TMBP 的红外光谱图Fig.2 Infrared spectrum of MBP and TMBP
样品红外光谱拟合的二级结构含量如表2 所示,绿豆蛋白的-折叠含量高,-螺旋含量最低,表现出典型的植物蛋白结构,这与Ma 等研究结果相一致。-折叠含量高,会导致蛋白水解酶的获取率低,蛋白的消化率低。在不同温度下,经高水分挤压处理后的蛋白,二级结构中各组成的含量都发生了变化。TMBP-130 ℃与MBP 相比,-折叠含量略微减小从33.423%±0.098%变为33.401%±0.139%。TMBP-140 ℃与MBP 相比,-折叠含量显著降低(<0.05),-螺旋和-转角含量显著增加(<0.05),无规则卷曲含量变化不显著(>0.05)。这表明部分-折叠结构转化成-螺旋结构和-转角结构,表明蛋白结构更加紧密。随着温度的继续升高TMBP的-折叠含量和-转角含量变化显著(<0.05),而-螺旋含量变化不显著(>0.05)。Hossain 等研究加水量对单螺杆挤压绿豆蛋白二级结构变化也有类似发现。-折叠含量的显著降低,表明蛋白质分子之间的化学键断裂、原始构象展开,提高蛋白的消化率,导致蛋白的变性以及随后的聚集。-转角含量的显著增加,表明挤压温度继续升高,在组织化过程中蛋白-蛋白发生聚集,结构不稳定。

表2 MBP 和TMBP 的二级结构Table 2 Secondary structure of MBP and TMBP
2.4 内源荧光光谱分析
荧光光谱可以提供色氨酸、酪氨酸等荧光氨基酸的微环境信息,可被作为表征蛋白质构象的指标。色氨酸荧光光谱用于研究蛋白质三级结构的变化以及蛋白质间的相互作用。
如图3 所示,MBP 的荧光最大发射波长(λ)在354 nm,而高水分挤压处理后,130、140、150 和160 ℃条件下生产的TMBP 的λ分别在357.6、356.6、354 和353.4 nm。λ均大于330 nm,这表明挤压前后,色氨酸残留物均处于极性环境中。130 和140 ℃条件下处理TMBP 的最大发射波长发生红移,表明蛋白质的三级结构或四级结构发生变化,蛋白质内部的色氨酸从非极性环境中暴露出来。而150 和160 ℃条件下处理的TMBP 与MBP有相似的λ,表明在挤压过程中部分蛋白质展开和变性,温度过高导致了最终的组织化蛋白中的蛋白结构不太紧凑,有一部分与天然的绿豆蛋白相似,因此在相似的波长处检测到峰值。
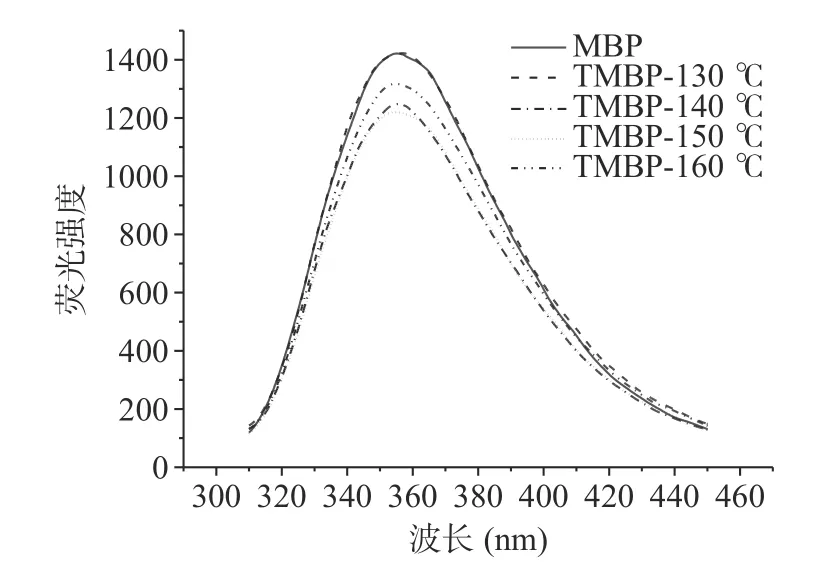
图3 MBP 和TMBP 荧光光谱图Fig.3 Fluorescence spectra of MBP and TMBP
除了λ的变化,荧光强度(fluorescence intensity,FI)的变化也有助于检测蛋白质结构在三级结构上变化。与MBP 相比,除了130 ℃条件下的TMBP,高水分挤压处理降低了所有TMBP 样品中的FI,这可能是通过增加分子间相互作用和蛋白质-蛋白质聚集引起的荧光猝灭的结果。随着挤压温度的升高,蛋白质的变性程度增大,暴露在表面的色氨酸残基增多,发色团电子跃迁所需能量减少,荧光量子产率降低,会导致FI 降低。而高水分挤压处理会使蛋白质折叠结构的展开从而降低蛋白质荧光的内部猝灭,会导致FI 升高。多因素共同影响,导致了在130 ℃条件下TMBP 的FI 没有显著变化。
2.5 SDS-PAGE
利用电泳图可以观察到绿豆蛋白的分子量以及高水分挤压后蛋白分子量的变化情况。如图4 所示,在MBP 和TMBP 中主要有5 个主要的电泳条带,分子量在15~65 kD 之间。该结果与Hossain 等的研究结果一致。与MBP 相比,所有TMBP 泳道顶端的浓缩胶颜色有不同程度的加深,条带的宽窄也有不同程度的改变,说明高水分挤压处理后大分子物质发生了聚集,不同温度下,这些物质聚集程度也不同。随着挤压温度的增加,48 kD 附近的条带颜色逐渐变浅、宽度也逐渐变窄,而泳道顶端的颜色加深,表明这部分蛋白发生了变性,形成了分子量较大的蛋白质聚集体,也可能是这部分蛋白发生了美拉德反应,生成的不溶性物质无法穿过分离胶。

图4 MBP 和TMBP 的电泳图谱Fig.4 Electrophoresis patterns of MBP and TMBP
2.6 扫描电镜
如图5 扫描电镜观察结果可知,挤压前绿豆蛋白粉中既有表面比较光滑的球形颗粒,也有表面光滑但表面向内部凹陷的颗粒。在挤压后,这些颗粒的结构遭到破坏,样品总体上呈现扁平状,结构比较致密,可以看到多层蛋白质堆叠的现象,形成了纤维结构。高水分挤压过程中,蛋白质收到了机械作用力和高温的影响,经历了分子链展开、团聚、交联的过程,从而使得蛋白质在挤压后可以出现组织化结构。由此看来,绿豆蛋白可以作为高水分挤压产品的原料。

图5 MBP 和TMBP 的扫描电镜图Fig.5 SEM pictures of MBP and TMBP
3 结论
本研究通过对高水分挤压后绿豆蛋白的结构进行研究,结果发现多种化学作用力共同维持了组织化蛋白的空间结构,在130 ℃时,组织化绿豆蛋白二硫键含量最高,疏水相互作用含量高,蛋白质结构稳定,有利于蛋白组织化。挤压温度会对蛋白质的二、三级结构产生显著影响(<0.05),并且在挤压过程在会发生美拉德反应。温度过高,会导致疏水相互作用、二硫键的含量和-折叠含量降低,导致蛋白结构的不稳定,不利于高水分挤压的进行。样品挤压前后微观结构发生了显著变化,高水分挤压破坏了蛋白质的完整性使得蛋白质重组形成了组织化结构。由此可见,通过调节挤压温度可以改善组织化绿豆蛋白的结构。本文研究了挤压温度对绿豆蛋白结构的影响,后续需要进一步探究不同加工参数对绿豆蛋白结构的影响,为组织化绿豆蛋白品质的调控以及绿豆蛋白的开发利用提供理论参考。
