淡水小球藻分离培养及其对水体辛硫磷的降解功能研究
2022-10-10黄金秀吕利群
孙 阳,黄金秀,吕利群
(1.上海海洋大学 国家水生动物病原库,上海 201306;2.上海海洋大学 农业农村部淡水水产种质资源重点实验室,上海 201306)
在现代农业和水产养殖中,有机磷杀虫剂被广泛用于杀灭寄生虫、细菌等对生产有害的病原微生物[1]。然而,有机磷杀虫剂的广泛应用也导致了水体和土壤中的药物残留,对环境安全和人的生命健康构成了威胁[2]。辛硫磷是一种有机磷杀虫剂,化学名为Ο-α-氰基亚苯基氨基-Ο,Ο-二乙基硫代磷酸酯。由于辛硫磷在光照下不稳定,易分解且残留期短,在水产养殖中广泛用于水体中寄生虫病的防控。有研究表明,辛硫磷在土壤中残留期较长[3],长期的用药积累以及雨水冲刷,土壤残留辛硫磷汇入水体,可对水生动物产生神经毒性、肝脏毒性、生殖毒性以及免疫系统毒性[4-7]。因此,开发对辛硫磷有效降解的微生态制剂可以降低辛硫磷的用药风险。农药残留的降解研究围绕物理方式、化学方式和生物降解等多种方式展开,其中生物降解因利用无二次污染且廉价易得的微生物发挥作用而更受青睐。细菌在农药的生物降解中扮演先驱角色,微藻具有吸收环境中过量营养物质的能力,长期以来一直被用于污水处理。20世纪科研工作者发现了藻类也能有效降解农药,近年来有关藻类降解、富集农药的研究不断深入。有研究表明微藻可以作为一个巨大的代谢池,在去除包括阿特拉津在内的农药方面发挥重要作用[8-9]。藻类主要通过富集与降解发挥生物降解作用,藻类对农药的富集主要是被动作用,但也有研究表明,主动吸收也起到了重要作用[10],且藻类细胞壁结构在农药富集过程中同样起到重要作用[11]。藻类对农药的降解主要体现在藻类将高毒农药转化为低度无毒化合物或是以农药作为磷源、氮源生长[12]。以DDT为代表的有机氯的降解转化为藻类去除环境中有机农药及其他污染物提供新的机理研究思路。不同藻类降解农药的能力有所不同,研究显示,相比聚球藻(Synechococcus)、念珠藻(NostoccommuneVauch.)、栅藻(Scenedesmusmeyen)和颤藻(Oscillatoria)等藻类,普通小球藻(Chlorellavulgari)对久效磷、喹硫磷以及甲基对硫磷等有机磷农药有更好的降解效果[12-14]。废水中高浓度的农药具有潜在的毒性,可抑制微藻的生长。随着农药浓度降解到一个相当低的水平,其几乎不能对微藻生长产生不良影响,表明只有在非毒性浓度时农药才能被藻类降解,在农药毒害作用下藻类几乎不能发挥任何降解作用[15]。鉴于小球藻在有机农药及其他污染物的生物修复中的重要作用,研究了有机磷农药辛硫磷对一株淡水蛋白核小球藻(Chlorellapyrenoidosa)的毒性作用以及非毒性浓度下该藻株对辛硫磷的吸附和降解作用。对有机磷农药的毒性作用以及藻类在非毒性浓度下对有机磷的吸附降解进行深入拓宽研究,这对于了解污水处理厂或径流中有机磷农药的生物积累和降解具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试验材料 水样采自上海海洋大学校园淡水湖明湖(N30°53′14.33″,E121°53′35.38″)。
1.1.2 培养基 ①HB-4水生四号培养基(HB-4)[16]:Ca(H2PO4)2·H2O+2(CuSO4·H2O) 30 mg/L,(NH4)2SO420 mg/L,MgSO4·7H2O 80 mg/L,NaHCO310 mg/L,KCl 2.5 mg/L,FeCl3(1%) 0.15 mL,土壤提取液0.5 mL(土壤提取液购自索莱宝)。②分离纯化培养基:HB-4水生四号培养基+1.0%琼脂。调节pH值为6~7,高压蒸汽灭菌,待其冷却至60 ℃左右时,加入氨苄青霉素,使其终浓度为0.05 g/L,无菌条件下倒平板备用。
1.1.3 试剂与仪器 DNA secure Plant Kit试剂盒(TIANGEN)、甲醇(HPLC级)、二氯甲烷(AR级)、超纯水、高纯氮、辛硫磷标准品(99.99%),购自Sigma公司。液相色谱仪(LC100,上海伍丰科学仪器有限公司);高效液相色谱柱(ODS-SP,GL Sciences公司);恒温光照培养箱(ZQLY-180GE,上海知楚仪器有限公司);0.22 μm有机系针头式过滤器(生工生物工程(上海)股份有限公司)。
1.2 方法
1.2.1 藻细胞富集 取水样100 mL,先经筛绢网过滤除去大型浮游生物和悬浮物,然后将滤液分装至50 mL离心管内,5 000 r/min离心15 min浓缩水样,弃去上清液,加入无菌水振荡使藻细胞悬浮,真空抽滤,滤膜孔径为0.22 μm。用无菌水多次冲洗滤膜上的样品,并将样品转移至250 mL锥形瓶中,瓶中加入150 mL 灭菌的HB-4培养基。将锥形瓶置于光照恒温培养箱中,27 ℃,3 000 lx培养1~2周,每天摇晃3~5次,每次轻摇100下,仔细观察瓶内生物的生长变化情况。
1.2.2 藻细胞分离 将上述富集得到的混合藻液经充分稀释后(1×PBS稀释)涂布于分离纯化培养基,恒温光照培养箱中静置,20 ℃,光照强度2 000 lx培养两周后可见有藻集结体出现,将该藻株命名为MH-1,镜检确认后将单个藻落于无菌条件下转移至5 mL HB-4培养基中,置于恒温光照培养箱中,25 ℃,3 000 lx条件下进行扩大培养。目测藻液颜色至深绿色时进行下一步接种培养。
1.2.3 种属鉴定 采用 18S rDNA 方法确定经分离纯化得到的藻集结体的种属。利用DNA secure Plant Kit 试剂盒提取藻细胞基因组DNA,PCR 扩增引物及扩增条件参考梁颖等[17],PCR 产物送至上海生工生物工程有限公司,测序结果经 NCBI数据库进行比对鉴定。
1.2.4 蛋白核小球藻MH-1的培养 按照5%、15%和25%(体积分数)接种量接种MH-1新鲜藻液于HB-4培养基,光照恒温培养,28 ℃,光照强度4 000 lx,光暗比12∶12 h,每日手动摇晃培养器皿3~5次,避免藻集结体黏附在瓶壁。每隔24 h取样,紫外分光光度计波长680 nm条件下以HB-4培养基为参比,测定藻液光密度以表示藻细胞生物量,实验用藻细胞个数为(4~5)×106个/mL。
1.2.5 辛硫磷对蛋白核小球藻MH-1的安全浓度 在装有200 mL藻液的锥形瓶中,加入辛硫磷标准工作液,使其质量浓度分别为2、5、10、15 μg/mL,每个质量浓度设置3个平行,同时设置不加药剂组与助溶剂甲醇组为对照。将上述容器置于恒温光照培养箱中,28 ℃,光照强度4 000 lx,光暗比12∶12 h进行培养。每隔24 h定时取样,紫外分光光度计680 nm条件下,以HB-4培养基为参比,测定藻液光密度以表示藻细胞生物量。同时取适量藻液,分光光度法[18]测定叶绿素a含量。
1.2.6 藻液中药剂含量的测定 将不同体积辛硫磷标准工作液分别置入含有160 mL藻液的250 mL锥形瓶中,得到两组含辛硫磷质量浓度分别为0.2和2.0 μg/mL的藻溶液,另设置不加藻细胞的含辛硫磷溶液为空白。定时摇晃样品,按照设定的时间从每个样品中取出15 mL溶液经0.45 μm滤膜过滤,取滤液10 mL转移至50 mL棕色避光离心管中,加入20 mL二氯甲烷分4次萃取(5+5+5+5),合并萃取所得有机相,室温下氮吹,残渣用1 mL甲醇充分溶解,转移至棕色进样瓶中以备HPLC检测。该处理方法的添加回收率为75.76%~91.18%,相对标准偏差为3.65%~3.82%。所有样品设3个平行。
1.2.7 藻细胞富集药物量的测定 将已测定光密度的藻液于 4 000 r/min 离心 5 min,弃去上清,PBS洗涤3次,再将离心管倒置滴干,加入3 mL二氯甲烷于离心管内,超声波细胞破碎仪低温破碎 5 min,直到镜检无完整藻细胞为止。用HPLC级甲醇补充至 4 mL,漩涡震荡混匀,经 0.45 μm 滤膜过滤以备HPLC检测。藻细胞对药物的富集量用mg/g FW表示,即每克湿重藻细胞能够富集到的药物毫克数。
1.2.8 对照试验 进行对照试验以增加试验的可靠性。添加辛硫磷溶液于HB-4培养基,使终质量浓度达到0.2、2.0 μg/mL,置于恒温光照培养箱中培养,于同样的时间点采集培养液,以确定藻细胞以外因素对辛硫磷降解的影响。
1.2.9 液相色谱条件V流动相甲醇∶V水=75∶25,色谱柱C18分析柱(4.6 mm×250 mm,5 μm),进样量20 μL,波长280 nm,柱温室温,流速1.0 mL/min。本实验条件下,辛硫磷标准品的保留时间为15.10 min。
1.2.10 数据分析 实验数据采用SPSS 17.0软件进行统计分析,采用GraphPad prism 8软件进行误差分析。
2 结果与分析
2.1 小球藻的分离鉴定
划线培养3代后,无菌条件下挑取藻集结体进行纯化培养。在平板上得到单个藻集结体,利用倒置显微镜进行观察,其形态如图1所示,单个藻集结体呈规则圆形,有凸起,边缘整齐光滑,嫩绿色。利用甲醛固定液将藻细胞固定于平板上,于光学显微镜下观察,可见单个藻细胞呈球形,无鞭毛,特征颜色为绿色。镜检结合18S rDNA鉴定分离藻种MH-1为蛋白核小球藻。

图1 光学显微镜下的藻集结体(A)与藻细胞(B)Fig.1 Microscopic view of algal colonies(A) and algal cells(B)
2.2 蛋白核小球藻MH-1的生长过程
蛋白核小球藻MH-1在HB-4培养基中的生长情况如图2所示。当初始藻株生物量较高时(15%和25%),蛋白核小球藻MH-1生长迅速,培养3 d,吸光度升高了0.24~0.32,生长百分率为222.06%~248.87%。而5%接种量条件下,3 d内生长较为缓慢,自第4天起,生长速度逐渐加快,第5天时其生长百分率为829.86%,第6天时为1 129.68%。三种接种量条件下,蛋白核小球藻MH-1的生长百分率在第5天转向第6天时均表现了高于其他时间段的显著增长,所以在第5天时蛋白核小球藻MH-1的生长速度最快,即最佳生长时间为5 d。

图2 蛋白核小球藻MH-1的生长情况Fig.2 Growth curve of MH-1
2.3 辛硫磷对蛋白核小球藻MH-1生长的影响
2.3.1 藻细胞量的变化 不同质量浓度的辛硫磷处理下,蛋白核小球藻MH-1的生长过程见图3。在低质量浓度2 μg/mL时,48 h内小球藻生长与对照组基本无异,96 h后生长较为缓慢,并逐渐接近稳定水平,说明低浓度辛硫磷在短时间内对蛋白核小球藻生长无抑制作用,随着时间推移,开始显示出一定抑制作用。当辛硫磷质量浓度在5 μg/mL以上时,藻细胞生长自24 h后受到明显抑制,96 h内缓慢生长,120 h继续生长,藻生物量显著低于对照组,高浓度辛硫磷对蛋白核小球藻生长产生显著抑制作用。
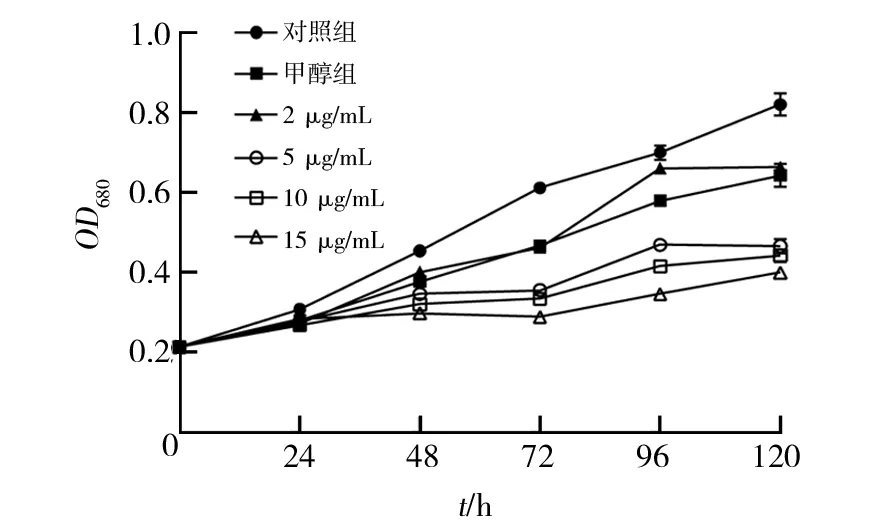
图3 不同辛硫磷初始浓度下蛋白核小球藻MH-1细胞的增长曲线Fig.3 Growth curves of MH-1 at the four different concentrations of phoxim
2.3.2 叶绿素a含量的变化 以叶绿素a含量 (μg/mL) 为指标,测定了对照组和辛硫磷处理条件下蛋白核小球藻MH-1的生长情况(图4)。结果显示,相比空白对照组,48 h内2 μg/mL辛硫磷产生的抑制作用并不明显,48 h后逐渐出现显著影响。5~10 μg/mL辛硫磷处理下,叶绿素a的含量自24 h起显著减少。120 h内15 μg/mL辛硫磷完全抑制藻体生长,叶绿素a含量几乎没有变化。在高浓度辛硫磷作用下,藻液颜色由绿色转为蓝色,推测可能与藻细胞叶绿素合成受阻有关。48 h后大量藻细胞开始沉淀死亡,藻体颜色转向灰黑色,说明藻细胞的生长受到严重阻碍,辛硫磷对藻细胞产生明显的细胞毒性。
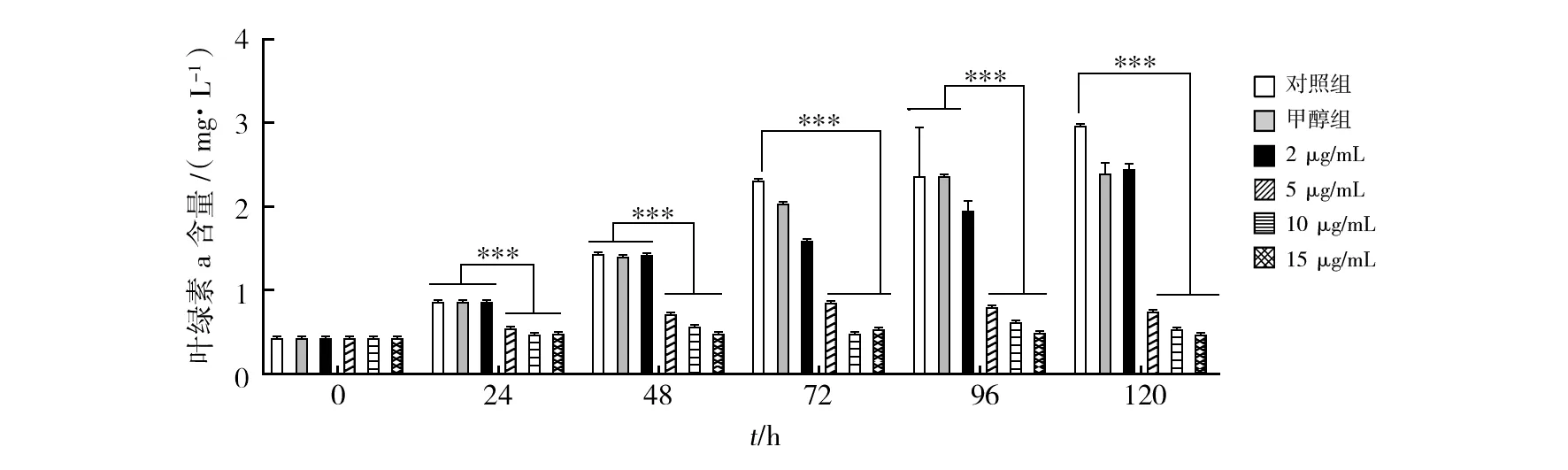
图4 不同浓度辛硫磷处理下蛋白核小球藻MH-1叶绿素a变化Fig.4 The changes in chlorophyl a of Chlorella pyrenoidosa MH-1 treated with phoxim at different concentrations***P<0.001,表示差异极显著***P<0.001,means difference is significant at the 0.001 level
2.4 辛硫磷标准曲线的绘制
利用甲醇将辛硫磷标准品分别配制为100、50、20、10、5 μg/mL等一系列质量浓度,经HPLC测定,得到质量浓度与峰面积的线性回归方程为y=50.261x - 4.612 1,R2=0.999 6。在0.5~100 μg/mL范围内,辛硫磷质量浓度与峰面积呈良好的线性关系。在辛硫磷降解试验中使用该方程并结合外标法进行了质量浓度计算。

图5 辛硫磷标准曲线Fig.5 Stand curve of phoxim
2.5 培养基中辛硫磷的降解
对照试验中,5 d内辛硫磷在HB-4培养基中的降解动态如图6所示。由图6可知,0.2 μg/mL处理组在5 d后辛硫磷质量浓度降低至0.08 μg/mL,减少了43.92%。2.0 μg/mL处理组,5 d后辛硫磷质量浓度降低至0.76 μg/mL,减少了59.16%,可知辛硫磷在光照下易于分解,且随着质量浓度的升高,辛硫磷因光降解和水解等因素引起的浓度降低效果将更加明显。

图6 辛硫磷在HB-4培养基中的降解动态Fig.6 Degradation of phoxim in HB-4 medium
2.6 蛋白核小球藻MH-1对辛硫磷的降解
蛋白核小球藻MH-1对辛硫磷的降解动态见图7。无论是在辛硫磷低浓度还是高浓度处理下,藻液中辛硫磷的浓度随着时间的延长均明显减少。初始质量浓度为2.0、0.2 μg/mL时,5 d内总降解率分别为98.61%和93.58%,扣除空白降解率,其净降解率分别为39.61%和49.66%,日平均降解速率分别为0.38和0.02 μg/mL。可见,当环境中辛硫磷含量在安全浓度内时,其浓度越高,蛋白核小球藻MH-1对其日降解速率越高,但对低浓度辛硫磷有更高的净降解率。

图7 蛋白核小球藻MH-1对辛硫磷的降解动态Fig.7 Biodegradation of phoxim by MH-1
2.7 蛋白核小球藻MH-1对辛硫磷的吸附
如图8所示,蛋白核小球藻MH-1对辛硫磷存在显著的富集作用,其富集量随辛硫磷浓度的变化有明显差异,但其变化趋势一致。24 h内,小球藻对辛硫磷的富集量持续上升,24 h时富集量分别为0.20 mg/g FW(2.0 μg/mL)和0.07 mg/g FW(0.2 μg/mL)。之后3 d内富集量呈现下降趋势。72 h后富集量开始呈上升趋势,120 h时富集量最高分别可达0.25 mg/g FW和0.16 mg/g FW。在测量周期内,蛋白核小球藻MH-1对环境中辛硫磷的富集量整体呈升高趋势,120 h时富集量最高。

图8 蛋白核小球藻MH-1富集辛硫磷的变化动态Fig.8 Changes of phoxim amount accumulated by MH-1 with time at the two different concentrations
3 讨 论
有机磷农药是农业生产中应用最普遍的杀虫剂种类之一,具有高效、广谱以及不易残留等特点[19],但不规范、不科学的用药则会危害到生态环境甚至人类健康。我国自2007年起,甲胺磷等高毒有机磷农药开始明令禁止生产,近年来有机磷农药的生产及使用主要为敌百虫、氧化乐果、辛硫磷和马拉硫磷等低毒药物。农药对藻类的毒性强弱主要取决于农药自身的理化性质,此外也会受到藻种类型以及各种环境因子的影响。Katagi[20]报道200 μg/mL以上处理后,马拉硫磷对蓝绿藻 (Cyanobacteria) 的生长可产生显著且长期的抑制作用,而在一些报道中,仅0.075 μg/mL的乐果与0.5 μg/mL的二甲硫吸磷就可以完全抑制栅藻的生长[21]。本研究中,辛硫磷质量浓度在2 μg/mL以上时,可显著抑制小球藻的生长且在24 h后使其失绿,随后藻细胞死亡沉淀,这与刘仁杰等[22]所报道的结果相似。
叶绿体是微藻光合作用的主要部位,包括光收集、能量转换和光能转换。因此,叶绿素的合成是藻类在环境胁迫下生长的敏感生物标志物[23-24]。本研究中,随着辛硫磷浓度的升高,藻细胞叶绿素含量急剧下降,高浓度辛硫磷使藻液颜色在24 h后开始转为蓝色,随着时间推移绿色逐渐褪去且有明显藻体沉淀悬浮。当暴露在不同类型的药物下时,藻细胞叶绿素含量变化差异较大,本研究结果可以证明辛硫磷对小球藻的毒性可能导致藻细胞叶绿素含量降低。
藻类是水体食物链的关键部分,也是一类对于有毒有机化合物归趋起着重要作用的微生物。自1957年Oswald等[25]首次提出将藻类应用于有机污染污水处理,其后相继有研究报道藻类对除草剂和杀虫剂[26-27]、酚类[28]以及多环芳烃类[29]具有降解和转化的能力。葛丽云等[30-31]发现普通小球藻能够促进水体中17 β-雌二醇和苯胺的降解,其中由小球藻引起的光降解发挥主要作用。迟杰等[32]研究结果显示,6 d内普通小球藻对邻苯二甲酸酯类化合物DBP的富集率和降解率分别为42.0%和11.0%。本研究结果表明,当辛硫磷质量浓度在0.2和2.0 μg/mL时,蛋白核小球藻MH-1对辛硫磷的降解率为49.66%和39.61%,日降解率分别为0.02和0.38 μg/mL。可见当浓度升高时,降解率反而有所降低,这可能是因为高浓度辛硫磷胁迫下蛋白核小球藻MH-1生长受到抑制,从而引起藻生物量降低,富集和降解效果随之降低。藻细胞对辛硫磷的富集量在24 h持续上升,在检测周期内,在0.2和2.0 μg/mL辛硫磷处理下蛋白核小球藻MH-1对其富集量最高分别可达0.16和0.25 mg/g FW,这一结果与鸥晓明等[33]的研究结果相似。
综上,当水体辛硫磷质量浓度在2.0 μg/mL以上时,可对蛋白核小球藻MH-1产生明显毒性作用,在0.2~2.0 μg/mL 质量浓度范围内,蛋白核小球藻MH-1对辛硫磷具有良好的降解效果,最高降解率可达49.66%,最高日降解率可达0.38 μg/mL,藻细胞对药剂的吸附效率最高可达0.25 mg/g FW。本研究表明,蛋白核小球藻MH-1可以用于水体辛硫磷药物残留的生物修复。