钆金属有机框架的制备及用于吸附辛硫磷的研究
2019-04-24陈茂龙程云辉
唐 雄 陈茂龙 许 宙 程云辉
(长沙理工大学化学与食品工程学院,湖南 长沙 410114)
饮用水安全[1]事关千家万户,其中自来水的水源大多来自江河湖泊流域等。近年来,水源地农残超标事件的报道[2]屡见不鲜,辛硫磷农药因其杀虫谱广,击倒力强,且残留期长等特点而被广泛使用,但残留的辛硫磷农药通过径流、雨淋和农田排水等各种方式离开农作物生态系统时,通常会带来水源污染问题。
传统水体残留农药处理方法包括吸附[3]、催化氧化[4]和生物降解[5]等,由于水体农药残留毒性大、成分复杂等特点,往往不易达到预期处理效果。一般来说,催化氧化和生物降解方法可以分解农药分子的复杂结构,但存在降解不够完全的问题;吸附法因简单、绿色环保而成为常用方法,但传统活性炭吸附农药的方法[3]尚无法解决特异性吸附等问题。
金属有机框架材料是由有机配体和金属离子或团簇通过配位键自组装形成的具有分子内孔隙的有机无机杂化材料。近年来金属有机框架材料(Metal-organic-frameworks,MOFs)[6]因比表面积大、孔隙率高、结构可调控等优点广泛应用于小分子的选择性吸附和分离[7]。Jin等[8]利用所合成的Zr-MOF吸附甲基对硫磷,吸附率可达95%,且具备良好的选择性;Akpinar等[9]利用所合成的MOFs吸附阿特拉津,吸附率高达90%,对于吸附后的MOFs,展现出良好的再生能力。
当饮用被辛硫磷污染的水源后,人体内的胆碱酯酶的活性部分与辛硫磷分子紧密结合,形成磷酰化胆碱酯酶,胆碱酯酶丧失分解乙酰胆碱的能力,从而使中枢神经系统及胆碱酯酶神经过度兴奋,最后转入抑制和衰竭,危及生命。早期从磷酸、亚磷酸与稀土金属的研究中发现[10],磷氧键的氧端对稀土金属钆盐有极强的配位能力,而有机磷农药分子中普遍含有磷氧键,辛硫磷分子结构中含有3个磷氧键(图1)。本研究拟以GdCl3·6H2O为稀土金属盐,1,3,5-均苯三甲酸(H3BTC)为有机羧酸配体,水和N,N-二甲基甲酰胺(DMF)为溶剂,采用水热法合成Gd-MOF晶体,对其结构进行表征,考察Gd-MOF对辛硫磷农药的吸附性能。

图1 辛硫磷分子结构式Figure 1 Phoxim molecular structure
1 材料与方法
1.1 材料与试剂
六水氯化钆:分析纯,北京华威锐科化工有限公司;
1,3,5-均苯三甲酸:分析纯,北京百灵威科技有限公司;
N,N-二甲基甲酰胺、氢氧化钠、无水羧酸钠:分析纯,国药集团化学试剂有限公司;
盐酸:分析纯,成都市科隆化学品有限公司。
1.2 仪器与设备
电子天平:FA2004N型,上海精密科学仪器有限公司;
烘箱:DHG-9036A型,上海精宏有限公司;
水浴锅:HH数显型,邦面仪器上海有限公司;
紫外-可见分光光度计:UV-1800型,日本岛津公司;
离心机:TG16-WS型,湖南湘仪离心机仪器有限公司;
超纯水仪:PURELAB型,美国Millipore公司;
漩涡混合器:SZ-1型,江苏金坛市金城国胜实验仪器厂;
傅里叶红外光谱仪:Thermo Nicolet 670型,美国FTIR公司;
透射电子显微镜:JEOLJEM-2100型,日本电子株式会社。
1.3 方法
1.3.1 合成方法 根据文献[10]修改如下:将DyCl3·xH2O换成GdCl3·6H2O,其他保持不变。称取GdCl3·6H2O(0.13 mmol) 48 mg,再加入1,3,5-均苯三甲酸(H3BTC 0.1mmol) 20 mg溶解在DMF:H2O(10 mL,体积比为4∶1)烧杯中,室温搅拌10 min,加入乙酸钠(NaAc 0.5 mmol) 41 mg,60 ℃水浴反应2.5 h,弃去上清,烘干,得白色粉末Gd-MOF。
1.3.2 吸附方法 在室温下(20 ℃),加入相同质量Gd-MOF(30 mg)和不同浓度相同体积的辛硫磷(20~200 mg/L 10 mL)进行吸附。
1.3.3 再生方法 在温度为120 ℃,时间为4 h的条件下,对吸附后的Gd-MOF进行热再生[14]。
1.3.4 Gd-MOF吸附辛硫磷的吸附量计算 采用紫外—可见分光光度计分析辛硫磷的浓度,辛硫磷浓度变化由Gd-MOF吸附前后得到,按式(1)计算:
(1)
式中:
Qe——辛硫磷吸附量,mg/L;
Co——辛硫磷初始质量浓度,mg/L;
Ce——辛硫磷吸附平衡时的质量浓度,mg/L;
V——辛硫磷溶液的体积,L;
m——吸附剂Gd-MOF的质量,g。
1.3.5 Gd-MOF吸附辛硫磷效率的计算 采用紫外—可见分光光度计分析辛硫磷的浓度,辛硫磷浓度变化由Gd-MOF吸附前后得到,按式(2)计算:
(2)
式中:
η——辛硫磷吸附效率,%;
Co——辛硫磷初始质量浓度,mg/L;
Ce——辛硫磷吸附平衡时的质量浓度,mg/L。
1.3.6 Gd-MOF的表征 为考察所合成Gd-MOF的晶体形态是否具有应有特征,本研究采用傅里叶红外(FT-IR)、水合粒径(DLS)、透射电镜(TEM)以及X粉末衍射(XRD)对Gd-MOF结构进行了表征[11]。
2 结果分析
2.1 Gd-MOF的表征
2.1.1 Gd-MOF的FT-IR表征 由图2可知:配体H3BTC的主要特征吸收峰包括vO-H=(3 000 cm-1)、vC=O=(1 710 cm-1)和自由羧基的反对称伸缩振动vas=1 610 cm-1与对称伸缩振动vs=(1 410,1 610 cm-1)。在合成得到的MOFs中H3BTC原有的3个吸收峰vO-H=3 000 cm-1、vC-O=2 460 cm-1、vC=O=1 710 cm-1;反对称伸缩振动与对称伸缩振动分别发生红移现象,分别移动到1 620,1 430 cm-1;但新产生了3 500,1 040,715~775 cm-1的特征吸收峰,在3 500 cm-1出现vO-H伸缩振动峰是由MOF中的水分子引起的,715~775 cm-1是由金属Gd3+与苯环的面外弯曲振动而引起的,在1 040 cm-1处由于金属Gd3+与氧键的结合导致vC-H键面内弯曲而引起的。以上结果均证明金属Gd3+和配体成功配位[11],与Guo[10]报道的MOFs的红外图谱的出峰位置以及峰形基本一致,表明试验成功合成出Gd-MOF。试验结果与林小英等[11]的研究发现一致,即相比于有机羧酸配体,MOFs中有机羧酸配体的的主要特征吸收峰将发生红/蓝移现象。

图2 Gd-MOF和H3BTC的红外图谱Figure 2 Infrared spectra of Gd-MOF and H3BTC
2.1.2 Gd-MOF的DLS和TEM的表征 图3是Gd-MOF的DLS和TEM图,由图3(a)可知,Gd-MOF的粒径大小分布在3~6 μm,较为集中的分布区间为4 μm左右,而且与图3(b)TEM表征数据中的大小基本一致,证明所合成的Gd-MOF是均匀分散的MOFs材料。Guo等[10]研究利用乙酸钠作为去质子化剂,合成后的MOFs尺寸大小范围约为0.200~5.000 μm。由TEM图还可以看出该Gd-MOF是细长状的,有利于小分子进入材料的孔洞内。
2.1.3 Gd-MOF的XRD的表征 图4是本试验合成Gd-MOF和Guo等[10]报道MOFs的XRD图谱,由图4可知Gd-MOF的特征峰与Guo等[10]的晶体结构数据模拟的XRD图谱出峰位置基本一致(8.48,10.61,18.03,22.93),说明两者匹配程度较高,合成的Gd-MOF纯度及结晶度都较高。


图3 Gd-MOF的DLS及其TEM图Figure 3 Gd-MOF DLS diagram and its TEM diagram

图4 MOF的XRD图谱Figure 4 XRD pattern of MOF
2.2 Gd-MOF对水中辛硫磷的吸附性能的研究
基于金属Gd3+与辛硫磷分子之间的络合作用[10],本研究拟将Gd-MOF作为辛硫磷分子的吸附剂,Gd-MOF的制备及其用于吸附辛硫磷的原理如图5所示。由图5可见,Gd-MOF的孔径与辛硫磷分子尺寸匹配较好,这使得辛硫磷分子能够进入Gd-MOF的孔中。而Gd3+的配位水也容易被辛硫磷所取代,配体的苯环与辛硫磷的苯环也会产生-相互作用。最终促使该Gd-MOF能够较好的吸附辛硫磷分子。

图5 Gd-MOF的制备及其用于吸附辛硫磷的原理图Figure 5 Preparation of Gd-MOF and its schematicdia-gram for adsorption of phoxim
2.2.1 辛硫磷的饱和吸附曲线 图6是辛硫磷的饱和吸附曲线,从图6可知,当辛硫磷浓度在20~80 mg/L范围时,Gd-MOF空间孔径通道大多未被占据,此时吸附量增大趋势明显;随着辛硫磷浓度提高至100 mg/L,Gd-MOF空间孔径大多被占据,吸附曲线趋于平缓[11],但吸附量仍呈增大趋势;当辛硫磷浓度提高至160 mg/L时,平衡吸附量不再增大,说明Gd-MOF中吸附位点已达到饱和状态,最终平衡吸附量为33.5 mg/g。
2.2.2 Gd-MOF质量对辛硫磷吸附率的影响 不同Gd-MOF质量对辛硫磷吸附率的影响结果如图7所示,从图7 可知,当Gd-MOF质量<70 mg时,吸附率一直呈上升趋势,当Gd-MOF质量为70 mg时,吸附率可达89.01%;当MOFs质量>70 mg时,吸附率趋于平缓,这可能是钆金属离子之间的聚集堵塞了吸附孔径而致[11]。

图6 辛硫磷的饱和吸附曲线Figure 6 Saturated adsorption curve of phoxim

图7 Gd-MOF质量对吸附率的影响Figure 7 Effect of Gd-MOFamounts on adsorption ratio
2.2.3 吸附时间对吸附率的影响 吸附时间对辛硫磷吸附率的影响结果如图8所示。从图8可知,在吸附开始的5~10 min内,吸附率几乎呈直线增大,在10 min时吸附率可达84.91%;吸附10~50 min 后,吸附率呈缓慢增长趋势;吸附50 min以上吸附率更趋平缓。
2.2.4 pH值对吸附率的影响 溶液pH值是影响吸附效果的因素之一,主要体现在对吸附剂表面电荷的控制。考虑到pH值过低,可能会导致MOFs结构框架裂解;而pH>7[13]时,可能会破坏辛硫磷分子中的磷氧键结构而导致其分解。本试验在pH 3~7范围内考察了Gd-MOF对辛硫磷的吸附率,结果如图9所示。由图9可知,在相同MOFs质量条件下,pH在3~6变化时,MOFs对辛硫磷溶液均存在吸附作用,且吸附率无明显变化;在pH接近中性条件下,由于溶液中H+浓度的减少,可能降低了辛硫磷分子和MOFs之间的络合作用,从而导致吸附率下降。

图8 吸附时间对吸附率的影响Figure 8 Effect of adsorption time on adsorption ratio
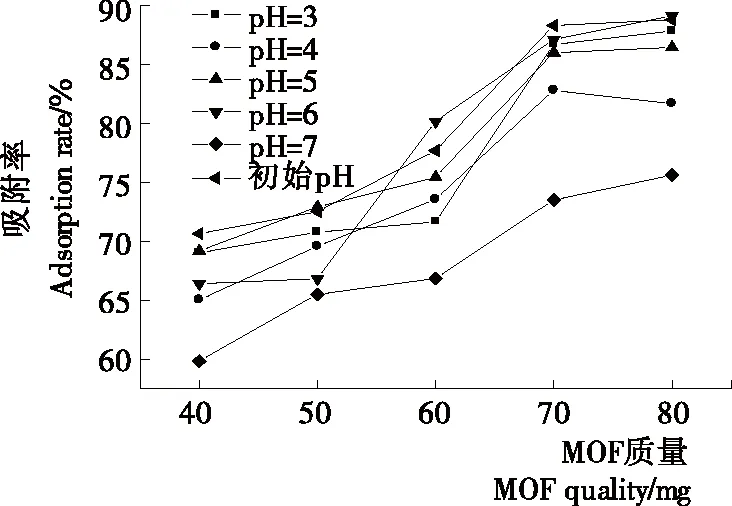
图9 pH值对吸附率的影响Figure 9 Effect of pH values on adsorptionratio
2.2.5 Gd-MOF再生效果试验 再生能力是MOFs作为吸附剂的重要评价指标,本研究利用辛硫磷对热不稳定的特点,对吸附辛硫磷后的MOFs进行热再生,并对其再生后的吸附性能进行了考察,再生次数对辛硫磷吸附性能的影响见图10。由图10可知,再生3次后,Gd-MOF对辛硫磷的平衡吸附量仅下降了16%,这与Lv[14]的研究结果一致。

图10 Gd-MOF再生后的平衡吸附量Figure 10 Adsorption equilibrium after the regeneration of Gd-MOF
2.2.6 Gd-MOF对实际样品中辛硫磷吸附效果的验证实验 为了验证本试验合成的Gd-MOF对实际样品中辛硫磷的吸附效果,本研究针对自来水和河水样品进行了加标回收实验,先将不同浓度的辛硫磷样品添加到自来水和河水中,再利用Gd-MOF对其进行吸附,结果如表1所示。从表1可知,Gd-MOFs对自来水和河水中辛硫磷的吸附率分别达到79.31%,76.41%。与Bahrami[15]研究的MOFs对毒死蜱的的吸附率还存在一定的差距,后续研究可考虑通过对MOFs进行后修饰[16]来提高其对辛硫磷的吸附率。

表1 Gd-MOF对不同水环境中辛硫磷加标回收测定及吸附效果
3 结论
本试验以GdCl3·6H2O为稀土金属盐,1,3,5-均苯三甲酸为有机羧酸配体,通过水热法制备Gd-MOF,并考察其对辛硫磷农药的吸附性能。结果表明:Gd-MOF对辛硫磷的平衡吸附量为33.5 mg/g,在pH 3~7时对辛硫磷表现出一定吸附力。Gd-MOF对辛硫磷的吸附可能是稀土金属离子对辛硫磷分子间磷氧键的氧端有配位络合作用。尽管越来越多的MOFs被合成出来,但应用主要集中在荧光传感方面,利用MOFs吸附农药的报道并不多见,后期研究将进一步改善MOFs的结构功能和尺寸大小,以提高MOFs对辛硫磷的吸附率。
