蛋白酶靶向的荧光纳米诊疗探针研究进展
2022-10-10姚俊列马雪华吴爱国
邢 洁,姚俊列,3,马雪华,3,吴爱国
(1.中国科学院宁波材料技术与工程研究所 宁波慈溪生物医学工程研究所 浙江省生物医学材料技术与应用国际科技合作基地 中国科学院磁性材料与器件重点实验室 医用植介入材料浙江省工程研究中心,浙江 宁波 315201) (2.先进能源科学与技术广东省实验室,广东 惠州 516000) (3.中国科学院大学,北京 100049)
1 前 言
蛋白酶对生命活动代谢过程至关重要,其中特定酶的异常活性通常会导致严重的疾病,如阿尔茨海默病、帕金森病、癌症、糖尿病、心血管疾病、关节炎等[1]。因此,在体内外对酶的活性进行检测和实时成像,可有助于了解生物学问题、揭示疾病进程,从而促进辅助药物管理和药物代谢研究[2-4]。相较于临床使用的传统成像诊断方式,荧光成像具有低侵入性、低辐射、低毒性、实时快速响应和强大的空间成像能力等优点。基于此,许多蛋白酶响应荧光探针被设计开发用于疾病诊断和治疗[5]。
目前,临床用荧光探针主要用于浅表癌症早期诊断、肿瘤血管成像等,它可以区分病变组织和正常组织边界,实现荧光引导的术中导航[6-8]。随着纳米技术的蓬勃发展,各种纳米荧光基团如上转换纳米粒子、贵金属纳米簇、碳点、金属化合物量子点和有机纳米聚合物发光体在荧光探针设计中被频繁使用[9-11]。同时,大量纳米载体平台如自组装纳米胶束、金属有机骨架(metal organic frameworks, MOFs)等结构对诊疗一体化纳米探针的开发做出巨大贡献[12]。近年来,基于光学介导的肿瘤消融治疗一体化路线在荧光诊疗探针的功能设计中激增,例如光热治疗(photothermal therapy, PTT)、光动力治疗(photo dynamic therapy, PDT)、光化学治疗(photochemotherapy, PCT)和光放射治疗(photoradiotherapy, PRT)等治疗方式[5]。
肿瘤相关蛋白酶在癌症发生、发展、侵袭、转移以及细胞凋亡等过程中发挥关键作用,开发癌症相关异常表达蛋白酶响应型荧光诊疗探针,采用荧光探针非侵入性地检测、评估并利用其在体内的活性对癌症进行诊断、治疗及预后都具有重要意义[13, 14]。本文主要针对近5年基于基质金属蛋白酶、组织蛋白酶、半胱天冬氨酸蛋白酶、胰蛋白酶和一些其它类型蛋白酶(如成纤维细胞激活蛋白等)所构建的荧光纳米诊疗探针进行综述(图1),并讨论目前蛋白酶荧光纳米诊疗探针研究中存在的问题及改进措施。

图1 蛋白酶靶向的荧光纳米诊疗探针研究进展Fig.1 Research progress of protease targeted fluorescent theranostic nanoprobes
2 蛋白酶响应荧光纳米诊疗探针
2.1 基质金属蛋白酶
基质金属蛋白酶(matrix metalloproteinase, MMPs)是肿瘤发生、侵袭、转移和血管生成的重要生物标志物[15, 16]。近年来,基于肿瘤微环境高表达MMPs的特性,研究人员设计了一系列荧光诊疗探针,主要是成像检测和荧光响应诊疗一体化探针,其中小分子荧光探针居多[17, 18],纳米探针相对较少[19, 20]。
MMP-2是MMPs家族中最重要的蛋白酶之一,其在大多数实体瘤中过度表达,因此MMP-2活性的分析对于癌症的临床诊断和治疗评估具有重要意义[13]。Chan等[21]开发了一种荧光纳米复合物诊疗探针,该探针由上转换纳米粒子、MMP-2识别多肽和淬灭剂3个主要部分组成,被MMP-2识别后会发射出荧光信号。首先,采用高温共沉淀法制备了油酸配体保护的NaYF4∶Yb3+/Er3+上转换纳米粒子(upconversion nanoparticles, UCNPs)。接着在上转换纳米粒子表面包覆一层二氧化硅外壳,并进一步通过羧基将MMP-2识别的多肽修饰在二氧化硅表面,金纳米粒子作为淬灭剂通过巯基连接到多肽上,形成纳米复合探针UCNP@p-Au。UCNP@ p-Au检测MMP-2的原理是基于荧光共振能量转移(fluorescence resonance energy transfer, FRET)。探针上的MMP-2识别多肽被响应前,内部上转换纳米粒子发射的荧光被金纳米粒子吸收,探针呈现弱荧光状态,而在肿瘤微环境中,多肽被MMP-2识别并断裂,导致金纳米粒子脱落, FRET效应消失,上转换纳米粒子荧光得以恢复,从而实现响应型荧光检测诊疗应用(图2)。

图2 MMP-2靶向探针UCNP@p-Au结构和成像示意图[21]Fig.2 MMP-2 targeted probe UCNP@p-Au structure and imaging diagram [21]
同样基于FRET探针设计原理,Nguyen等[22]设计了具有MMP-9开启荧光特性的金纳米簇/石墨烯复合纳米探针,用于检测人乳腺癌MCF-7细胞分泌的MMP-9。一步法合成由MMP-9响应肽和巯基十一酸双配体稳定的荧光金纳米簇,并通过金纳米簇表面配体MMP-9响应肽的自由端吸附连接到石墨烯上,形成金纳米簇/石墨烯复合纳米探针。在MMP-9肽连接情况下,金纳米簇和石墨烯距离较近,由于FRET效应,金纳米簇荧光被石墨烯吸收,而当探针在含有MMP-9的体系中被响应发生肽键断裂,金纳米簇脱离石墨烯表面,其荧光恢复,即通过荧光强度实现MMP-9的特异性检测。实验结果表明,该金纳米簇/石墨烯复合纳米探针对MMP-9的检测限可达0.15 nmol·L-1,具有高灵敏度、高选择性和简便性,显著缩短检测时间、降低操作复杂度。
除了无机荧光纳米探针,近年来有机荧光纳米探针也被开发。基于肿瘤原发部位和转移区域高表达MMP-2和MMP-9的特点,Cho等[23]设计了双发射荧光纳米探针(dual-emissive fluorogenic nanoprobe, DFNP),用于监测肿瘤转移区域MMP-2和MMP-9的活性。该探针结构是通过自组装形成,自组装单体主要由染料Cy7标记的嵌段聚合物F127(F127-Cy7)和无荧光疏水肽(Cy5.5MMP-Q)组成,其中Cy5.5MMP-Q对MMP-2和MMP-9有荧光响应。探针被MMP-2和MMP-9酶响应后Cy5.5发射荧光,随后通过Cy5.5和Cy7这2种不同波长的荧光强度比值可以间接反映酶含量,从而对MMP-2和MMP-9相关组织微环境进行半定量分析。更重要的是,DFNP能够在活体内有效聚集到淋巴结,在小鼠肿瘤淋巴结转移模型中产生可靠的比率信号,提供淋巴结中MMP-2和MMP-9的活性信息,并且监测结果与组织学分析结果一致。还可以通过DFNP淋巴结成像情况监测癌症光动力治疗后的反应,具有癌症治疗中诊断和预后分析潜力。
近年来,诊疗一体化响应型纳米结构荧光探针引起了研究者的广泛关注。Ye等[24]报道了一种靶向MMP-2的激活型纳米探针(T-MAN),具有荧光/磁共振双模态成像和光热治疗功能。首先,将Gd掺杂到CuS纳米盘中,用聚乙二醇(PEG2000)修饰的两亲性磷脂聚合物(DSPE-PEG2000)包裹形成胶束,然后通过胶束外层的氨基连接MMP-2响应的基团((QSY21)GGPLGVRGK(Cy5.5)-SH)和肿瘤靶向配体(cRGD)。其响应是通过特异性识别肽GGPLGVRGK被MMP-2切割后释放Cy5.5,实现荧光恢复。MMP-2响应后荧光增强185倍,可实现小鼠活体胃肿瘤和淋巴结转移的荧光成像。在808 nm激光下,T-MAN的光热转换效率达到70%,能够高效杀死肿瘤细胞。并且,T-MAN能够在胃肿瘤中优先聚集,实现小鼠术中原位胃肿瘤的精确检测和激光照射引发的光热消融。在此工作基础上,Ye等[25]开发的全有机半导体聚合物纳米颗粒可以实现靶向MMP-2的近红外比率型荧光探针成像,有效提高体内荧光成像能力。
2.2 组织蛋白酶
组织蛋白酶是广泛分布于组织中的溶酶体蛋白酶。已发现的组织蛋白酶可根据其活性部位氨基酸分为3类,分别为天冬氨酸(2种)、半胱氨酸(11种)和丝氨酸(2种)蛋白酶。组织蛋白酶在所有哺乳动物溶酶体中广泛表达,但在多种肿瘤细胞以及癌前病变组织中过度表达和激活,可以调节癌症的发生、发展、侵袭和转移[26]。
Blau等[27]开发了组织蛋白酶响应的近红外荧光纳米探针,可用于术中导航,精确检测肿瘤边界。他们设计合成了3种探针,结构如图3a所示。探针体系1(P-GFLG-Cy5)采用不可降解的N-(2-羟丙基)甲基丙烯酰胺(HPMA)共聚物和可降解的肽链甘氨酸-苯丙氨酸-亮氨酸-甘氨酸(GFLG)连接Cy5组成荧光较弱的自淬灭探针,酶响应识别GFLG,切断肽链,Cy5脱离聚合物产生荧光。探针体系2(PC)由可生物降解的聚-L-谷氨酸(PGA)聚合物主链组成,该主链连接有自淬灭的分子Cy5,形成PGA-Cy5,酶降解PGA后Cy5荧光信号增强。探针体系3(PCQ)基于FRET原理,Cy5与淬灭剂连接在PGA上,与蛋白酶作用后二者断开激活荧光。在原位乳腺癌和黑色素瘤自发转移到大脑的模型中,肿瘤组织荧光信号稳定,肿瘤与背景的信噪比提高,在手术过程中描绘了肿瘤边界,实现了肿瘤的精准切除。这种“智能”聚合物探针有可能帮助外科医生在手术期间实时确定肿瘤边界,从而改善患者预后。
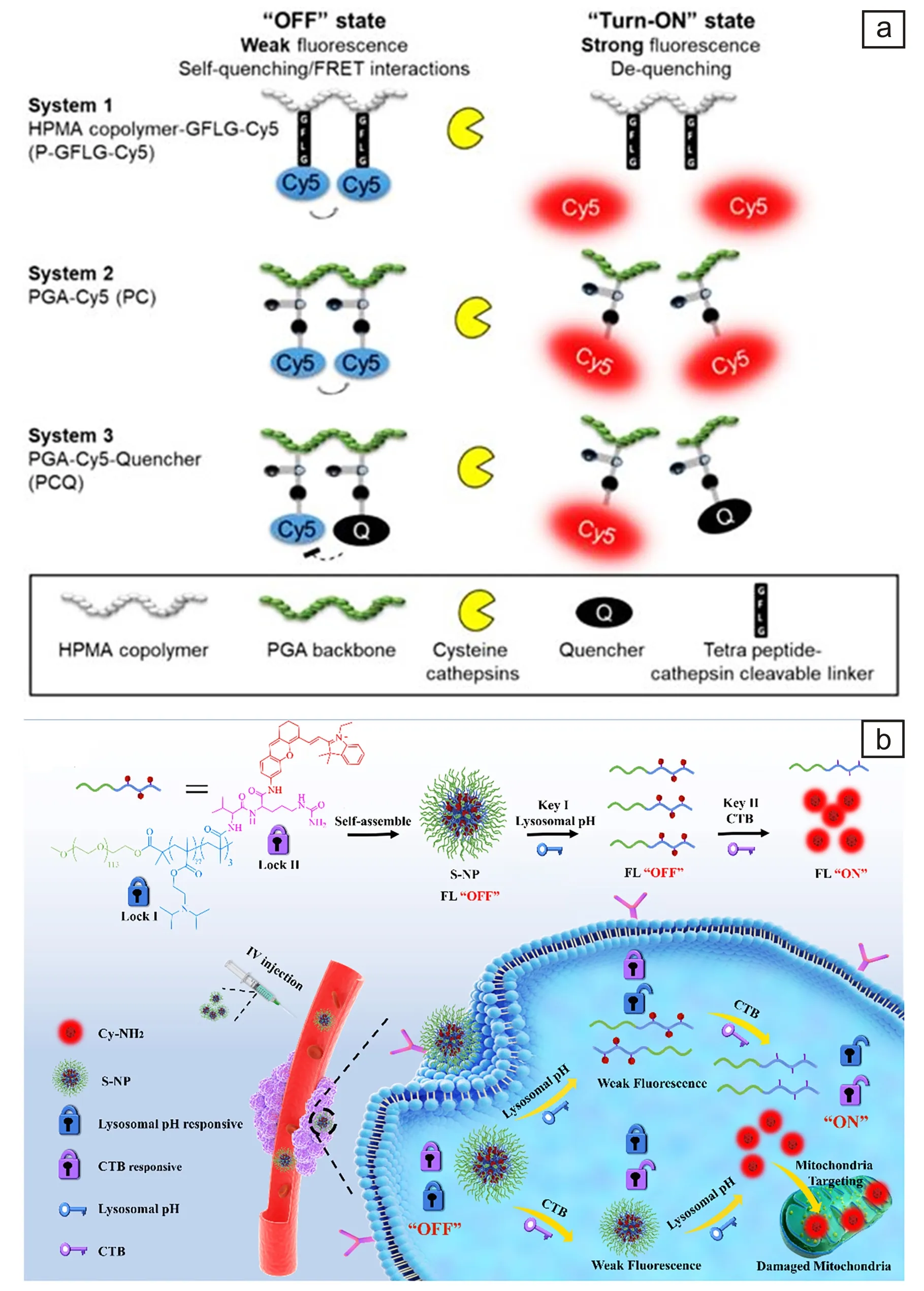
图3 组织蛋白酶响应的3种术中导航荧光探针结构(a)[27],自组装双响应诊疗一体化纳米探针(b)[29]Fig.3 Cathepsin responsive three intraoperative navigation fluorescent probe structures (a) [27], self-assembled double response integrated nano probe (b) [29]
Cai等[28]也利用HPMA共聚物,通过共轭化学方法制备出连接有标记染料Cy5.5的GFLG肽链、钆螯合物及化疗药紫杉醇(PTX)的支化聚合物,随后通过自组装形成刺激响应聚合物前药系统,该系统生物相容性良好、生理条件下稳定性高,但在肿瘤微环境中会迅速降解和释放PTX。实验表明,该纳米复合探针可以响应细胞内溶酶体组织蛋白酶,实现荧光成像。抗肿瘤治疗方面显示其对乳腺癌细胞具有较强的抑制能力,并能在体内实现良好的抗肿瘤效果。
Zong等[29]设计合成了溶酶体pH和组织蛋白酶双响应纳米荧光探针,用于癌细胞精准成像和治疗。如图3b所示,探针是通过组织蛋白酶响应肽,将近红外半菁染料CyNH2与酸响应聚合物连接,自组装形成纳米结构。该纳米复合探针在生物体内双重刺激下降解,CyNH2释放,在激光照射下实现荧光成像,同时CyNH2还具有线粒体靶向抑制癌细胞增殖的效果。实验表明,这种双重刺激响应纳米荧光诊疗探针,相较于单一响应的探针具有更好的选择性和特异性。
2.3 半胱天冬氨酸蛋白酶
半胱天冬氨酸蛋白酶(Caspase)是一个受到严格调控的酶家族,参与细胞凋亡和炎症反应。具体而言,凋亡启动子(Caspase-8/9)和执行子(Caspase-3/7)在程序性细胞凋亡中发挥不同的作用。凋亡功能的紊乱与许多疾病相关,如癌症的主要特征是细胞凋亡减少,而神经退行性病变则是细胞凋亡增加,在凋亡增加或减少过程中,相应的半胱天冬氨酸蛋白酶表达量将上调或者下调[30]。因此,许多用于细胞凋亡Caspase蛋白酶活性检测的成像技术被开发用于疾病诊断和评估抗肿瘤效果[31]。
Wang等[32]展示了一种荧光可激活的金纳米星(AuNS)复合探针,该探针可被Caspase-3激活荧光,实现对癌细胞凋亡成像,并通过细胞凋亡程度的成像反应出探针抗肿瘤光热治疗效果。如图4a所示,金纳米星作为内核和载体,在其表面修饰连接标记过荧光染料Atto 655的Caspase-3响应肽(DEVD),由于FRET效应,在连接状态下,金纳米星吸收染料Atto 655的荧光,探针荧光被淬灭,而该探针对Caspase-3响应后,染料分子和金纳米星二者距离变大,不能进行荧光共振能量转移,染料荧光恢复,从而实现Caspase-3检测成像。此外,该纳米复合探针表面还修饰了叶酸,主动靶向高表达叶酸受体的癌细胞,实现癌细胞有效内吞并累积更多的荧光诊疗纳米探针。实验结果显示,在近红外光照条件下,该探针的光热效应导致癌细胞凋亡,典型的凋亡效应蛋白酶Caspase-3被激活,终止探针分子内荧光淬灭,出现明显的荧光恢复。利用激活的荧光可以精准评估Caspase-3表达和探针实时治疗效果。这种新型多功能纳米复合材料可以作为肿瘤靶向治疗效果监测、评估一体化诊疗探针。

图4 Caspase-3响应的金纳米星诊疗探针(a)[32],Caspase-3/8响应的纳米纤维探针合成原理示意图(b)[35]Fig.4 Caspase-3 responsive AuNS@probe structure (a)[32], Schematic of the preparation of Caspase-3/8 responsive nanofiber probe (b)[35]
与前文所述的金纳米星在探针中作为淬灭剂不同,Yin等[33]开发了金纳米簇作为荧光信号分子,金属有机骨架NH2-MIL-101(Fe)作为荧光淬灭基团和化疗药物喜树碱的载体。金纳米簇通过Caspase-3响应型多肽连接到MOFs表面,同时表面还修饰了连接叶酸的聚乙二醇。当探针被细胞内吞后,化疗药物喜树碱被释放产生杀伤作用,凋亡指示蛋白上调,特异性切割金纳米簇与MOFs之间的肽链,金纳米簇荧光随即恢复,通过荧光和质谱分析量化Caspase-3的表达量,检测限可达0.12 ng·mL-1。
Li等[34]利用MoS2纳米片(NSs)开发了一种新型的二维纳米材料,用于检测Caspase-3,在生物荧光成像方面显示出巨大的潜力。通过聚多巴胺(PDA)共价生物修饰MoS2策略,构建了一种细胞内荧光成像生物探针MoS2@PDA-PEG肽(MPPP),用于测定Caspase-3活性。相比于传统的配位修饰,共价修饰可显著提高生物分子的共轭效率,并且增强纳米复合物在复杂环境中的稳定性。实验证明,该二维材料具有可靠的稳定性,表现出对Caspase-3的高灵敏度和高选择性检测,检测限为0.33 ng·mL-1。
Zhang等[35]开发了一维纳米线材料,具有荧光“开启”特性,可实时监测活细胞中的Caspase-3/8活性。探针设计原理示意图如图4b所示,合成NAP-GFFPYDEVD-AFC和NAP-GFFPEIETD-AFC这2种单体,当其进入细胞时,首先被细胞膜表面的碱性磷酸酶(ALP)催化,自组装形成纳米纤维广泛分布在细胞膜表面上,纳米线被内吞进入细胞,Caspase-3/8识别IETD/DEVD序列,切割探针,并释放7-氨基-4-三氟甲基香豆素(AFC)荧光基团,游离AFC荧光强度与细胞质中相应的半胱天冬氨酸蛋白酶的活性成正比,可用于细胞Caspase-3/8检测成像。
预包装的现制现售食品,现场分装或包装食品应张贴标签;标签内容应至少包括品名、生产日期与保质日期、保存条件、大卖场的名称、地址、联系电话;应按标签标注的储存条件下储存和销售;张贴标签后的产品不得再更改生产日期与保质期,也不得以加贴形式覆盖原来的生产日期与保质期;分装食品的保质期不得长于原包装上的保质期。
2.4 胰蛋白酶
胰蛋白酶是一类丝氨酸蛋白酶,主要水解含有赖氨酸和精氨酸的肽和酯。它与人类多种病理过程,如囊性纤维化、胰腺癌、胰腺炎、组织坏死、细胞凋亡等相关。因此,检测胰蛋白酶的异常在相关疾病的研究中非常重要[36]。
Hu等[37]利用D-青霉胺作为稳定剂和还原剂,制备了铜纳米簇(CuNCs),CuNCs的荧光激发/发射(390 nm/645 nm)在很大程度上是通过涂覆聚苯乙烯磺酸钠(PSS)来稳定的。设计原理如图5a,细胞色素c(Cyt c)可淬灭PSS覆盖的CuNCs荧光,在负载Cyt c的CuNCs中加入胰蛋白酶,Cyt c被水解成肽片段,CuNCs的荧光逐渐恢复。Hu等据此建立了一种高灵敏度的荧光检测方法,可用于检测血清中的胰蛋白酶。结果显示,胰蛋白酶的线性检测范围为0.1~6.0 μg·mL-1,检测限为20 ng·mL-1。
Xue等[38]开发了硅纳米粒子(SiNPs)引发的金纳米簇聚集诱导发射增强,用于鱼精蛋白和胰蛋白酶的比率检测探针。在这项工作中,由于静电相互作用,氨基修饰的硅纳米粒子和谷胱甘肽封端的金纳米簇(GSH-AuNCs)自组装成球形粒子SiNPs@GSH-AuNCs。SiNPs@GSH-AuNCs具有独特的570 nm处聚集诱导荧光发射增强(aggregation-induced emission enhancement, AIEE)现象。将鱼精蛋白加入到SiNPs@GSH-AuNCs体系,阳离子鱼精蛋白与SiNPs竞争,吸附到GSH-AuNCs表面,抑制自组装,终止AIEE现象,570 nm处荧光减弱淬灭,但胰蛋白酶可以催化鱼精蛋白水解,自组装抑制元素消失,AIEE恢复。在整个过程中,SiNPs充当内部标准,其450 nm处荧光发射强度保持不变,检测中通过I570/I450荧光强度比获得鱼精蛋白和胰蛋白酶浓度。该探针应用于血清样品中鱼精蛋白和胰蛋白酶的测定,显示出良好的灵敏度和选择性。
除了金属纳米团簇具有荧光发射性能以外,聚多巴胺纳米粒子(PDNPs)也具有荧光性能。Li等[39]通过羟基自由基诱导纳米颗粒降解的方法获得直径4.8 nm带负电荷的荧光PDNPs,并将其开发为胰蛋白酶检测探针。带负电的PDNPs具有较强的荧光发射强度,但与带正电的鱼精蛋白(protamine, Pro)结合后,形成PDNPs-Pro聚集纳米粒子荧光发射受到限制。PDNPs-Pro聚集纳米粒子用于检测胰蛋白酶时,胰蛋白酶水解鱼精蛋白,使PDNPs-Pro变回PDNPs恢复荧光。荧光对胰蛋白酶浓度的线性检测范围为0.01~0.1 mg·mL-1,最低检测限为6.7 ng·mL-1。
Hu等[40]提出了基于黑磷纳米片(BPs)的蛋白酶检测和抑制剂筛选系统,图5b显示了其工作原理。苝探针(Probe 1)的水溶液显示强荧光,二维材料BPs可以通过静电相互作用吸附苝探针并淬灭探针荧光,组蛋白(Histone)可以控制苝探针和BPs之间的相互作用,通过蛋白酶的引入调节荧光实现酶活性检测。该探针无需标记、灵敏度高、选择性好,胰蛋白酶检测限低至1 ng·mL-1。

图5 铜纳米簇检测胰蛋白酶示意图(a)[37];基于黑磷纳米片的蛋白酶检测系统(b)[40]Fig.5 Schematic of trypsin detection by copper nanoclusters (a) [37]; protease detection system based on black phosphorus (b) [40]
2.5 其他蛋白酶
人中性粒细胞弹性蛋白酶(HNE)是一种典型的蛋白酶,其表达情况与肺部炎症疾病和肺癌密切相关,具有成为这类疾病预测因子的潜力。Liu等[41]将HNE特异性肽底物、量子点(QD)和有机染料结合在一起,基于FRET原理,制备了纳米探针QDP,实现HNE的体外检测和体内成像。QDP能够在水溶液中特异性地测量HNE,灵敏度高达7.15 pmol·L-1,并成功地在活细胞中进行了内源性和外源性HNE靶向成像。此外,这种纳米探针能够在肺癌和急性肺损伤的小鼠模型中进行HNE成像,并持续监测时间和空间分辨率下的HNE活性。最重要的是,QDP对HNE活性的测定可以成功地将肺部疾病患者的血清与健康对照组的血清区分开来,证明QDP在成像性能方面的优势,为活体HNE检测和肺部疾病诊断提供了一种适用的工具(图6a)。
成纤维细胞激活蛋白(FAP)在许多癌细胞和肿瘤微环境中高表达,其具有二肽基肽酶活性和明胶酶活性,在肿瘤转移过程中发挥巨大作用[42]。Han等[43]基于聚多巴胺涂层包覆金纳米星(GNS@PDA)这一纳米体系,在其表面偶联Cy7标记的FAP识别肽,实现了计算机断层成像/光声/双光子发光/红外热成像及治疗一体化的多模态荧光纳米诊疗探针(图6b)。实验结果显示,GNS@PDA表现出优异的光热性能和高效的肿瘤累积。FAP响应近红外荧光活体成像揭示了关于肿瘤的病理信息,在多模态成像的精确指导下,Han等利用GNS@PDA在小鼠模型中进行了大体积实体瘤(200 mm3)的均匀光热消融,表明这种纳米探针在癌症治疗中有巨大的转化前景。

图6 量子点探针靶向HNE成像原理及应用(a)[41],FAP响应荧光成像的多功能金纳米星探针GNS@PDA(b)[43]Fig.6 Mechanism and application of quantum dot probe targeted HNE (a)[41], multifunctional GNS@PDA probe for FAP response fluorescence imaging(b)[43]
弗林蛋白酶(furin)是一种前体蛋白转化酶,在许多疾病中起重要作用。据报道,弗林蛋白酶与多种癌症高度相关,包括头颈部鳞状细胞癌、乳腺癌、卵巢癌、胶质母细胞瘤和结肠癌[44]。Hai等[45]开发了细胞内弗林蛋白酶检测的荧光探针Cys(StBu)-Lys(Gly-Lys(DABCYL)Gly-Gly-Arg-Arg-Val-Arg-Gly-FITC)-CBT,在细胞内谷胱甘肽响应后,点击缩合反应自组装成纳米粒子,再被弗林蛋白酶剪切释放探针上的染料(FITC)以实现荧光恢复,完成灵敏的酶活性荧光成像。
3 结 语
本文总结了近5年内开发的蛋白酶靶向荧光纳米诊疗探针,依照蛋白酶所属家族将其分为5大类,并对其中数十种蛋白酶靶向荧光纳米探针进行了详细的描述,主要包括探针设计原理、探针结构及其在生物医学方面的荧光诊疗特性等。总体而言,蛋白酶靶向荧光纳米探针的设计主要是基于荧光共振能量转移(FRET)原理,利用蛋白酶水解功能释放荧光信号基团,实现荧光响应。纳米探针材料的主要构成部分涵盖了贵金属纳米簇、荧光纳米上转换颗粒、量子点、有机纳米聚合颗粒、纳米纤维、自组装纳米胶束以及金属有机骨架结构等。相较于小分子荧光探针,荧光纳米探针的合成和设计更为复杂,可实现多模态融合在统一平台体系,在生物医学应用中展现出巨大优势。
尽管目前已经开发了许多蛋白酶靶向荧光纳米诊疗探针,但依然存在一些问题限制其进一步的生物医学应用转化。首先,荧光纳米探针的稳定性和灵敏性有待进一步提高。探针溶液稳定性可通过对纳米系统进行水溶性修饰来改善,探针荧光稳定性可选择搭载光学性能好的新一代荧光染料;探针灵敏性则需要寻找更加有效的靶向识别基团或者采用更加先进的设计原理,提升探针的灵敏性和抗干扰性能。其次,蛋白酶靶向的荧光纳米诊疗探针的应用主要停留在细胞或动物肿瘤模型层面,荧光纳米探针在人体内的吸收、分布、代谢、排泄和毒性等相关研究还相对较少,需要材料学和临床病理学等学科交叉的研究者合作,推进荧光纳米探针的进一步应用。这也是目前所有纳米药物研发面临的问题。综上,在未来的蛋白酶靶向荧光纳米探针的设计开发研究中,应在满足成像和治疗功能的同时,考虑探针的体内毒性,对其安全性进行系统性的研究,这是荧光纳米探针能否实现临床转化的关键。
