声敏剂在肿瘤声动力治疗中的研究进展
2022-10-10陈志钢
姜 琴,耿 鹏,张 雯,陈志钢
(东华大学材料科学与工程学院 纤维材料改性国家重点实验室,上海 201620)
1 前 言
根据《2020年全球癌症统计》报告,2020年全球约有1810万例新发癌症、近1000万癌症病患逝世[1],且随着人口老龄化加剧,人们患癌几率增加,癌症的致死率也将不断上升。现阶段,癌症的临床一线治疗方法仍以手术、化疗和放疗为主。然而,这些方法通常会导致肿瘤复发、多药耐药性和免疫系统损伤等严重的副作用。近20年来,纳米技术的蓬勃发展为生物医学,特别是癌症诊疗[2],带来了新的曙光。其中,基于纳米材料的光动力、光热等新型治疗方法[3]已经发展成为一种可行的治疗方案,用以克服传统医学面临的挑战。光动力/光热治疗是利用可见光或近红外光激发纳米材料产生毒性活性氧(reactive oxygen species, ROS)或高温,从而杀死肿瘤细胞[4],具有治疗时间短、效果显著和副作用小等优点,已在临床浅表肿瘤治疗方面取得良好的治疗效果。然而,由于光的穿透深度有限、能量衰减快,光动力/光热疗法还无法实现对深部肿瘤的高效治疗。大部分肿瘤(例如肺癌、胃癌、卵巢癌和胰腺癌等)往往生长在组织深处,使得光源在到达肿瘤前就被人体组织强烈吸收或散射,从而导致治疗效果不明显。因此,开发能够高效治疗深部肿瘤的新方法具有十分重要的意义。
众所周知,超声波是一种周期性振荡且频率高于人听力的机械波,具有强大的组织穿透能力[5],穿透深度可高达10 cm,因此近年来利用超声波治疗深部肿瘤吸引了科学家们的广泛关注。超声波驱动的声动力治疗不仅穿透力强,能够在短时间内无创地靶向病灶组织和部位,而且所使用的超声波强度低,长时间治疗也不会对周围正常组织造成损伤,因而在临床深部肿瘤治疗中展示出巨大的潜力[6]。其原理是[7]:将声敏剂富集在肿瘤处,低强度的超声波激发声敏剂使其处于激发态,激发态的声敏剂与肿瘤组织的氧气作用,产生羟基自由基(·OH)、超氧化物阴离子(·O2-)和单线态氧(1O2)等ROS;超声波引起空化效应,以声致发光的形式释放能量,释放的能量会使空化效应形成的微泡破裂,产生高温高压,通过热或流体剪切力破坏细胞骨架,从而导致细胞坏死;肿瘤组织自身吸收部分机械能并释放出热量,造成细胞热损伤。除此之外,空化效应还会进一步激发声敏剂产生ROS,生成的ROS通过氧气脂质损伤细胞器及DNA,诱导细胞凋亡(图1)。
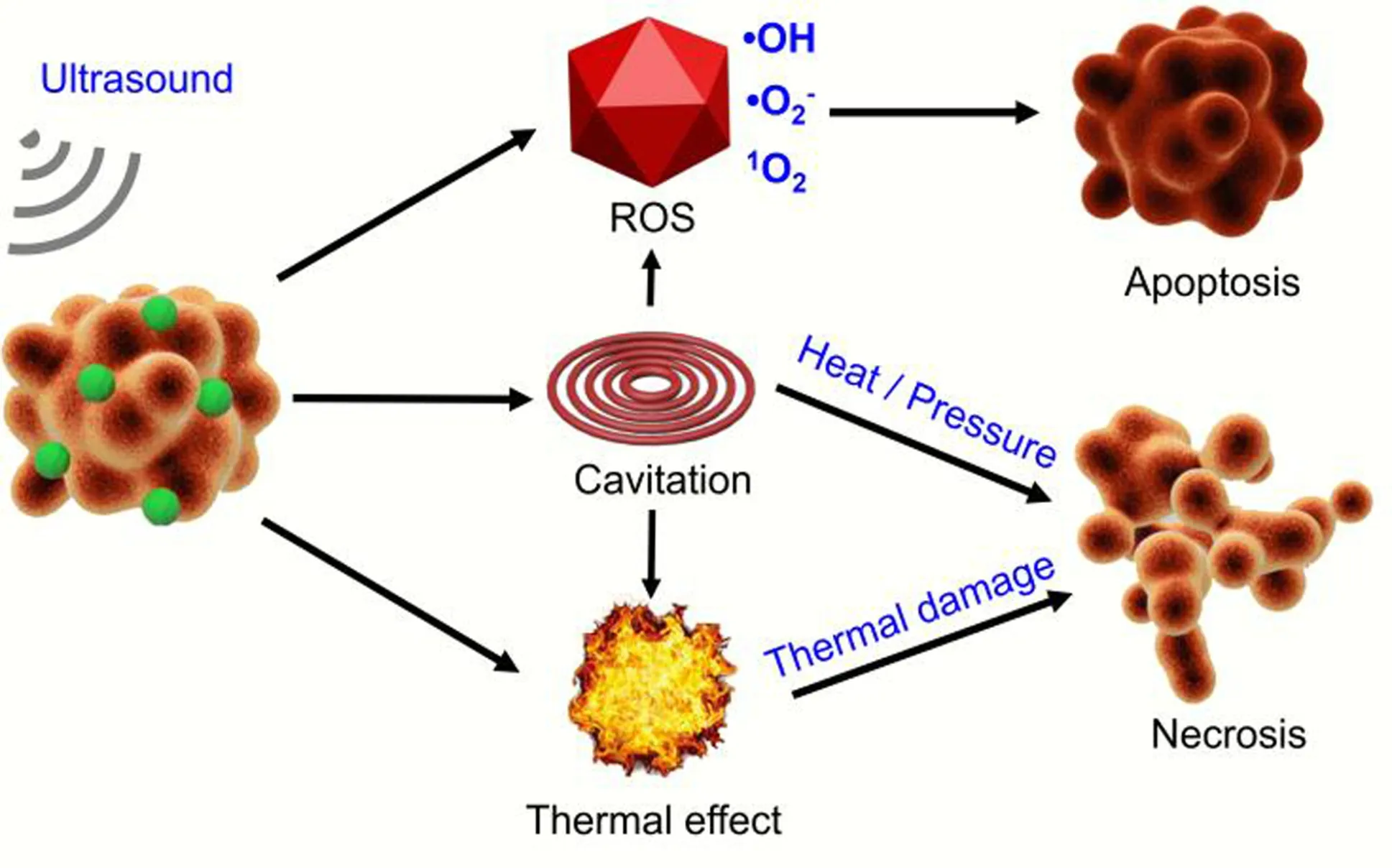
图1 声动力治疗机理示意图Fig.1 Schematic diagram of the mechanisms ofsonodynamic therapy
声动力治疗的核心是开发安全、高效的声敏剂。目前已报道的声敏剂可以分为3类[8],分别是有机分子、无机纳米和有机-无机杂化纳米声敏剂。不同类型的声敏剂各自具有很多优越的性能,在恶性肿瘤的声动力治疗中取得了令人鼓舞的发展。有机分子声敏剂的ROS量子产率高[9];无机纳米声敏剂具有可调的物理化学性质和较高的稳定性[10];有机-无机杂化纳米声敏剂大的比表面积使其能够携带其他诊疗试剂,更容易实现声动力和其他治疗模式的联合治疗[11]。本文重点介绍3类声敏剂的最新研究进展,评价其用于肿瘤声动力治疗的治疗效果,最后指出当前声动力治疗存在的挑战和未来走向临床应用的发展方向。
2 声敏剂的研究进展
2.1 有机分子声敏剂
有机分子声敏剂大多来源于光敏剂。目前已报道的有机分子声敏剂包括卟啉、玫瑰红、姜黄素、金丝桃素等化合物及其衍生物[12]。卟啉家族如血卟啉、原卟啉、血卟啉单甲醚和华卟啉钠等具有大的π-π共轭体系和丰富的化学结构(图2),能够在整个可见电磁波谱中吸收能量,快速产生ROS。其中,Photofrin®和Visudyne®卟啉分子已经进入临床实验,被批准用于治疗各种癌症,因此卟啉在声动力治疗中具有巨大的应用潜力[13]。早在1989年,日本东邦大学Yumita等[14]首次报道了血卟啉在1.92 MHz的超声波辐射下可以产生明显的细胞毒性作用;随后,他们又在荷瘤小鼠模型中评估了血卟啉的声动力治疗效果,发现血卟啉产生细胞毒性的原因与ROS的生成有关[15]。2009年,哈尔滨医科大学吴长君研究组[16]发现,血卟啉单甲醚在超声波辐射下不仅能产生ROS,而且能增强caspase-3和caspase-9等促凋亡蛋白和抑制Bcl-2抗凋亡蛋白的表达,导致脑胶质瘤细胞凋亡。体外实验结果表明,使用1 MHz的超声波辐射120 s,血卟啉单甲醚即可杀死~72.6%的胶质瘤细胞。
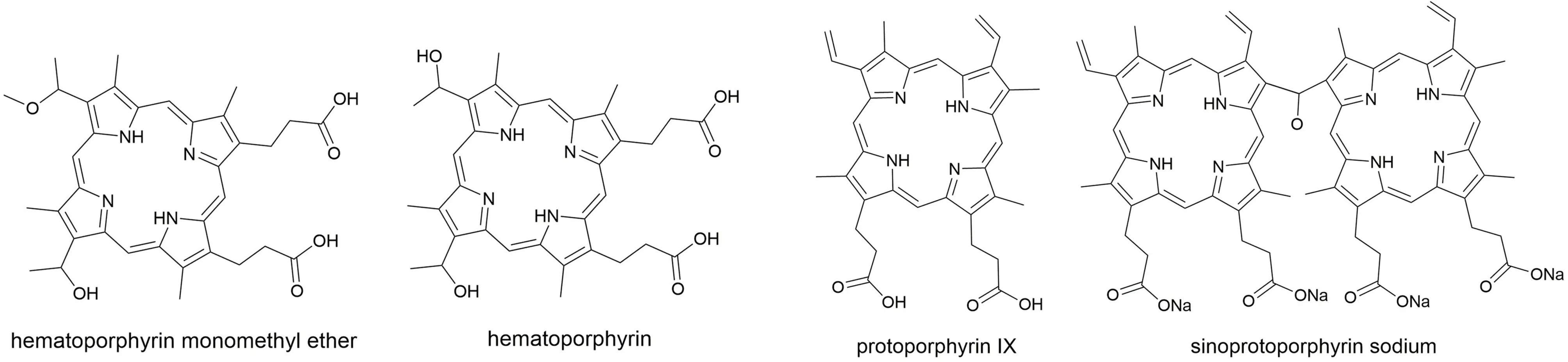
图2 血卟啉、原卟啉、血卟啉单甲醚和华卟啉钠的化学结构式Fig.2 Chemical structures ofhematoporphyrin, protoporphyrin IX, hematoporphyrin monomethyl ether, and sinoprotoporphyrin sodium
华卟啉钠是从Photofrin衍生出来的一种新型声敏剂。与Photofrin相比,华卟啉钠具有更高的活性和更低的暗毒性,其使用剂量仅为Photofrin的十分之一,目前已被批准在中国进行临床前试验。研究表明,华卟啉钠可以被超声波有效激活,在多个异植瘤模型中都能抑制肿瘤生长。由于华卟啉钠有2个羧酸钠修饰的卟啉环,能够优先被肿瘤细胞摄取、选择性地聚集在肿瘤组织,因而华卟啉钠在声动力治疗肿瘤中受到了科学家们的高度关注。2021年,哈尔滨工业大学胡铮研究组[17]系统地评估了原卟啉、血卟啉单甲醚和华卟啉钠在缺氧情况下的声动力效应。在相同物质的量浓度下,华卟啉钠产生ROS的速率分别是原卟啉的1.48倍、血卟啉单甲醚的15.3倍。更重要的是,即使在完全无氧的条件下,华卟啉钠经超声波辐射后也能产生ROS,因此其在缺氧环境下治疗肿瘤方面显示出更大的优势。尽管有机分子声敏剂具有优异的声动力效应,但大部分有机分子声敏剂都是疏水的,在水溶液中容易发生聚集,高浓度聚集不仅会造成自淬灭效应,降低ROS量子产率,而且会导致声敏剂血液循环时间短、肿瘤富集效率低,这些问题限制了有机分子声敏剂在临床癌症治疗中的应用[18]。
为了解决有机分子声敏剂的溶解性问题,科学家们通过封装或化学偶联的方法,将有机分子声敏剂与生物相容的纳米载体结合,发展了声敏剂递送纳米系统。纳米载体不仅可以有效改善有机分子声敏剂的水溶性,提高其在血液中的循环时间;还可以通过增强渗透与保留效应或主动靶向作用,将声敏剂高效递送到肿瘤处[19]。迄今为止,用来递送有机分子声敏剂的纳米材料有脂质体、蛋白质和聚合物纳米颗粒等[20]。2019年,中国科学院上海硅酸盐研究所陈雨研究组[21]使用脂质体作为纳米载体,通过反向蒸发法包封了血卟啉单甲醚和咪喹莫特这2种疏水性分子。制备的纳米颗粒动力学直径约为157.3 nm,能在水溶液中均匀分散。细胞摄取和声动力实验结果表明,脂质体包封后的纳米颗粒进入小鼠乳腺癌细胞的效率最高且杀伤效果最好,并且杀伤率显著高于血卟啉单甲醚分子。陈航榕研究组[22]将转铁蛋白和原卟啉偶联,转铁蛋白-原卟啉偶联物在水溶液中自组装形成纳米颗粒(图3a和3b)。由于转铁蛋白和原卟啉都是内源性物质,因此制备的纳米颗粒具有良好的生物相容性和稳定性,能在超声波辐射下有效产生ROS(图3c)。在转铁蛋白的介导下,纳米颗粒高效富集在肿瘤部位,通过细胞间连续传递实现了对肿瘤组织的深度穿透和高效治疗(图3d)。2022年,澳门大学陈美婉课题组[23]设计并合成了含卟啉的共轭聚合物,该聚合物在超声辐射后不仅可以实现声动力治疗,而且还能诱导肿瘤相关的抗原释放,促进树突细胞成熟和T细胞活化。更重要的是,将聚合物纳米材料和免疫检查点抑制剂(抗CD47抗体)连用,能诱发机体的免疫反应,显著抑制肿瘤的复发和转移。尽管纳米载体可以有效克服有机分子声敏剂水溶性差的缺陷,改善血液循环,提高其在肿瘤部位的富集,然而需要说明的是,这些纳米材料到达肿瘤部位后,材料中较高的声敏剂浓度仍会导致其自淬灭,从而降低整体材料的声动力性能,降低治疗效果[24]。
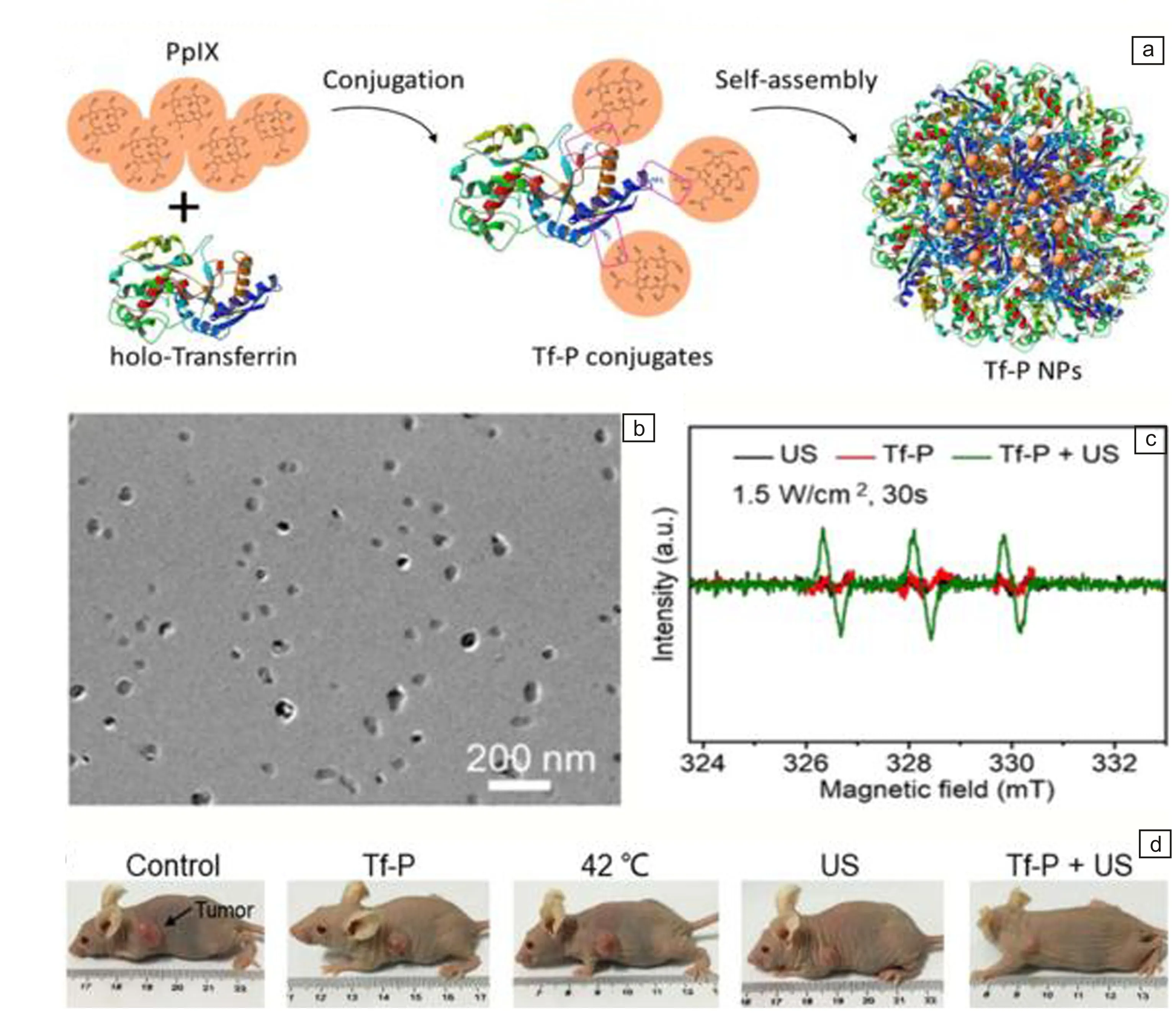
图3 转铁蛋白-原卟啉纳米颗粒用于肿瘤的声动力治疗[22]:(a)转铁蛋白-原卟啉纳米颗粒的形成示意图,(b)纳米颗粒的TEM照片,(c)纳米颗粒的活性氧(ROS)生成的电子自旋共振(ESR)谱图,(d)声动力治疗后小鼠的照片Fig.3 Transferrin-PpIX nanoparticles for sonodynamic therapy of tumors[22]: (a) schemetaic diagram for the formation of Transferrin-PpIX nanoparticles, (b) TEM image of nanoparticles, (c) ESR spectra of ROS generation of nanoparticles, (d) photos of mice after sonodynamic therapy
对有机分子声敏剂来说,理想的声动力治疗过程是:声敏剂先通过自组装形成纳米材料,经静脉注射到体内后,纳米结构能够防止声敏剂提前泄露,改善声敏剂的水溶性和血液循环。而当纳米材料到达肿瘤部位后,通过肿瘤部位的某些特定刺激发生解组装,释放声敏剂,从而消除声敏剂因局部高浓度造成的自淬灭效应,获得高的声动力性能。基于此,作者课题组[25]以血卟啉单甲醚为声敏剂模型,设计并合成了能够“按需组装和解组装”的卟啉纳米颗粒。首先通过酰胺化反应将血卟啉单甲醚和透明质酸连接,制备卟啉-透明质酸结合物;然后将结合物与过氧化氢酶混合,利用结合物和过氧化氢酶之间的相互作用,在中性pH下自组装制备了尺寸约为100 nm的纳米颗粒(CAT@HA-HMME,图4a)。制备的纳米颗粒不仅具有良好的水溶性和生物相容性,还能在血液中循环更长的时间(图4b和4c),其血液半衰期(t1/2= 4.17 h)是血卟啉单甲醚分子(~0.82 h)的5.08倍。更重要的是,纳米颗粒富集在肿瘤部位,在透明质酸的靶向牵引下进入肿瘤细胞后,细胞内的透明质酸酶能够水解纳米颗粒中的透明质酸,使之降解成寡聚糖,从而使得纳米颗粒发生解组装,释放卟啉单体和过氧化氢酶(图4d)。过氧化氢酶进而催化细胞内的过氧化氢转化为氧气,增加了肿瘤内的氧气浓度,释放的卟啉单体在接收超声波辐射后展现出远高于纳米颗粒的ROS量子产率。体内实验结果表明,CAT@HA-HMME在超声波辐射下极大地抑制了肿瘤生长,具有高效的抗肿瘤作用,抑瘤率可达78.1%。通过苏木精-伊红染色和血生化指标检测,作者课题组发现该纳米颗粒具有优异的生物安全性。与声敏剂递送纳米载体相比,这种“按需组装和解组装”理念能够实现对有机分子声敏剂在肿瘤部位的声动力性能的调控,同时为发展安全、高效、具有应用前景的声敏剂带来了新的希望。
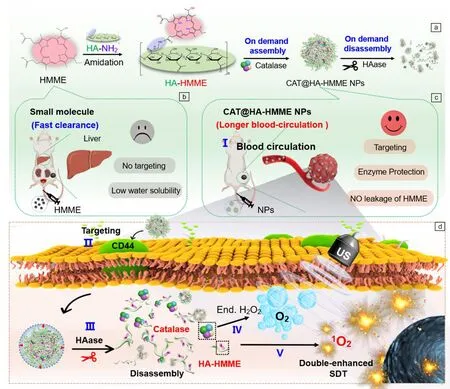
图4 按需组装-解组装的CAT@HA-HMME纳米颗粒用于肿瘤的声动力治疗[25]:(a)CAT@HA-HMME 纳米颗粒自组装和解组装过程的示意图,(b)血卟啉单甲醚分子的快速清除特征,(c)组装的CAT@HA-HMME纳米颗粒的延长的血液循环特征,(d)肿瘤细胞中CAT@HA-HMME纳米颗粒的按需解组装以促进声动力治疗的示意图Fig.4 On demand assembly-disassembly CAT@HA-HMME nanoparticles for sonodynamic therapy of tumors[25]: (a) schematic illustration of the assembly and disassembly process of CAT@HA-HMME nanoparticles, (b) HMME molecules with fast clearance feature, (c) the assembled CAT@HA-HMME nanoparticles with longer blood-circulation, (d) schematic illustration of on-demand disassembly of CAT@HA-HMME nanoparticles in tumor cells for boosting sonodynamic therapy
2.2 无机纳米声敏剂
随着纳米科技的发展,科学家们发现一些无机纳米材料本身能够在超声波辐射下产生ROS,可直接用作声敏剂。与有机分子声敏剂相比,无机纳米声敏剂具有以下优势[26]:① 尺寸和形貌可控,可以通过调节纳米材料的尺寸和形貌参数来获得更好的声动力性能;② 化学结构稳定,其ROS的生成速率不易受光漂白现象的干扰;③ 可作为成核点,在超声空化中促进微泡的生成。目前已报道的无机纳米声敏剂主要可以分为4类,分别是贵金属、碳基纳米材料、过渡金属氧化物和半导体化合物。其中,基于贵金属的无机纳米声敏剂包括金、银和铂等纳米材料[27-29]。碳基纳米材料如石墨烯和富勒烯等[30]具有高的导电性和大的比表面积,可以分离电子和空穴,在超声波辐射下产生大量ROS。由于存在丰富的氧缺陷结构,锰和锌等[31, 32]过渡金属氧化物经超声波辐射后,均可表现出超高的超声响应性能和ROS量子产率。除此之外,以TiO2为典型代表的半导体无机纳米声敏剂在超声波辐射下,能够快速发生电子和空穴分离,形成的电子和空穴能够和周围组织的氧气或水分子反应,快速产生ROS,因而在声动力治疗应用中得到迅猛发展[33]。2011年,日本福冈大学Harada等[34]最早发现在TiO2纳米材料存在的情况下,使用超声波辐射黑色素瘤细胞可使黑色素瘤细胞的细胞活力显著下降。随后,他们使用含聚烯丙胺的聚乙二醇接枝物修饰TiO2,制备了由TiO2和聚乙二醇组成的核壳型纳米胶束[35]。该纳米胶束不仅可以提高TiO2纳米颗粒在生理状态下的分散稳定性,还能促进TiO2纳米颗粒被宫颈癌细胞摄取,增强其在超声波辐射下对宫颈癌细胞的杀伤效果。2016年,韩国成均馆大学You等[36]设计了一种具有长循环的亲水HTiO2纳米颗粒,将其经静脉注射到小鼠体内后,可以在肿瘤和肝脏部位选择性富集。体内实验结果表明,在1.5 MHz超声波辐射330 s后,HTiO2纳米颗粒可以有效抑制深部肝脏肿瘤的生长。需要说明的是,尽管TiO2半导体纳米材料是一种有效的无机纳米声敏剂,但纯TiO2纳米颗粒的带隙较宽,经超声波辐射后产生的电子和空穴容易快速复合,制约了其声动力性能。
为提高TiO2无机纳米声敏剂的声动力性能,科学家们通过向TiO2中引入氧空位的方法来捕获超声波激发的电子,抑制电子和空穴复合,从而提高TiO2无机纳米声敏剂的ROS量子产率。2018年,中国科学院硅酸盐研究所陈雨研究组[37]通过铝热还原法在TiO2纳米晶表面还原生成一层氧空位TiO2-x层,制备了具有核壳结构的B-TiO2-x黑色纳米材料,并进一步使用聚乙二醇来改善其在体内的血液循环(图5a)。B-TiO2-x纳米材料的直径约为50 nm(图5b),其表面丰富的氧空位有助于促进电子和空穴快速分离,因此B-TiO2-x纳米材料表现出高效的声动力性能。在1.0 MHz超声波(功率密度为1.5 W/cm2)辐射下,B-TiO2-x纳米材料能够快速产生ROS, 其ROS的量子产率显著高于相同浓度的白色TiO2纳米晶(图5c)。同时,黑色的氧空位TiO2-x层还赋予了纳米材料优异的光热性能,其在1064 nm处的光热转换效率高达39.8%。将B-TiO2-x纳米材料静脉注射到小鼠体内后,在声动力治疗和光热治疗的协同作用下,小鼠肿瘤被完全根除且在监测期间无复发(图5d)。
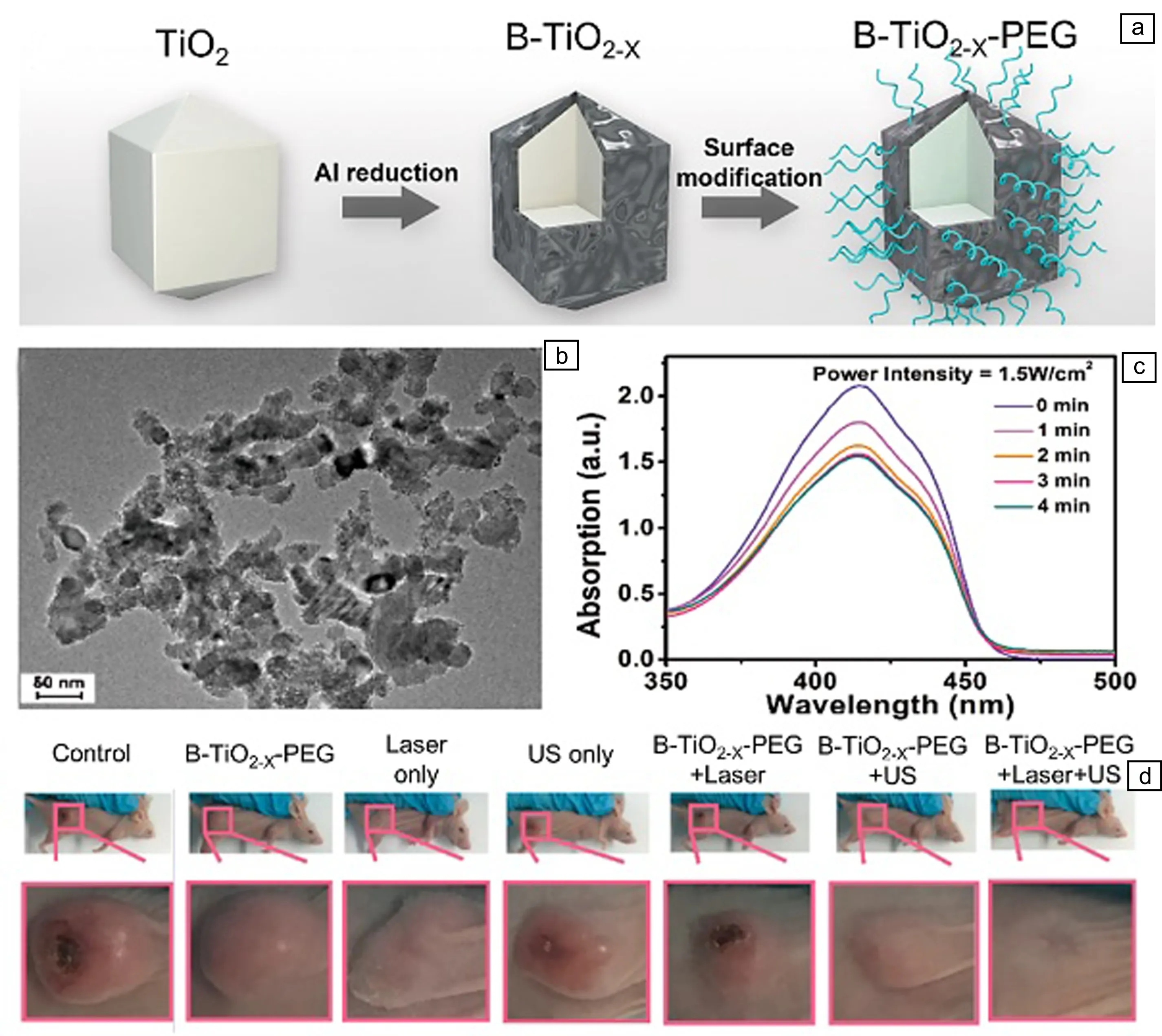
图5 氧空位的B-TiO2-x纳米材料用于肿瘤的声动力协同光热治疗[31]:(a)铝热还原法制备B-TiO2-x及聚乙二醇修饰过程的示意图,(b)B-TiO2-x纳米材料的TEM照片,(c)DPBF和B-TiO2-x纳米材料作用后在超声波辐射下的紫外吸收光谱,(d)采用不同方法治疗15 d的4T1荷瘤小鼠及其肿瘤区域的照片Fig.5 B-TiO2-x nanomaterials with oxygen vacancies for sonodynamic synergistic photothermal therapy of tumors[31]: (a) schematic illustration of the fabrication of B-TiO2-x and the modification of polyethylene glycol, (b) TEM image of B-TiO2-x nanomaterials, (c) UV-vis absorption spectra of DPBF after interaction with B-TiO2-x nanomaterials under ultrasound irradiation, (d) digital photos of 4T1 tumor-bearing mice and their tumor regions after varied treatments at the 15th day
除引入氧空位外,在TiO2纳米颗粒中掺杂金属或形成复合物也是提高其声动力性能的可行方法。2020年,苏州大学程亮研究组[38]通过热分解合成了超小的Fe掺杂TiO2纳米点(Fe-TiO2),并使用聚乙二醇对其进行表面修饰(图6a)。Fe掺杂能够降低TiO2的禁带宽度,提高电子和空穴的分离效率。他们研究了在不同Fe与Ti物质的量的比(1∶8、1∶4和1∶1)下合成的Fe-TiO2纳米点的声动力性能。尽管这些不同物质的量的比的Fe-TiO2纳米点具有与纯TiO2纳米点相似的尺寸(图6b),但相比于纯TiO2纳米点,所有Fe-TiO2纳米点均展现出增强的ROS量子产率(图6c)。同时他们发现,随着Fe含量的逐渐增加,Fe-TiO2纳米点的声动力性能先增加后降低,Fe与Ti物质的量的比为1∶4的Fe-TiO2纳米点的声动力性能最好。通过静脉注射到小鼠体内后,Fe-TiO2纳米点在超声波辐射下能够显著抑制肿瘤生长(图6d和6e)。2021年,中山大学巢晖等[39]将Ir和TiO2复合,制备了Ir-TiO2复合纳米材料用于声动力治疗。修饰在TiO2表面的Ir配合物能够作为陷阱捕获超声激发的电子,促进电子和空穴发生分离,增强复合纳米材料的声动力性能。体内实验结果表明,该复合纳米材料的抗肿瘤作用高于纯TiO2纳米颗粒,应用1.0 MHz超声波(功率密度为1.0 W/cm2)辐射300 s,Ir-TiO2复合纳米材料即可完全抑制肿瘤生长。
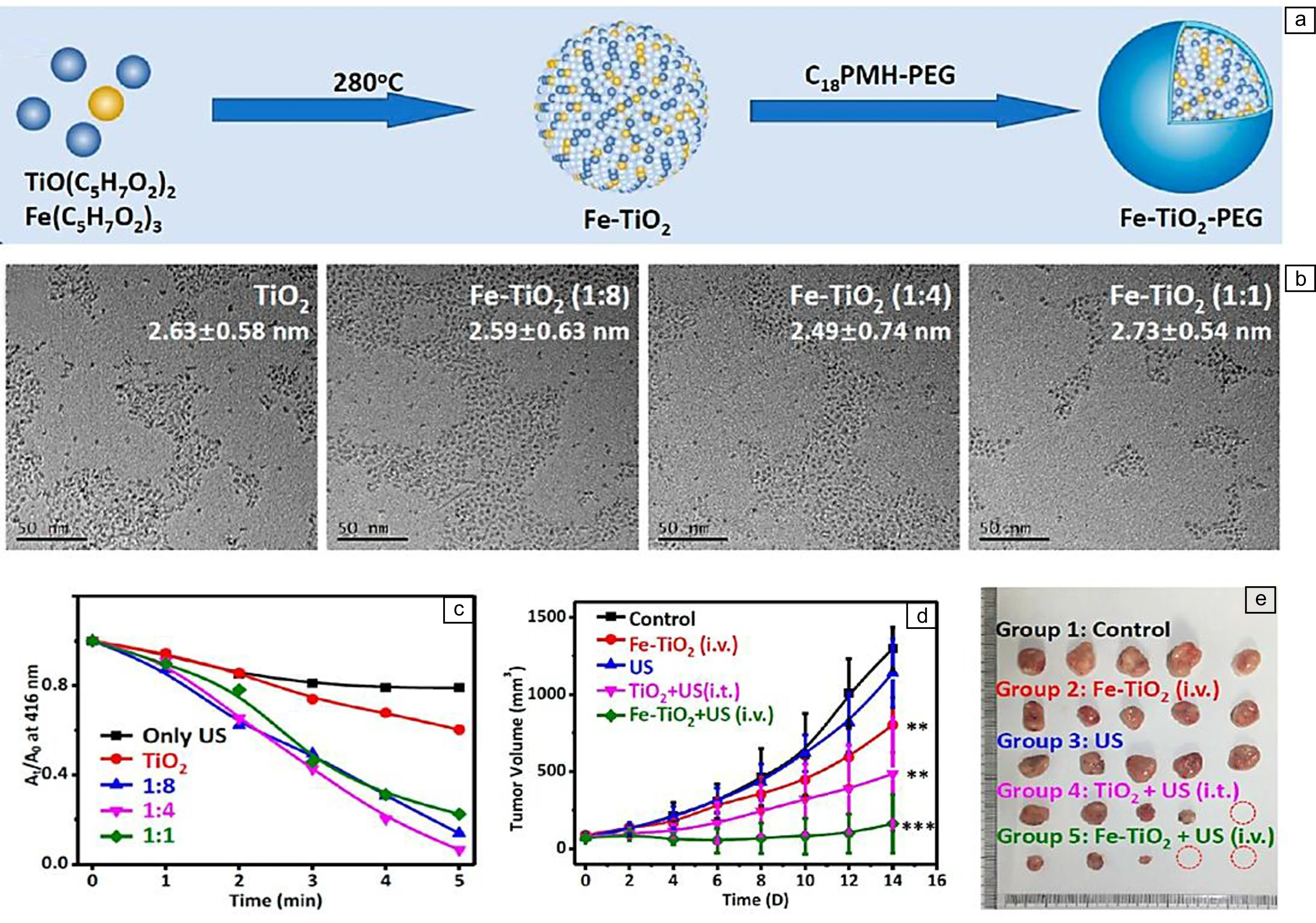
图6 铁掺杂TiO2纳米点用于肿瘤的声动力-化学动力学治疗[38]:(a)Fe-TiO2纳米点制备和聚乙二醇修饰的过程示意图,(b)Fe-TiO2纳米点的TEM照片,(c)DPBF和Fe-TiO2纳米点作用后在超声波辐射下的紫外吸收光谱变化图,(d)不同方法治疗后小鼠体内肿瘤体积变化的曲线,(e)治疗14 d后各组小鼠的肿瘤照片Fig.6 Fe-doped TiO2 nanodots for sonodynamic-chemodynamic therapy of tumors[38]: (a) schematic illustration of the process of preparation of Fe-TiO2 nanodots and modification of polyethylene glycol, (b) TEM images of Fe-TiO2 nanodots with different feeding ratios obtained via a similar method, (c) the change of UV-vis absorption spectra of DPBF after interaction with Fe-TiO2 nanodots under ultrasound irradiation, (d) curves of tumor volume changes in mice under different treatments, (e) tumor photos of mice in each group after treatments at the 14th day
除典型的无机纳米材料外,近年来还报道了一些其他新型的无机纳米声敏剂。2018年,北京化工大学刘惠玉课题组[40]首次发现沸石咪唑酸盐骨架衍生的碳纳米材料(图7a)具有类卟啉环结构,能够表现出与卟啉分子相似的超声响应性能。衍生碳纳米材料的尺寸约为140 nm (图7b),其类卟啉环结构在超声波辐射下能够形成微泡,辅助增强超声空化效应。当衍生碳纳米材料的浓度为100 μg/mL时,衍生碳纳米材料经超声辐射后的ROS产率较辐射前增加了203.6%,ROS量子产率明显高于相同浓度的纯多孔碳材料和锌卟啉化合物(图7c和7d)。该团队采用密度泛函理论研究了衍生碳纳米材料在超声波辐射下的能量结构。相比于纯多孔碳纳米材料和锌卟啉化合物,衍生碳纳米材料的HOMO轨道和LUMO轨道间隙最大(图7e),电子和空穴的转移速率最快。在小鼠肿瘤模型中,应用超声波(1 MHz, 1.5 W/cm2)辐射300 s,衍生碳纳米材料能够高效消融肿瘤(图7f),抑瘤率高达85%,并且对周围正常组织无损伤。之后,该团队进一步在沸石咪唑酸盐骨架表面修饰了一层介孔SiO2,依次通过部分刻蚀、原位生长锰和碳化刻蚀,制备了具有双层中空结构的ZIF-8@MnSiO3碳纳米材料[41]。锰的引入不仅能够提碳纳米材料核磁共振成像能力,还可以通过氧化还原反应加快电子和空穴的分离,提高ROS生成速率。经静脉注射到小鼠体内后,硅酸锰碳纳米材料具有强的核磁共振成像T1信号,且能够高效在肿瘤部位富集。体外细胞和体内动物实验结果均表明:与对照组相比,硅酸锰碳纳米材料在超声波辐射下能够有效杀伤肿瘤细胞,实现核磁共振成像指导的声动力治疗。此后,越来越多的研究人员开始关注碳基纳米材料,并且许多高性能碳基无机纳米声敏剂相继被开发。
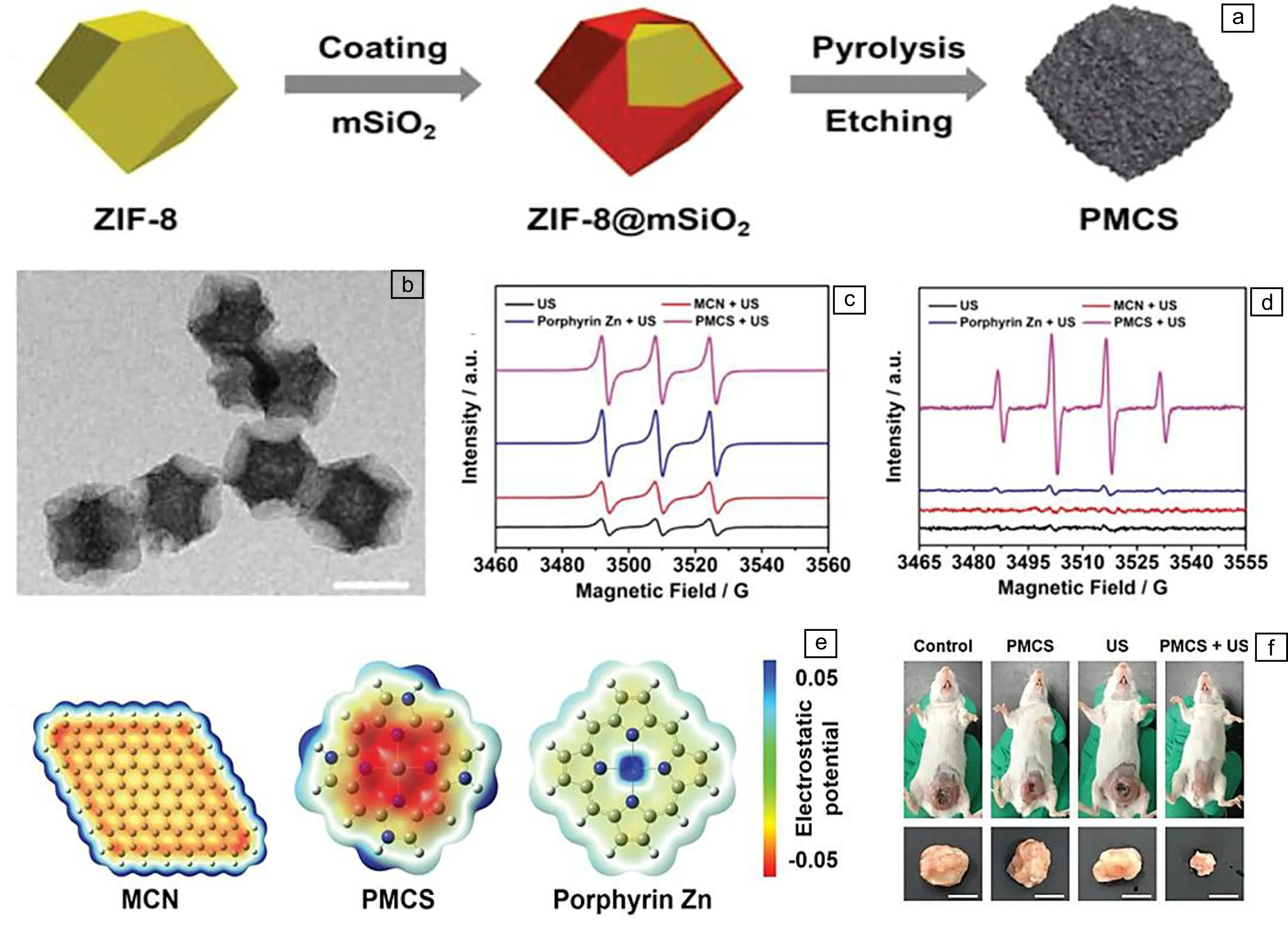
图7 衍生碳纳米材料用于肿瘤的声动力治疗[40]:(a)衍生碳纳米材料的形成过程示意图,(b)衍生碳纳米材料的TEM照片,比例尺为100 nm,(c)衍生碳纳米材料在超声激发后产生单线态氧的电子自旋共振谱图,(d)衍生碳纳米材料在超声激发后产生羟基自由基的电子自旋共振谱图,(e)纯多孔碳纳米球、衍生碳纳米材料和锌卟啉化合物分子模型的静电势分布,(f)治疗18 d后各组小鼠和肿瘤的代表性照片Fig.7 Derived carbon nanomaterials for sonodynamic therapy of tumors[40]: (a) schematic illustration of the formation process of derived carbon nanomaterials, (b) TEM image of derived carbon nanomaterials, the scale bar is 100 nm, (c) ESR spectra of 1O2 generation of nanomaterials upon ultrasound irradiation, (d) ESR spectra of ·OH generation of nanomaterials upon ultrasound irradiation, (e) electrostatic potential profiles of molecular models for porous carbon nanospheres, nanomaterials and zinc porphyrin compounds, (f) representative mice and tumor photos in each group after treatments at the 18th day
需要说明的是,尽管大多数无机纳米声敏剂具备临床转化的潜力,但其长期生物安全性是一个值得关注的问题。这些纳米材料在体内往往不可降解,所以给药时必须严控给药剂量以降低系统毒性,这就要求这些纳米材料具有高的声动力性能。因此,仍需开发性能高、生物安全性好的无机纳米声敏剂,以促进声动力治疗的临床应用。
2.3 有机-无机杂化纳米声敏剂
除有机分子声敏剂和无机纳米声敏剂外,科学家们还将有机和无机材料结合起来,发展了有机-无机杂化纳米声敏剂。特别是,由金属离子/团簇和有机声敏分子配位形成的金属有机框架(metal organic frameworks, MOFs)纳米材料具有巨大的应用潜力。在声动力治疗中,一方面,MOFs中的有机配体作为连接体,可以通过连接体-金属簇电荷转移原理吸收能量并激活金属簇[11],促进电子转移,使其快速产生ROS。另一方面,MOFs的多孔结构能够防止有机声敏分子发生自淬灭,促进ROS快速扩散,进而提高ROS量子产率。除此之外,MOFs具有比表面积大、孔隙率高和表面易于修饰等物理化学性质,有助于MOFs携带诊疗试剂,实现声动力治疗和其他治疗模式的联合治疗。2020年,作者课题组[42]将铁离子和血卟啉单甲醚结合,首次制备了一种新型的非晶MOFs声敏剂(FeCPs),并将其用作纳米载体递送阿霉素抗肿瘤药物(图8a)。FeCPs的平均粒径约为70 nm(图8b),比表面积为75.8 m2/g, 对阿霉素的载药率可达31.3%。在40 kHz超声波(功率密度为1.75 W/cm2)辐射下,FeCPs即可产生ROS(图8c)。将磷脂修饰的FeCPs经静脉注射到荷瘤小鼠体内,FeCPs在超声波辐射下能够有效地破坏瘦肉组织屏障覆盖的肿瘤,显著抑制深部肿瘤的生长(图8d)。
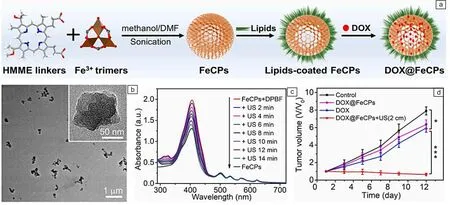
图8 铁血卟啉MOFs纳米材料用于肿瘤的声动力和化疗的联合治疗[42]:(a)DOX@FeCPs的合成过程示意图,(b)FeCPs的TEM照片,(c)BPDF和FeCPs作用后在超声波辐射下的紫外吸收光谱图,(d)治疗12 d后各组小鼠肿瘤体积变化的曲线Fig.8 Fe-hematoporphyrin MOFs nanomaterials for the combined treatment of sonodynamic and chemotherapy of tumors[42]: (a) schematic illustration of synthesis procedures of DOX@FeCPs, (b) TEM image of FeCPs, (c) UV-vis absorption spectra of DPBF after interaction with FeCPs under ultrasound irradiation, (d) curves of tumor volume changes of mice in each group after treatments at the 12th day
需要指出的是,声敏剂的高声动力性能并不完全等同于高的治疗效果,声动力治疗效果不仅依赖声敏剂,还受到肿瘤微环境中的底物浓度的影响。当声敏剂在肿瘤部位富集后,其和肿瘤微环境中的氧气发生作用,产生ROS,肿瘤部位的乏氧环境水平会限制ROS生成,从而影响声动力治疗效果。为解决乏氧问题,同时提高治疗效果,作者课题组[43]利用FeCPs的多孔结构负载过氧化氢酶和葡萄糖氧化酶,制备了一种多功能的有机-无机杂化纳米声敏剂(FeHF-GOx/CAT),并用叶酸修饰的聚乙二醇改善其亲水性和靶向性。在叶酸的靶向作用下,FeHF-GOx/CAT能够高效富集在肿瘤部位,并在超声波辐射下释放过氧化氢酶和葡萄糖氧化酶。过氧化氢酶能够催化肿瘤部位的过氧化氢转化为氧气,改善肿瘤的乏氧环境;同时葡萄糖氧化酶可以消耗肿瘤中的葡萄糖,产生过氧化氢,通过提供充足的底物来进一步增强过氧化氢酶的催化速率,因此这种级联酶负载可以显著提高ROS生成效率。在荷瘤小鼠模型中,由于级联酶和声动力治疗的联合作用,FeHF-GOx/CAT展现出优于单一声动力治疗或饥饿治疗的肿瘤抑制效果。此外,作者课题组[44]将具有过氧化氢酶活性的Pt纳米颗粒原位生长在载阿霉素MOFs表面,制备了一种可改善氧气释放的MOFs声敏剂用于乏氧肿瘤的声动力和化疗联合治疗。在超声波辐射下,Pt纳米颗粒在肿瘤细胞内催化过氧化氢分解,释放氧气。释放的氧气不仅能提高ROS量子产率(~4.5倍),还可以通过下调乏氧诱导因子α协同增敏化疗。因此,与单一声动力治疗相比,该方法通过化疗和声动力联合治疗实现了高效的肿瘤治疗效果。
除乏氧环境外,肿瘤细胞内还存在大量的谷胱甘肽,谷胱甘肽会和ROS发生氧化还原反应,清除声动力过程中产生的ROS,从而降低声动力治疗效果。因此,消耗谷胱甘肽也是提高治疗效果的有效策略之一。基于此,作者课题组[45]利用Mn3+的强氧化性,设计并制备了一种Mn3+和血卟啉单甲醚自组装的MOFs声敏剂(Mn(III)-HFs)(图9a),并对其表面进行聚乙二醇修饰以改善血液循环。Mn(III)-HFs纳米颗粒的直径约为95 nm,具有典型的非晶结构(图9b和9c)。由于Mn3+和谷胱甘肽能发生氧化还原反应,因此Mn(III)-HFs纳米颗粒能够消耗肿瘤细胞内的谷胱甘肽,生成Mn2+和氧化型谷胱甘肽(图9d),获得“一石三鸟”的效果:① 谷胱甘肽促进Mn(III)-HFs纳米结构坍塌,使其可以排出体外,提高纳米材料的生物安全性和降解性;② 谷胱甘肽还原生成的二价锰离子比三价锰离子具有更好的核磁共振成像能力;③ 谷胱甘肽的消耗和血卟啉单甲醚单体分子的释放均可促进ROS生成,增强声动力治疗效果(图9e和9f)。Mn(III)-HFs纳米颗粒经静脉注射到小鼠体内后,能够进行高对比度的T1/T2双模态核磁共振成像。同时在1 MHz超声波(2.5 W/cm2)辐射下,Mn(III)-HFs纳米颗粒具有良好的肿瘤抑制能力,能够抑制瘦肉组织屏障覆盖下的肿瘤的生长(图9g)。
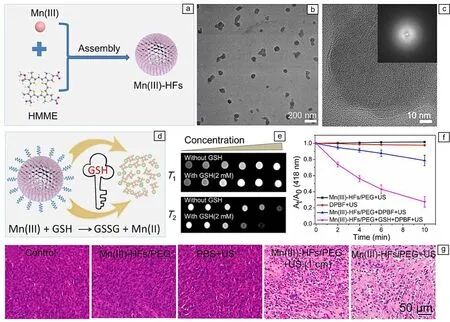
图9 谷胱甘肽消耗的锰血卟啉MOFs纳米材料用于肿瘤的声动力治疗[45]:(a)Mn(III)-HFs组装过程示意图,(b,c)Mn(III)-HFs的TEM照片,(d)谷胱甘肽(作为密钥)解锁Mn(III)-HFs/PEG的示意图,(e,f)谷胱甘肽解锁Mn(III)-HFs/PEG增强核磁共振成像和ROS生成,(g)治疗11 d后各组小鼠肿瘤苏木精与伊红染色的光学显微镜照片Fig.9 Glutathione depleting Mn-hematoporphyrin MOF nanomaterials for sonodynamic therapy of tumors[45]: (a) scheme showing the assembling process of Mn(III)-HFs, (b, c) TEM images of Mn(III)-HFs, (d) schematic illustration of the unlocking of Mn(III)-HFs/PEG using glutathione, (e, f) glutathione-depletion-enhanced magnetic resonance imaging and ROS generation of Mn(III)-HFs, (g) optical microscope photos of hematoxylin and eosin-staining tumors of mice in each group after treatments at the 11th day
尽管肿瘤微环境诸如低pH值、过量的谷胱甘肽等可以促进MOFs声敏剂在体内的快速降解,提高MOFs声敏剂的生物安全性,但大多数MOFs声敏剂和肿瘤微环境作用后降解成单体分子,这些单体分子往往积累在肝、脾、肺等网状内皮系统,对正常组织或器官的长期安全性仍存在潜在的威胁。为进一步提高MOFs声敏剂的生物安全性,作者课题组[46]又通过两步超声法合成了一种超小尺寸的MOFs纳米点(GdHF-NDs)。第一步,将含有Gd3+和血卟啉单甲醚分子的混合溶液置于水浴中,通过水浴超声使Gd3+和血卟啉单甲醚共价配位自组装形成配位聚集体(GdHF-A, ~400 nm);第二步,采用探针超声法将GdHF-A聚集体进行超声剥离,获得尺寸约为5 nm的GdHF-NDs超小纳米点(图10a和10b)。实验结果表明,在相同的超声波辐射条件下,制备的GdHF-NDs纳米点比GdHF-A聚集体能够更高效地产生ROS,其ROS量是后者的2.3倍(图10c和10d)。由于钆离子具有7个不成对电子,顺磁性强,因此,GdHF-NDs纳米点经静脉注射到荷瘤小鼠体内后,能够实现核磁共振成像指导的声动力治疗,有效抑制肿瘤的生长(图10e)。更重要的是,GdHF-NDs纳米点具有小尺寸效应,可以通过肾脏途径快速地代谢出体外。尿液分析结果表明:GdHF-NDs纳米点在体内不会分解,而是通过肾脏途径经尿液和粪便从小鼠体内排出(图10f)。值得指出的是,GdHF-NDs纳米点对血液、肝脏和肾脏等没有副作用,有效避免了因药物积累引发的长期毒性。该纳米点为制备安全和高效的声敏剂提供了一个新的范例。
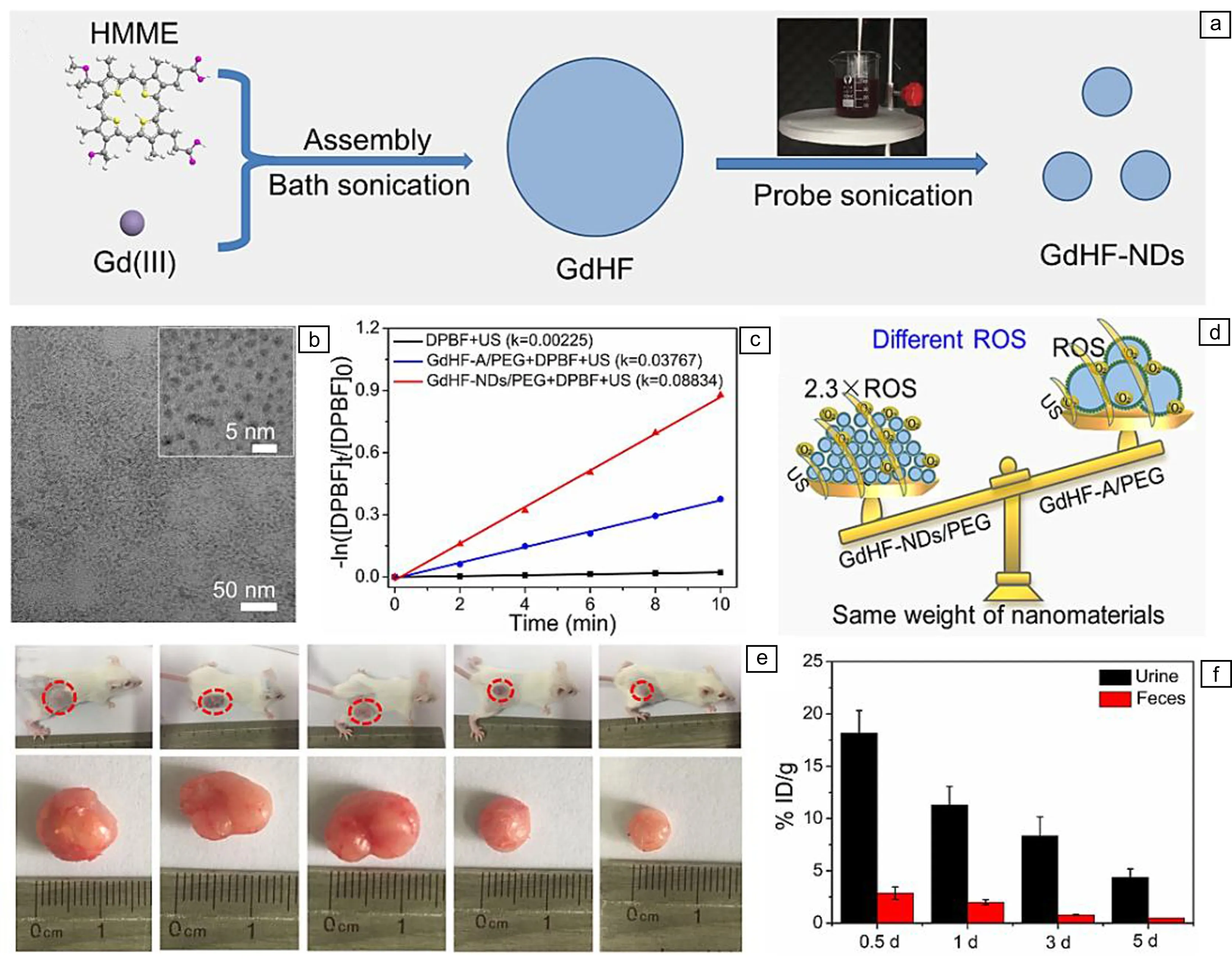
图10 肾脏可快速清除的钆血卟啉MOFs纳米点用于肿瘤的声动力治疗[46]:(a)探针超声法制备GdHF-NDs的示意图,(b)GdHF-NDs的TEM照片,(c) GdHF-NDs和GdHF-A在超声激发下产生ROS,(d)相同条件下,GdHF-NDs比GdHF-A产生更多ROS的示意图,(e)小鼠和肿瘤体积的照片,(f)GdHF-NDs在尿液和粪便的生物分布Fig.10 Ultrasmall gadolinium-hematoporphyrin MOFs nanodots with rapid renal clearance for sonodynamic therapy of tumors[46]: (a) scheme showing the preparation of GdHFs via a probe sonication route, (b) TEM image of GdHF-NDs, (c) ROS generation of GdHF-NDs and GdHF-A upon ultrasound irradiation, (d) schematic illustration of GdHFs-NDs generating more ROS than GdHF-A under the same conditions, (e) photos of mice and tumor volumes, (f) biodistribution of GdHF-NDs in urine and feces
4 结 语
声动力治疗是利用超声波激发肿瘤部位的声敏剂产生毒性活性氧(ROS)来杀死肿瘤的方法,其核心是声敏剂。目前,科学家们已经发展了3类声敏剂用于肿瘤的声动力治疗,包括有机分子声敏剂、无机纳米声敏剂和有机-无机杂化纳米声敏剂。这3类声敏剂在声动力治疗方面均取得了显著进展。然而,这些声敏剂在能够应用于临床之前,仍然面临着许多挑战:① 声敏剂的生物安全性及其在体内的代谢研究仍处于起步阶段;② 复杂的肿瘤微环境影响声敏剂在肿瘤组织中的ROS生成效率;③ 将声敏剂负载抗肿瘤药物,可以实现声动力治疗和其他治疗方法的联合,提高肿瘤治疗效果,但如何控制药物在肿瘤部位的精准释放还需进一步研究;④ 声敏剂功能单一,其声动力治疗效果受限于超声波辐射,一旦超声波辐射停止,声动力治疗将立马停止,因此单一声动力治疗往往无法彻底治愈肿瘤,复发率高。
为更好地促进声动力治疗的临床应用,还有待于在以下方面进行研究:① 设计、合成具有更好生物相容性和生物降解性的声敏剂,确保其降解产物能够通过人体代谢系统进行快速处理。未来该方面的工作可集中在使用生物矿化或生物活性物质来制备安全无毒的声敏剂方面,例如,生物大分子、生物体代谢物、细胞或有机基质。这些生物矿化或生物活性物质来源于生命体,在体内代谢快且代谢时不会产生有害物质,因此生物矿化或生物活性物质形成的声敏剂有望实现安全、零毒性、快代谢的声动力治疗。② 充分利用肿瘤微环境的物理特性,提高声敏剂在肿瘤组织中的ROS量子产率。可将现有声敏剂和肿瘤微环境响应组分结合,通过肿瘤微环境调控声敏剂的ROS生成速率,或开发不依赖氧气的声敏剂来提高其声动力性能。③ 通过超声波精准控制药物在肿瘤部位的释放。使用超声响应的聚合物对声敏剂进行包封,同时负载抗癌药物,然后在超声波辐射下,聚合物共价键发生断裂,从而促进药物释放。这种超声波触发的药物释放可充分利用超声波的能量,能够最大限度地提高联合治疗的效果。④ 将声动力和其他治疗模式联合可解决其功能单一的问题,声敏剂可以弥补其他治疗模式的不足或通过协同作用增强治疗效果,而高效的联合治疗依赖于声敏剂,开发高性能的多功能声敏剂仍是进一步提高疗效的关键。尽管声动力治疗距离临床应用还将面临一些长期的挑战,但科学家们已取得重要进展。预计未来声动力治疗将在临床癌症治疗,尤其在要求精准递送的深层组织,以及在需要跨越血脑屏障的大脑特定区域的癌症治疗方面取得更多进展。
