1,4-丁二偕胺肟在Cu(Ⅱ)/Ni(Ⅱ)/U(Ⅵ) 存在下的官能团转化反应
2022-10-10刘婷婷高成琪杨素亮田国新
刘婷婷,柳 倩,高成琪,郝 轩,周 今, 薛 云,杨素亮,*,田国新
(1.哈尔滨工程大学,黑龙江 哈尔滨 150001;2.中国原子能科学研究院,北京 102413)
海水中铀的储量约为45亿吨,是陆地已探明铀矿储量的数百倍[1]。但海水提铀是过去几十年铀资源开发领域最具挑战性的难题之一[2],到目前为止尚未研发出经济可行的海水提铀技术。以聚乙烯为支撑材料、丙烯腈为聚合单体,经辐照接枝和羟胺功能化制备的偕胺肟基吸附材料具有成本低廉、与铀酰离子结合能力强、选择性好等优点,且易于制成便于海水提铀实施的纤维,目前被认为是最有应用前景的吸附材料[3]。但该类材料还存在铀吸附容量仍不够高、重复使用后吸附容量显著下降、选择性仍有待提高等问题。为进一步提高其海水提铀性能,科研人员近20年来主要从两个方向进行了努力。一方面,通过提高接枝率来提高材料提铀功能基团的比例,以提高其铀吸附容量,接枝率已高达300%[4],但吸附容量的提升并不如预期。另一方面,从材料表面不同官能团与铀酰及共存金属离子相互作用的角度出发[5-6],量化不同官能团与金属离子的结合能力,指导优化吸附材料的制备过程,调控对铀有选择性的官能团占比,以达到同时提高铀吸附容量及选择性的目的。
丙烯腈聚合过程可能有“头对尾”和“头对头”两种方式,羟胺官能团化过程中不同的实验条件也会产生不同结构的官能团。偕胺肟基吸附材料的主要表面官能团有开链的二偕胺肟结构和环状的酰亚胺二肟结构[7],其中开链二偕胺肟结构的比例相对较大。为准确、定量测定这两种结构官能团对相关金属离子的结合能力,科学家们用结构类似的水溶性小分子配体模拟这些官能团,在水溶液中研究这些官能团与铀酰等金属离子的相互作用及官能团自身的转化反应。过去10年不同国家的研究结果均表明,环状结构的酰亚胺二肟对铀的结合能力稍强于开链结构的二偕胺肟[6,8-13];Cu(Ⅱ)、Ni(Ⅱ)、U(Ⅵ)存在时,二偕胺肟官能团会发生不同的环化反应[14]。因此认为,金属离子存在下官能团的转化反应需要进一步深入研究。
“头对尾”聚合且羟胺官能团化后生成戊二偕胺肟结构,“头对头”聚合生成丁二偕胺肟和己二偕胺肟结构,加热条件下二偕胺肟结构又可经环化反应生成酰亚胺二肟结构[15-16]。在详细考察偕胺肟基吸附材料制备、海洋提铀实施、铀洗脱以及材料再生过程的基础上,本课题组近几年系统展开了对相关小分子化合物的转化反应及其与相关金属离子的配位化学研究[17]。本文研究1,4-丁二偕胺肟(H2L)在加热、酸碱溶液中,以及有Cu(Ⅱ)、Ni(Ⅱ)、U(Ⅵ)存在条件下发生的化学反应及其反应机制。
1 实验
1.1 主要试剂
1,4-丁二偕胺肟(H2L)和丁二酰亚胺二肟(H3ⅠL),参照文献[16]方法在实验室制备,1H NMR测得其纯度均大于99%,两者结构及与偕胺肟基吸附材料表面官能团的对应关系如图1所示;重水,赛默飞世尔科技公司;氘代盐酸(DCl)和氘代氢氧化钠(NaOD),Sigma-Aldrich试剂公司;氘代二甲基甲酰胺(DMF-d7),伊诺凯试剂公司;四甲基硅烷(TMS),核磁级,Aladdin试剂公司;N-羟基丁二酰亚胺,生化试剂,国药集团化学试剂有限公司;六水合硝酸铀酰,分析纯,中国医药公司北京化学试剂有限公司。其他化学试剂均为分析纯或更高纯度。
1.2 核磁共振氢谱(1H NMR)测定
核磁共振谱使用瑞士布鲁克拜厄斯宾有限公司(Bruker-Biospin)的Magent System 400′54 Ascend 400 MHz核磁共振谱仪进行测定。重水作溶剂的实验用四甲基硅烷为外标对核磁共振谱进行定标;氘代二甲基甲酰胺作溶剂的实验用溶剂峰对核磁共振谱进行定标。
1.3 金属配合物单晶培养及结构测定
将含有H2L和CuCl2(摩尔比为2∶1)的微酸性水溶液敞口置于室温下,约1周得到紫色块状晶体,经分析为Cu(HⅢL)2(配合物1,CCDC号为2184261)。将丙酮缓慢挥发至含H2L和Cu(NO3)2(摩尔比为1∶1)的50%乙醇水溶液中,约2周后得到深绿色块状晶体,经分析为Cu3(H2ⅣL)3(H2O)3·(NO3)3(配合物2,CCDC号为2184262)。使用Ni(NO3)2替换Cu(NO3)2,采用与配合物2相同的培养方法,得到绿色块状晶体,经分析为Ni3(H2ⅣL)3-(H2O)6·(NO3)3(配合物3,CCDC号为2190901)。经更换溶剂、改变金属离子与配体的摩尔比、改变培养温度等多种尝试,仍未能成功从H2L与U(Ⅵ)的混合溶液中获得金属配合物晶体,仅获得金属配合物沉淀。制备方法如下:将摩尔比为2∶1的H2L溶夜与硝酸铀酰溶液混合,在电热板上加热(溶液温度不超过80 ℃)约10 min,冷却后过滤得到砖红色沉淀,室温下真空干燥至恒重。
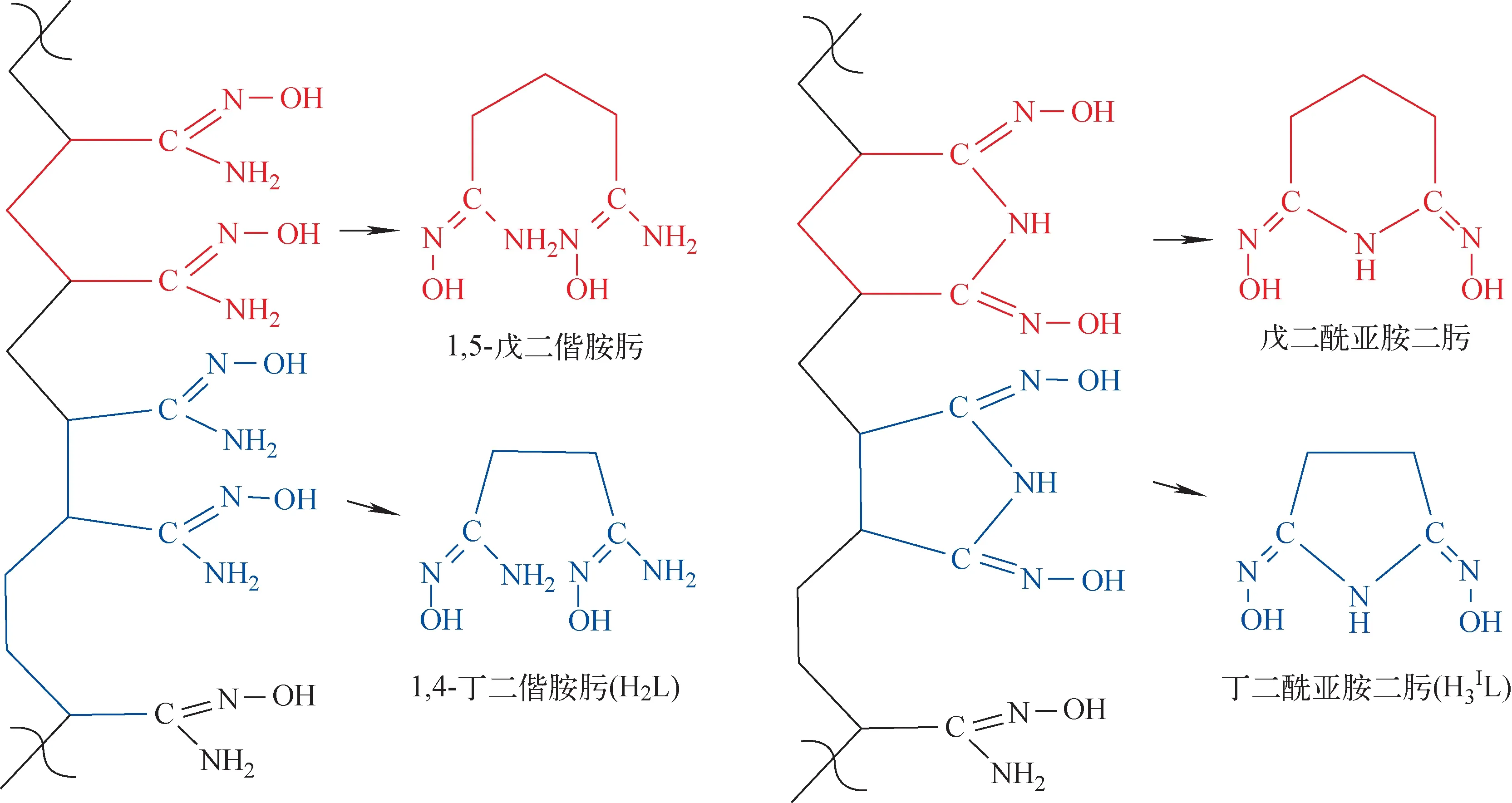
图1 偕胺肟基吸附材料表面主要官能团结构及相应的小分子配体Fig.1 Small molecule ligand and representing major functional group on surface of amidoxime-based adsorbent
配合物单晶均在SuperNova Atlas单晶衍射仪上使用Mo靶(λ=0.710 73 nm)进行X射线衍射,数据收集过程中晶体温度保持在100.01(10) K。晶体结构通过直接法解得,使用SHELXT程序包[18]进行精修。
1.4 吸收光谱测量
采用Cary 7000光谱仪收集实验所需吸收光谱,光谱采集的波长范围为200~350 nm,狭缝宽度为1.0 nm,收集步长为0.25 nm。吸收光谱的测量光程为10 mm,测量时样品的温度控制在(25.0±0.2) ℃。
2 结果和讨论
2.1 H2L在加热条件下及酸、碱溶液中的化学反应
偕胺肟基吸附材料在制备或使用过程中的温度变化,可能导致已生成的偕胺肟官能团之间继续发生化学反应;而在提铀实施前,常用碱溶液对材料进行预处理,提铀实施后常用酸溶液进行铀的洗脱和吸附剂的再生。本工作通过检测H2L在加热条件以及酸、碱溶液中随时间变化的核磁共振谱来监测配体的稳定性及化学反应。
1) H2L在加热条件下的1H NMR谱
将H2L溶解于DMF-d7中,加热至130 ℃并定时取样测量,得到加热条件下H2L的1H NMR谱,结果如图2a所示。由图2a可见,H2L的核磁信号逐渐减小直至消失,同时新的化合物丁二酰亚胺二肟(H3ⅠL)的核磁信号出现并逐渐增强,说明H2L在加热条件下发生环化反应逐渐转化为H3ⅠL。推测其反应机制如图2b所示,加热条件下H2L的1个氨基进攻另一端肟基的双键发生加成反应,并脱去1个NH3分子后环化生成H3ⅠL。据此可推测,在偕胺肟基吸附材料的制备过程中,部分开链的二偕胺肟结构有可能转化为环状的酰亚胺二肟结构,但需要较高的反应温度,反应速率也较慢。
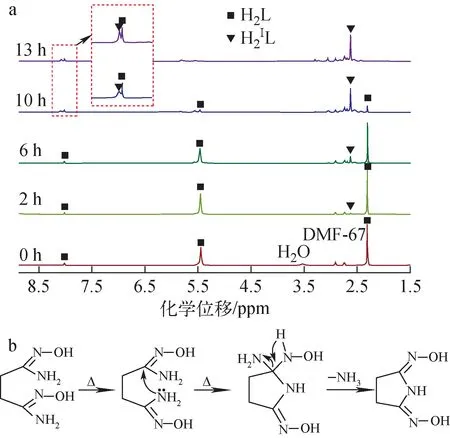
图2 130 ℃下DMF-d7中H2L随时间变化的 1H NMR谱(a)及可能的反应机制(b)Fig.2 Evolution of 1H NMR spectrum of H2L with time in DMF-d7 at 130 ℃ (a) and possible reaction pathway (b)
2) H2L在酸、碱溶液中的1H NMR谱
室温下0.2 mol/L H2L在1 mol/L DCl和1 mol/L NaOD溶液中的1H NMR谱如图3所示。由图3a可见,室温下H2L在酸中发生两步化学反应,依次生成N-羟基丁二酰亚胺(HⅡL)和丁二酸。由图3b可见,与在酸溶液中的反应不同,H2L在1.0 mol/L NaOD溶液中相对稳定,25 d内未发生明显变化。
2.2 H2L在Cu(Ⅱ)、Ni(Ⅱ)存在下的反应
1) H2L与Cu(Ⅱ)、Ni(Ⅱ)配合物的晶体结构

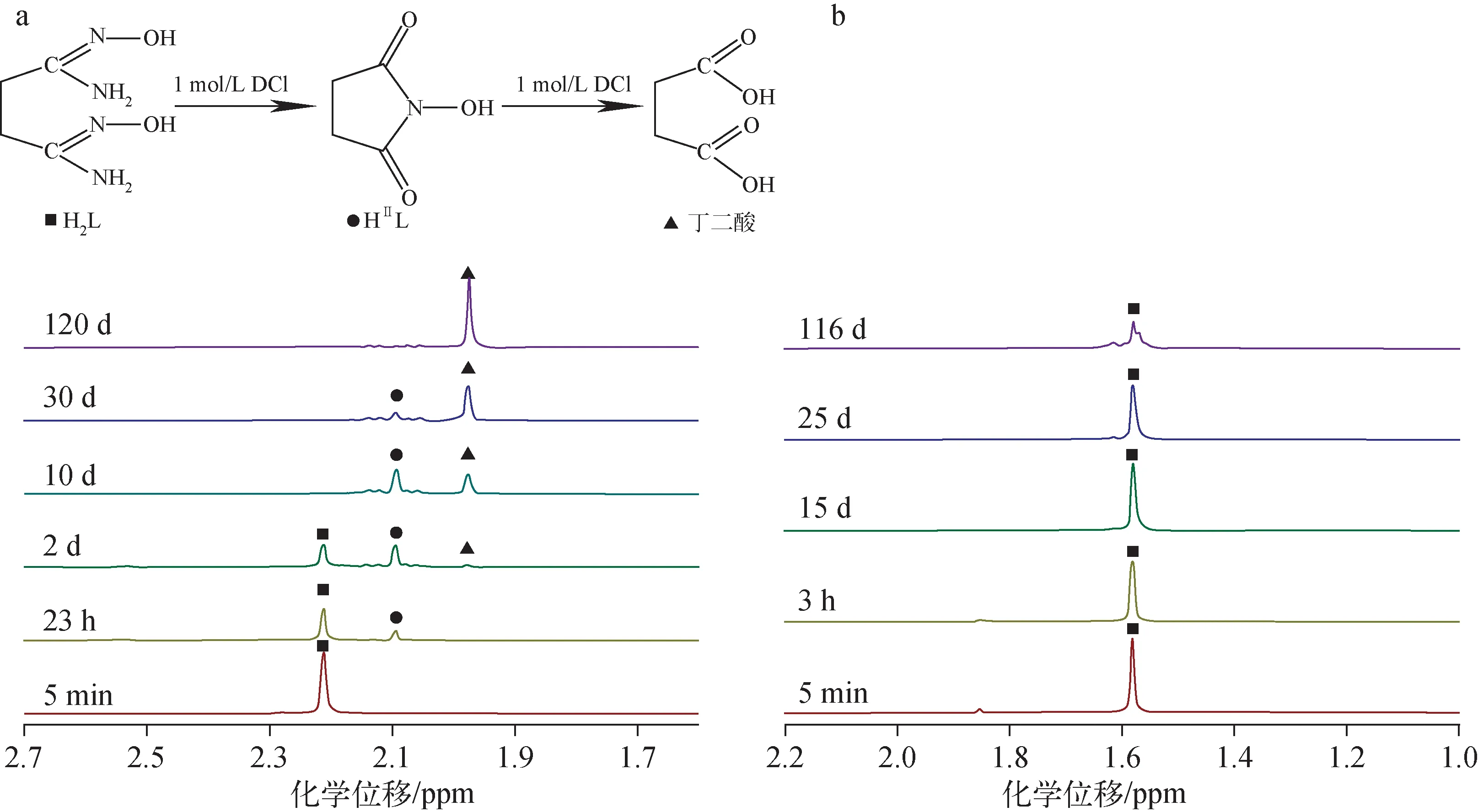
图3 室温下H2L在1 mol/L DCl(a)和1 mol/L NaOD(b)的1H NMR谱Fig.3 1H NMR spectrum of H2L in 1 mol/L DCl (a) and 1 mol/L NaOD (b) at room temperature
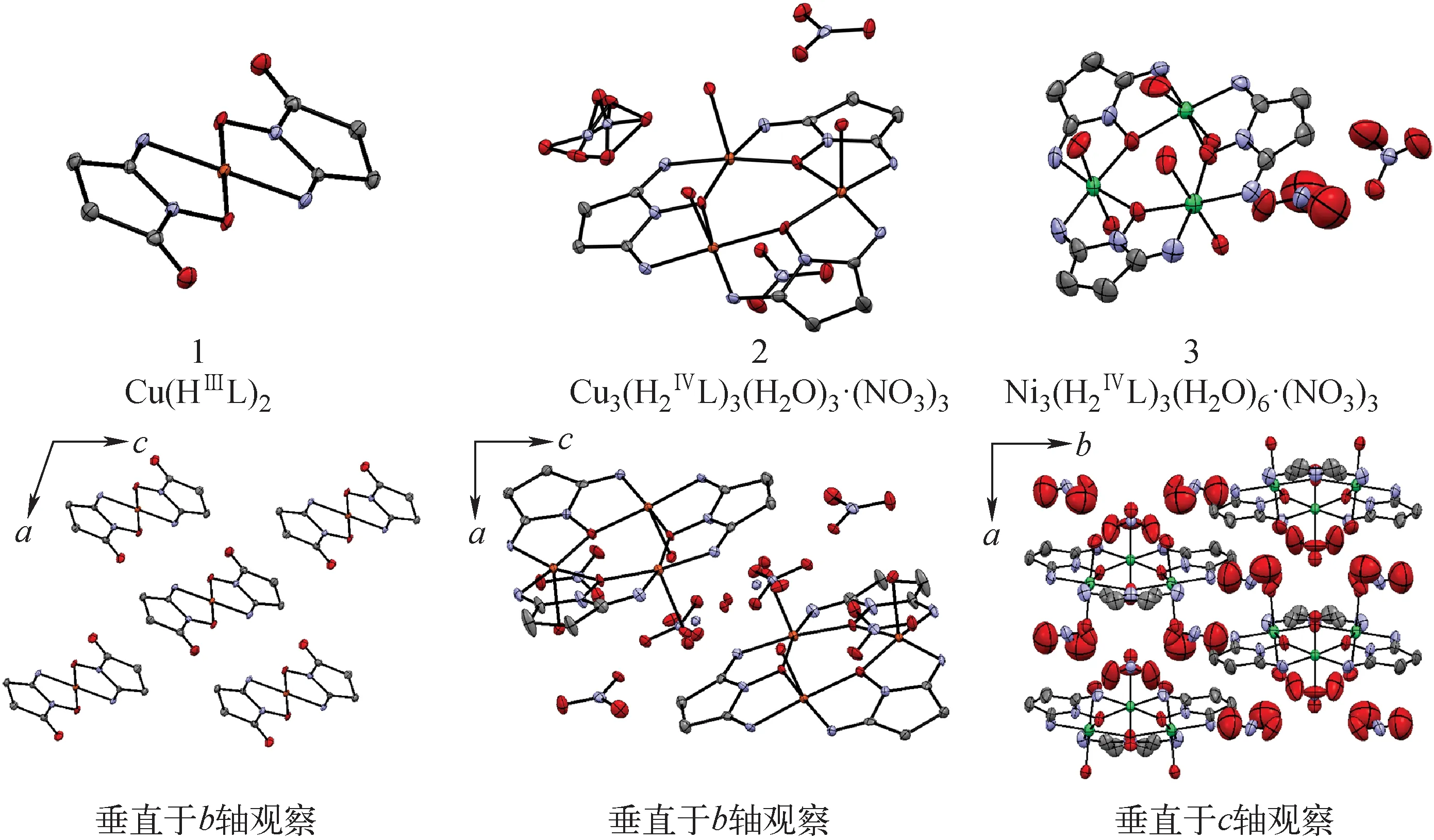
图4 以50%椭球率显示的配合物晶体结构Fig.4 Crystal structures of three complexes at 50% probability ellipsoids
2) H2L与Cu(Ⅱ)、Ni(Ⅱ)反应机制推测
多数有机配体在紫外区具有特征吸收光谱。定量称量配合物1和配合物3的晶体,用稀酸溶解并定容后,测量其紫外区的吸收光谱,如图5所示。由图5可见,无论配合物1还是配合物3,解离后的配体在酸溶液中的吸收光谱的特征均与N-羟基丁二酰亚胺(HⅡL)的一致,表明2个配合物中的1-羟基-5-亚氨基吡咯烷-2-酮和2,5-二亚氨基吡咯烷-1-醇结构在酸溶液中均不稳定,都会水解为HⅡL。

表1 配合物单晶的晶体学数据Table 1 Crystallographic data of single crystal complexe
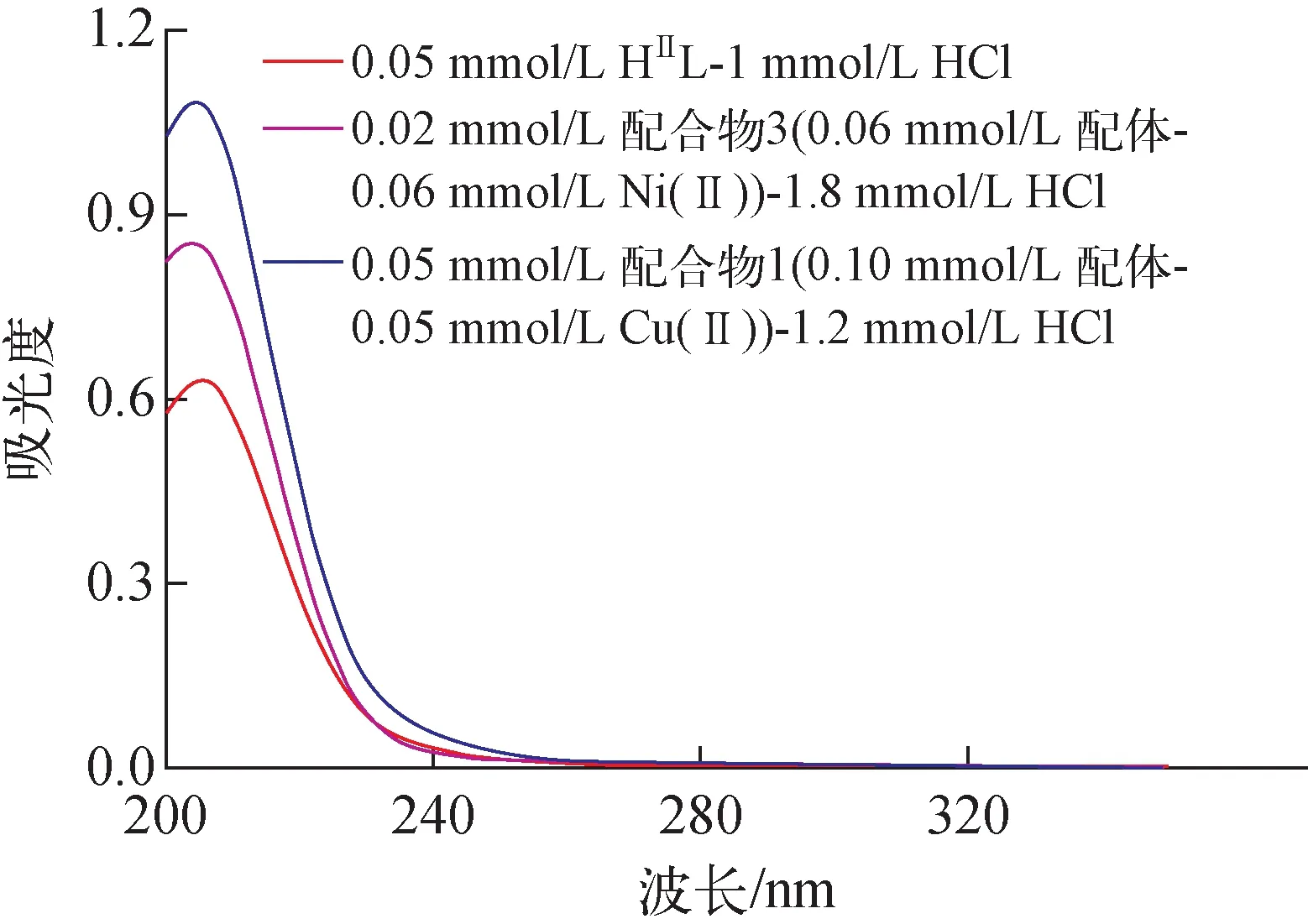
图5 酸解离后配合物1和配合物3与HⅡL的吸收光谱Fig.5 Adsorption spectra of complex 1 and 3 after acid dissociation compared with HⅡL

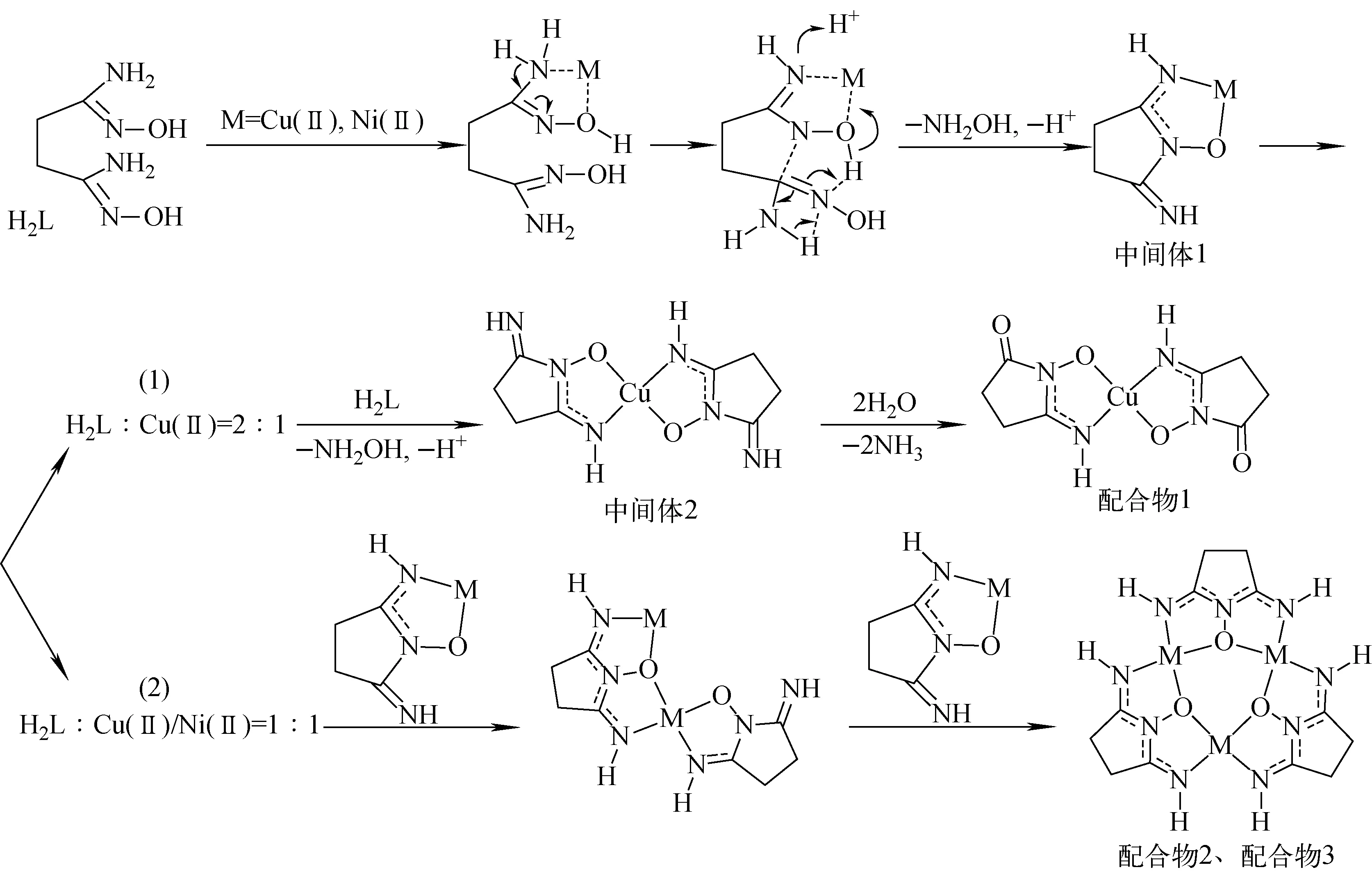
图6 H2L与Cu(Ⅱ)、Ni(Ⅱ)反应的可能机制Fig.6 Possible mechanism of reaction between H2L and Cu(Ⅱ), Ni(Ⅱ)
2.3 H2L在U(Ⅵ)存在条件下的反应
1) H2L与U(Ⅵ)配合物沉淀分析
将一定质量的U(Ⅵ)配合物沉淀消解后通过ICP-OES测量其中铀含量,进而估算出该配合物中U(Ⅵ)与配体的摩尔比为1∶1。用稀酸定量溶解H2L和U(Ⅵ)混合溶液中制备的砖红色配合物沉淀,然后收集所得溶液在紫外区的吸收光谱,并与H2L、H3ⅠL、HⅡL的吸收光谱进行比较,结果如图7所示。虽然该配合物沉淀是通过H2L与U(Ⅵ)反应而获得,但其酸解离后溶液吸收光谱的特征却与闭环结构的丁二酰亚胺二肟(H3ⅠL)的一致,这说明在形成配合物的过程中,H2L发生官能团环化反应转化为H3ⅠL。与H2L加热环化生成H3ⅠL的反应条件相比,H2L在U(Ⅵ)存在时的环化反应所需温度相对较低,反应速率也快得多。
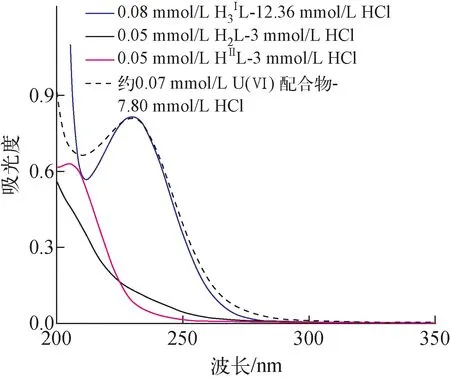
图7 U(Ⅵ)配合物沉淀酸解离溶液与H2L、 H3ⅠL、HⅡL溶液吸收光谱的对比Fig.7 Comparison of absorption spectra of U(Ⅵ) complex solution after acid dissociation with solutions of H2L, H3ⅠL and HⅡL
2) H2L与U(Ⅵ)生成配合物的反应机制推测
根据配合物酸解溶液的紫外吸收光谱,可推断H2L在加热条件下会与U(Ⅵ)发生化学反应生成H3ⅠL的金属离子配合物。通过分析该配合物沉淀的化学组成,可知配合物中U(Ⅵ)与H3ⅠL的摩尔比为1∶1。根据以上信息,对加热条件下H2L与U(Ⅵ)的化学反应进行了反应机制推测,结果如图8所示。
U(Ⅵ)首先与1,4-丁二偕胺肟的1个偕胺肟官能团双齿配位形成五元环结构,在加热条件下配位后的氨基N原子攻击另1个偕胺肟官能团的C原子,脱去1个NH3分子后U(Ⅵ)与新生成的H3ⅠL以稳定的三齿配位模式存在。考虑到配合物中U(Ⅵ)与H3ⅠL的摩尔比为1∶1,结合之前对H3ⅠL与U(Ⅵ)反应研究的结果[17],推测配合物沉淀中的配合物分子同样以双核配合物的形式存在。
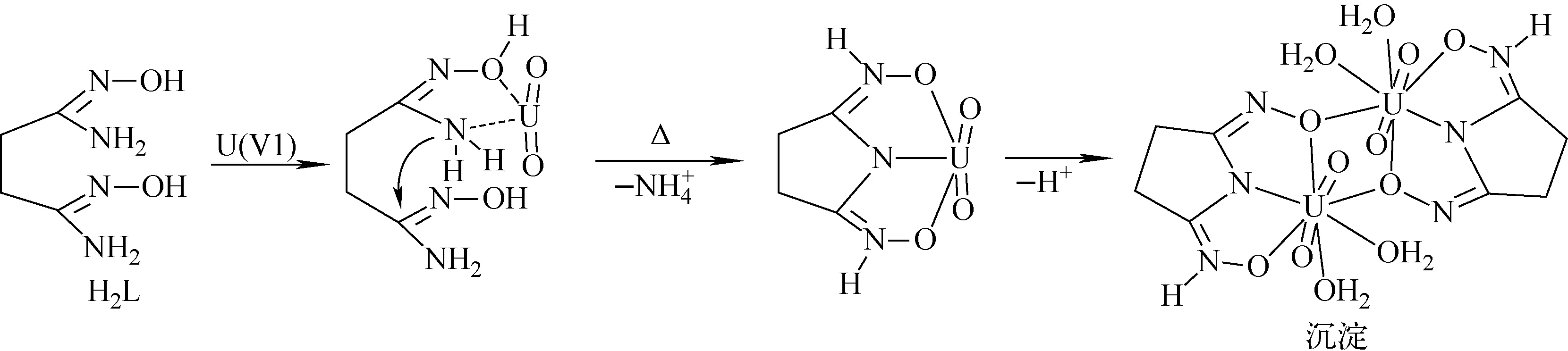
图8 H2L与U(Ⅵ)反应的可能机制Fig.8 Possible mechanism of reaction between H2L and U(Ⅵ)
3 结论
1H NMR测定结果表明,在没有金属离子存在时,H2L在130 ℃加热13 h后可完全脱氨环化生成丁二酰亚胺二肟;在酸性溶液中不稳定,室温下在1 mol/L DCl中数天内完全转化为N-羟基丁二酰亚胺,1个月后完全酸解为丁二酸;在碱性溶液中相对稳定,近1月时间内在1.0 mol/L NaOD溶液中未观察到明显的化学反应。
配合物结构和组成测定表明,在不同金属离子存在的条件下,H2L会与金属离子相互作用生成配合物,同时发生多种官能团结构的转化反应。有Cu(Ⅱ)、Ni(Ⅱ)存在时,H2L官能团会由二偕胺肟结构转变为2,5-二亚氨基吡咯烷-1-醇结构或1-羟基-5-亚氨基吡咯烷-2-酮结构;配合物酸解离后,均水解生成N-羟基丁二酰亚胺,N-羟基丁二酰亚胺又会逐渐水解生成丁二酸。加热条件下,H2L会与U(Ⅵ)反应生成丁二酰亚胺二肟(H3ⅠL)的U(Ⅵ)配合物,与H2L加热环化生成H3ⅠL的反应相比,条件相对温和,反应速率也快得多。这一发现在除加热环化反应外,提供了一种新的将二偕胺肟结构官能团转化为与铀亲和能力更强的酰亚胺二肟结构官能团的途径。
