巴西坚果过敏原Ber e 1的分离纯化及表征鉴定
2022-10-09徐骥远罗水忠吴志华
唐 宇,徐骥远,张 英,罗水忠,吴志华
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.合肥工业大学食品与生物工程学院,安徽 合肥 230009;4.南昌大学中德联合研究院,江西 南昌 330047)
坚果是一类外壳坚硬,内部包含可食用果仁的食物,也是8大类过敏食物之一。坚果富含油酸、亚油酸等不饱和脂肪酸、蛋白质、维生素、矿物质和膳食纤维等多种营养成分,能有效降低患心血管疾病的风险,同时还能提高免疫力、促进生长发育和延缓衰老等。随着经济和生活水平的提高,坚果类休闲食品日益受到欢迎,据统计,中国坚果行业市场销售规模从2014年的556亿 元迅速增长到2020年的1 800亿 元,进口坚果包括开心果、碧根果和巴西坚果越来越受到消费者青睐。因此,人们接触到坚果过敏原的机会也变得更多。
巴西坚果()又名巴西栗,也称鲍鱼果,营养丰富,是玉蕊科巴西栗属的植物,主要生长在亚马逊地区如巴西、秘鲁、哥伦比亚和委内瑞拉等。巴西坚果过敏的症状包括喉咙瘙痒、唇肿、呼吸困难、黄斑疹等。国际免疫学会联合会已经确认了其中的2 种过敏原蛋白,Ber e 1和Ber e 2。
Ber e 1属于2S白蛋白家族,占巴西坚果总蛋白含量的30%左右,富含甲硫氨酸(占18%)和半胱氨酸(占8%)。含硫氨基酸是人类和动物饮食中必不可少的,具有很高的营养价值。Ber e 1中-螺旋占比30%~47%,合成时分子质量为18 kDa,翻译加工后分子质量降为12 kDa,由一个9 kDa的大亚基和3 kDa的小亚基通过二硫键连接组成,等电点为6.3,有较强的热稳定性和耐消化性。Pastorello等收集了11 名巴西坚果过敏患者血清,它们均能识别过敏原蛋白Ber e 1。Ber e 2是一种11S球蛋白,分子质量为29 kDa。Beyer等收集了27 名巴西坚果过敏患者血清,其中有56%的患者血清能识别该蛋白。
对Ber e 1的深入研究,首先需要将过敏原蛋白纯化出来。有较多研究采用高效液相色谱法或两步法分离过敏原蛋白Ber e 1。Dearman等先使用尺寸排阻法分离目的蛋白,后通过反相高效液相色谱法进一步纯化Ber e 1,该方法得到的蛋白纯度较高,但操作步骤繁琐,对仪器要求也比较高。Moreno等利用凝胶过滤色谱和色谱聚焦梯度串联法等纯化获得天然Ber e 1,但该方法操作较为复杂且耗时长。此外,这些方法仅能获得较少量的目的蛋白。巴西坚果过敏原蛋白纯化量少,限制了对巴西坚果过敏的研究。因此,探索建立简单经济高效的Ber e 1纯化方法,有望推动其研究的深入。
花生过敏原蛋白Ara h 2和Ber e 1同属于2S白蛋白家族,用阴离子交换层析法能够分离纯化获得高纯度的Ara h 2。阴离子交换层析法需要的设备简单,操作较为方便,耗时较短,是一种经济高效的分离蛋白纯化方法,用该方法分离纯化Ber e 1,有望获得较好的结果。
本研究将巴西坚果粉碎脱脂提取粗蛋白后,采用阴离子层析法纯化巴西坚果过敏原蛋白Ber e 1,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)联用和免疫印迹实验(Western blot)对其进行鉴定,通过圆二色谱和紫外分光光度计表征其二、三级结构。
1 材料与方法
1.1 材料与试剂
巴西坚果仁 微拉美(宁夏)进出口有限公司;巴西坚果过敏患者血清 重庆曼纽艾克科技有限公司;明胶美国Sigma公司;生物素化羊抗人IgE二抗 美国Bio-Rad公司;HRP酶标亲和素 深圳欣博盛生物科技有限公司;实验用其他试剂均为国产分析纯。
1.2 仪器与设备
FDV型超细粉碎机 中国台湾佑崎有限公司;5804 R高速冷冻离心机 德国Eppendorf公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;蛋白质分离纯化系统(包括HL-1恒流泵、HD-1核酸蛋白检测仪、HD-A电脑采集器、TH-500 A梯度混合器、SBS-100数控计滴自动部分收集器) 上海青浦沪西仪器厂;DEAE-Sepharose Fast Flow阴离子交换层析树脂 美国通用电气公司;Power PacBasic电泳仪、EPS 601蛋白转印仪、GS-800型光密度扫描仪美国Bio-Rad公司;Easy-nLC 1200色谱系统、Q Exacitve HF-X质谱仪、Varioskan Flash酶标仪 美国赛默飞世尔科技公司;MOS-450/AF-CD圆二色光谱仪法国Biologic公司;UV WinLab紫外分光光度计 美国Perkin Elmer公司。
1.3 方法
1.3.1 研磨脱脂
用超细粉碎机加液氮磨碎巴西坚果仁,并与石油醚溶液按1∶10(g/mL)混合。磁力搅拌脱脂4 h后,用真空抽滤装置进行固液分离,弃去液体,沉淀反复脱脂2 次。通风橱自然风干后得巴西坚果脱脂粉。
1.3.2 巴西坚果过敏原蛋白浸提
参考Pastorello等的方法并略加修改。将巴西坚果脱脂粉与0.01 mol/L磷酸盐缓冲液(pH 7.4)按1∶10(g/mL)混合,设置3 个平行样品。4 ℃磁力搅拌4 h后,6 000 r/min、4 ℃离心30 min,收集上清液。重复浸提沉淀2 次,-20 ℃冷藏备用。
1.3.3 Ber e 1蛋白分离纯化
采用阴离子交换层析树脂对过敏原蛋白Ber e 1进行分离纯化,先使用0.01 mol/L pH 6.8的磷酸盐缓冲液冲洗柱子至基线平,后加入巴西坚果蛋白,继续洗脱出现穿过峰至基线平后,用洗脱液(含0~0.5 mol/L氯化钠的平衡缓冲液)进行梯度洗脱,流速2 mL/min。使用紫外分光光度计在280 nm波长处检测蛋白质,收集各洗脱峰组分。
1.3.4 SDS-PAGE测定
1.3.4.1 粗提蛋白纯度测定
采用SDS-PAGE对蛋白进行纯度鉴定。将提取的蛋白稀释至2 mg/mL,与5×非还原上样缓冲液按体积比4∶1混合,100 ℃加热5 min。使用4%浓缩胶和12%分离胶,在恒流6 mA、30 min和恒流12 mA、90 min条件下进行浓缩和分离。电泳结束后,经考马斯亮蓝染色20 min,脱色12 h,对电泳凝胶进行图像采集,并利用Quantity one-4.6.2软件进行灰度扫描分析蛋白纯度。
1.3.4.2 纯化蛋白测定将纯化的蛋白
进行SDS-PAGE分析、考马斯亮蓝染色,切下目的蛋白条带,将胶条脱色后用胰蛋白酶进行胶内酶解,收集酶解液后进行LC-MS/MS分析。
1.3.5 LC-MS/MS鉴定
色谱条件:EASY-Column毛细管色谱柱(75 μm×150 mm,3 μm);流动相:A为0.1%甲酸水溶液(/),B为0.1%甲酸、80%乙腈、20%水混合溶液(/);色谱柱以100%的A液平衡;梯度洗脱程序:0~2 min,97%~95% A、3%~5% B;2~42 min,95%~75% A、5%~25% B;42~52 min,75%~55% A、25%~45% B;52~55 min,55%~10% A、45%~90% B;55~70 min,10% A、90% B;柱温50 ℃;进样量0.5 μg;流速300 nL/min。
质谱条件:电喷雾电离;分析时长70 min;正离子模式;离子源温度250 ℃;电压2.1 kV;母离子扫描范围:/300~1 800;二级质谱采集:每次全扫描后触发采集20 个最高强度母离子的二级质谱图谱。
使用质谱数据库检索软件MaxQuant 1.6.1.0进行数据库搜索及鉴定。
1.3.6 血清学鉴定
采用Western blot,参考闵芳芳和陈鹏等的方法并部分修改。纯化的Ber e 1蛋白经SDS-PAGE分离后,通过转膜仪在100 V、400 mA条件下电转50 min,使其转移至硝酸纤维素膜上。转膜结束后用质量分数为3%明胶的TBST室温封阻1 h;加入1∶50(/)稀释的巴西坚果过敏患者的血清,4 ℃过夜孵育;TBST洗膜后加入1∶5 000(/)稀释的生物素化羊抗人二抗,室温孵育1 h;TBST洗膜后加入1∶60(/)稀释的HRP酶标亲和素,室温孵育1 h;洗膜后加ECL显色液显色成像。所有孵育过程均在滚轴上进行。
1.3.7 二级结构的表征
参考Wu Zhihua等的方法,在氮气吹扫的条件下,用圆二光谱仪检测纯化的蛋白的二级结构。测定条件:扫描波长范围190~240 nm;平均扫描速率60 nm/min;光谱宽带1 nm。比色皿光径1 mm;蛋白样品质量浓度0.1 mg/mL。通过圆二色谱在线分析软件(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)对结果进行分析转换,得到样品的蛋白二级结构各成分单元的含量。
1.3.8 三级结构的初步表征
参照Zhang Ying等的方法,用紫外分光光度计检测纯化蛋白的三级结构。测定条件:扫描波长范围250~360 nm;比色皿光径1 cm;设置扫描速率100 nm/min;光谱宽带2.0 nm;响应时间0.2 s;波长间隔1.0 nm。蛋白样品质量浓度为0.1 mg/mL,体积为1 mL。
1.3.9 蛋白定量及得率计算
参照李娟等的方法并进行部分修改,采用考马斯亮蓝法测定蛋白质量浓度,以牛血清白蛋白作质量浓度工作曲线,通过不同波长光吸收确定蛋白样品质量浓度。Ber e 1得率计算如下:

式中:纯化Ber e 1蛋白质量由测得蛋白质量浓度及对应体积所得;上样总蛋白中Ber e 1质量以Ber e 1约占其总蛋白含量的30%为依据计算所得。
1.4 数据处理
运用SPSS 25.0软件对二级结构测定结果进行统计分析,采用Duncan法对数据进行多重比较,并进行单因素方差分析,使用Origin 2018软件绘图。
2 结果与分析
2.1 巴西坚果粗提蛋白SDS-PAGE分析
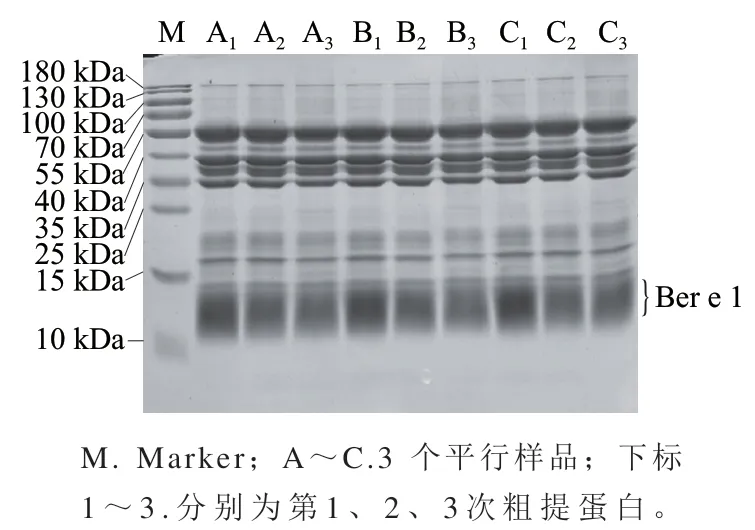
图1 巴西坚果粗提蛋白SDS-PAGE图Fig. 1 SDS-PAGE profile of crude protein extracted from Brazil nuts
结果表明3 个平行中,第1次提取的粗蛋白质量浓度为(43.4±1.7)mg/mL,第2次提取的粗蛋白质量浓度为(11.2±1.2)mg/mL,而第3次提取的粗蛋白质量浓度仅为(1.9±0.1)mg/mL。说明巴西坚果脱脂粉经两次浸提后,剩余可溶蛋白已经很少。由图1可知,3 个平行间及每个平行的3 次提取间,获得的蛋白没有明显的组分差别;但随着提取次数的增多,粗提蛋白质量浓度显著下降,目的蛋白Ber e 1的含量也有所降低。由于第3次提取液中蛋白质量浓度不到第1次提取液的5%,所以只取前两次提取液混合进行Ber e 1的分离纯化,灰度扫描显示,混合液中目的蛋白Ber e 1含量约占总蛋白的30%,与文献报道的巴西坚果中过敏原蛋白Ber e 1的含量一致。
2.2 离子交换层析分离纯化巴西坚果过敏原Ber e 1分析
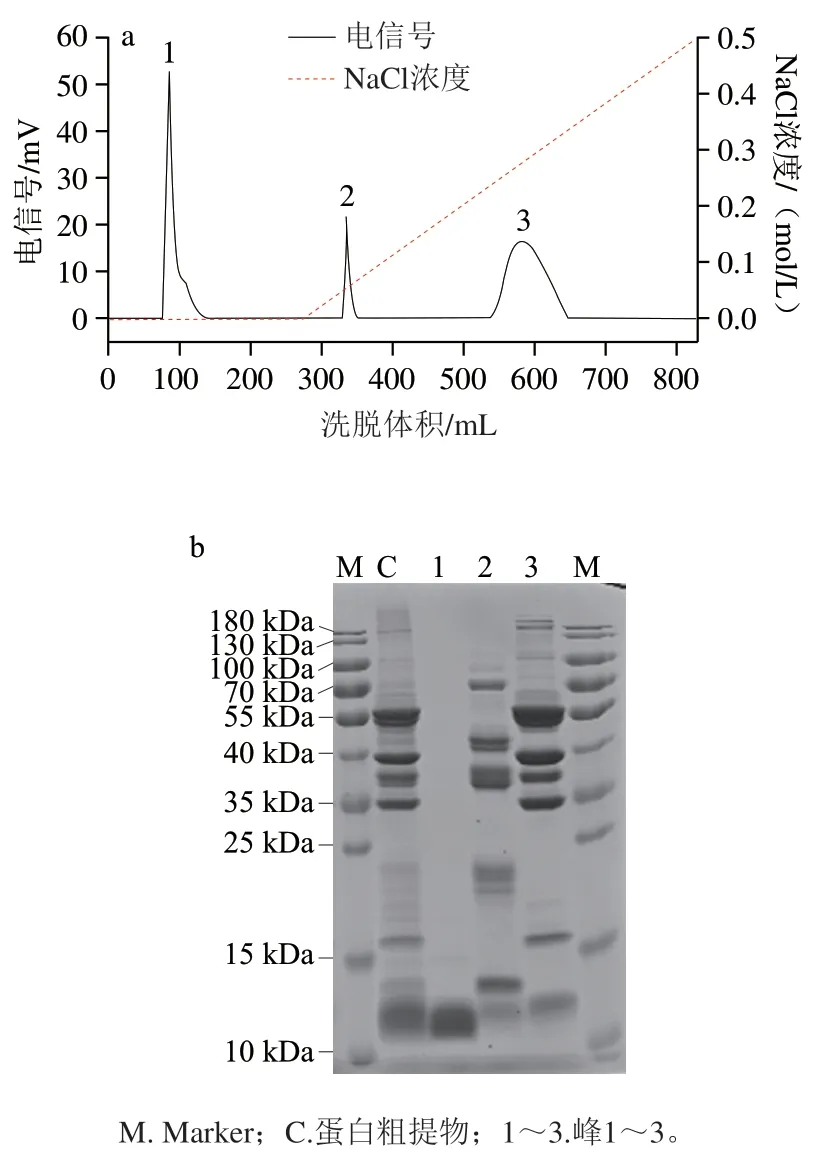
图2 纯化巴西坚果过敏原Ber e 1的阴离子交换层析曲线(a)及SDS-PAGE(b)图Fig. 2 Anion-exchange chromatographic curve (a) and SDS-PAGE profile (b) of Brazil nut allergen Ber e 1
如图2所示,峰1(即穿过峰)中含大量高纯度的过敏原蛋白Ber e 1,Ber e 1的等电点为pH 6.3,在所选平衡缓冲液的pH值下带负电荷,可以被阴离子交换树脂吸附,但可能由于目的蛋白Ber e 1和阴离子交换树脂的结合能力较弱,可直接被不含NaCl的磷酸盐缓冲液洗脱下来,也有部分蛋白结合在柱上,在梯度洗脱过程中被高盐溶液洗脱下来。峰1处收集到的蛋白经SDS-PAGE及灰度扫描,显示Ber e 1纯度大于95%。
2.3 巴西坚果过敏原Ber e 1的LC-MS/MS鉴定分析
由表1可知,共检测到4 条Ber e 1的特征肽段,除信号肽外检测出的肽段覆盖率为36.5%,质谱结果认定该蛋白为巴西坚果过敏原Ber e 1。

表1 巴西坚果过敏原Ber e 1检测肽段Table 1 Identification of peptides in Brazil nut allergen Ber e 1 by LC-MS/MS
2.4 巴西坚果过敏原Ber e 1的血清识别分析
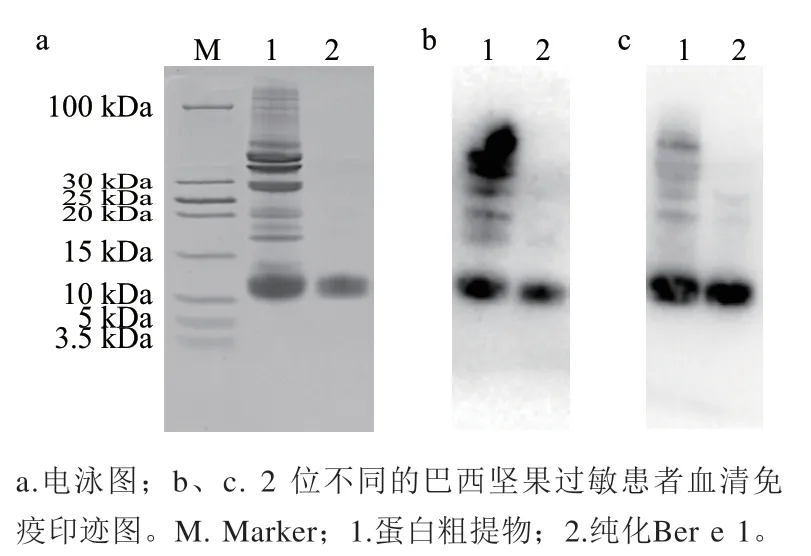
图3 巴西坚果蛋白粗提物及纯化过敏原Ber e 1的Western blot分析Fig. 3 Western blot analysis of crude protein extracted from Brazil nuts and purified allergen Ber e 1
如图3所示,粗蛋白泳道和纯化的目标蛋白泳道均有显色,且Ber e 1对2 位过敏患者的血清都有较强的反应,进一步说明本实验分离得到了巴西坚果过敏原,且蛋白Ber e 1免疫活性保持良好。此外,在粗蛋白泳道的29 kDa处(即Ber e 2)和30~100 kDa之间的蛋白条带也有显色,其中第1位坚果过敏患者的血清(图3b)对30~100 kDa之间的多个蛋白条带识别更强,显色更深。这说明除已知两种过敏原蛋白Ber e 1、Ber e 2外,巴西坚果中可能还存在其他种类的未知过敏原蛋白。
2.5 巴西坚果过敏原Ber e 1二级结构的表征
圆二色光谱在远紫外区具有肽键吸收信号,并能反应蛋白质特征二级结构的含量。从图4可以看出,过敏原蛋白Ber e 1在193 nm波长处有最大吸收峰,在208 nm(-螺旋肽键的π-π*跃迁)和222 nm(-螺旋肽键的n-π*跃迁)波长处有2 个负的特征肩峰谱带,表明Ber e 1中明显存在-螺旋结构。通过圆二色谱在线软件分析,结果显示巴西坚果过敏原蛋白Ber e 1中-螺旋含量占30.6%,在文献报道的-螺旋占比范围内,-折叠含量占19.0%,-转角含量占22.9%,无规卷曲含量占27.6%。
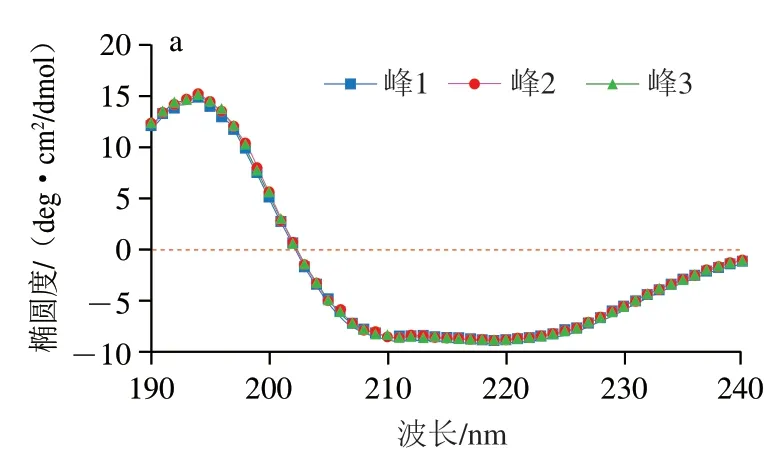
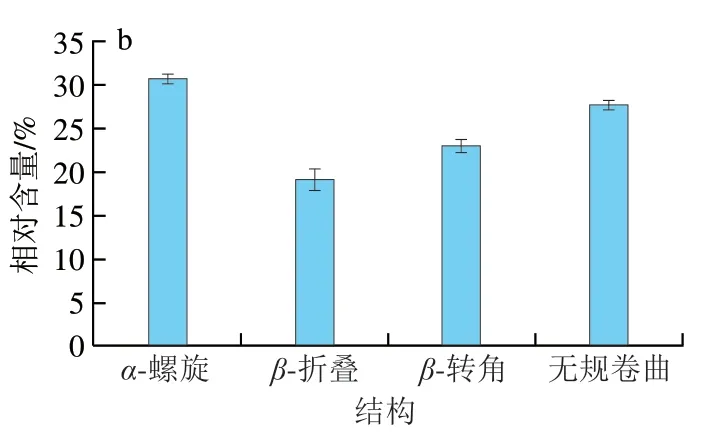
图4 巴西坚果过敏原蛋白Ber e 1的圆二色光谱(a)和二级结构单元组分图(b)Fig. 4 CD spectrum (a) and secondary structure composition of Brazil nut allergen Ber e 1 (b)
2.6 巴西坚果过敏原Ber e 1三级结构的初步表征
蛋白质在近紫外处的吸收主要与酪氨酸、色氨酸以及苯丙氨酸和二硫键有关。由图5可知,在250~280 nm波长附近有较大吸收。由于芳香氨酸残基的侧链的谱峰常因微区特征的不同而改变,芳香族氨基酸残基的侧链之间及其与二硫键的谱峰均可能会产生重叠。已有研究表明Ber e 1的两个亚基是通过4 个二硫键连接起来的,这可能对250~280 nm波长之间的吸收峰有影响,所以在275 nm及282 nm波长处没有明显的酪氨酸特征吸收峰,这在一定程度上说明了所纯化的过敏原蛋白Ber e 1的二硫键未被破坏,其高级结构未展开。此外,因Ber e 1的蛋白序列中不含色氨酸,所以在290~310 nm之间没有色氨酸的特征峰。当前鲜见表征过敏原蛋白Ber e 1三级结构的报道,因此本研究为过敏原蛋白Ber e 1的后续研究奠定了一定的基础。
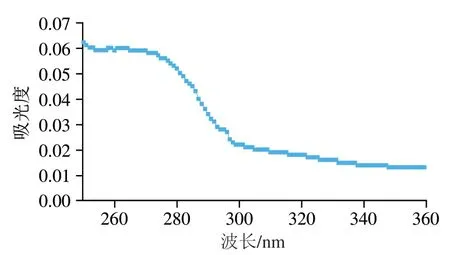
图5 巴西坚果过敏原蛋白Ber e 1的紫外光谱图Fig. 5 UV spectrum of Brazil nut allergen Ber e 1
2.7 巴西坚果过敏原Ber e 1的得率分析
如表2所示,在一次典型的纯化过程中,上样体积为6 mL,总蛋白质量浓度为26.0 mg/mL,获得纯化的Ber e 1约22.4 mg,计算可知,Ber e 1得率为47.8%,则1 g巴西坚果脱脂粉可以得到约74.6 mg目的蛋白Ber e 1。
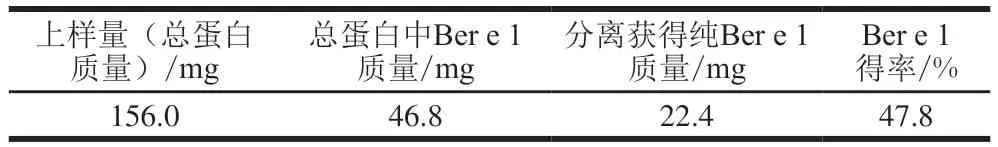
表2 阴离子交换层析法分离得到的巴西坚果过敏原Ber e 1的得率Table 2 Recovery of Ber e 1 during anion-exchange chromatographic purification
3 结 论
以巴西坚果仁为原料,通过粉碎、脱脂、浸提获得粗蛋白,采用阴离子交换层析法分离纯化Ber e 1蛋白,通过LC-MS/MS对纯化的蛋白进行鉴定。一步分离纯化即可得到纯度95%以上的巴西坚果过敏原蛋白Ber e 1,纯化过程中,蛋白得率为47.8%,一次纯化量可超过20 mg。经Western blot、圆二光谱仪及紫外分光光度计测定分析表明,纯化的蛋白保持自身高级结构,能够被巴西坚果过敏患者的血清准确识别。当前我国对巴西坚果过敏原的研究较少,本研究纯化Ber e 1的技术路线简单,对设备要求低,耗时短且制备量大,可以为巴西坚果过敏原Ber e 1相关研究和应用奠定一定基础。
