T细胞在系统性硬化症的作用
2022-10-09丁汀汀于震梁钰颖温鸿雁
丁汀汀,于震,梁钰颖,温鸿雁
基于表面分子表达不同,T细胞可分为CD4T细胞和CD8T细胞,基于细胞功能的不同,T细胞细分为自然杀伤T(natural killer T cells,NKT)细胞、CD8细胞毒性T(cytotoxic T lymphocyte,CTL)细胞、调节性T(regulatory T cell,Treg)细胞、和T辅助(helper T cell,Th)细胞等。原始CD4T细胞经过抗原刺激后至少可分化为五类被明确定义的T细胞亚群,包括Th1、Th2、滤泡辅助T细胞(follicular helper T cell,Tfh)、Th17和Treg细胞,近期一些研究报告了新的CD4T细胞亚群,包括Th9和Th22细胞,以及他们在SSc患者的外周血、血清和皮肤病变中各自的细胞因子。有研究表明CD8T细胞系统性硬化症(systemic sclerosis,SSc)的发生、发展中也起到重要作用,其中CD8CD28T、CD8Treg细胞均介导异常免疫反应。SSc传统治疗药物以糖皮质激素、免疫抑制剂及血管活性药物为主,其长期使用产生的不良反应使人们期望有更精准的治疗药物。本文回顾近期有关T细胞亚群失调及其细胞因子产生的效应功能异常对SSc发病机制的影响的相关文献,以寻求SSc的潜在治疗靶点。
1 系统性硬化症与CD4+T细胞
1.1 系统性硬化症与Th1/Th2细胞
炎症是导致纤维化的主要步骤之一,但促炎细胞因子不一定促纤维化。Th1细胞以分泌干扰素(IFN)-γ为特征,参与宿主对细胞内病原体的防御。白细胞介素(IL)- 12诱导幼稚CD4T细胞分化为Th1细胞以产生IFN-γ。IFN-γ抑制成纤维细胞诱导的胶原合成并减轻纤维化,因此,Th1细胞具有抗纤维化作用。Th2细胞主要产生标志性细胞因子IL- 4、IL- 5和IL- 13等,其与嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、2型先天淋巴细胞(ILC2)共同参与2型免疫诱导的纤维化病理过程。正常情况下Th1细胞与Th2细胞之间存在着平衡,这种平衡的破坏与多种疾病的发生发展有关。Shah等研究表明早期重度SSc患者外周血CD4T细胞表型更偏向于Th2,且淋巴细胞亚群的差异由疾病本身引起,与免疫抑制剂(DMARDs)的使用无关。SSc为Th2细胞介导的疾病,Th1细胞及其分泌的细胞因子在其发病机制中发挥抗纤维化功能,同时,Th2细胞及其分泌的细胞因子可以改变与Th1相关的IFN-γ表达水平。此外,IL- 13是纤维化的必需细胞因子,其参与炎症阶段,介导 T 细胞和成纤维细胞之间的相互作用,有助于SSc从炎症阶段过渡到纤维化阶段,并促进受累器官持续纤维化。然而IL- 13不是单纯的Th2细胞因子,它也可以由Th1、Th17等细胞产生,并作用于多种细胞。IL- 13通过与IL- 13Rα2受体结合诱导转化生长因子-β1的产生,进而影响Th1/Th2细胞之间的平衡,因此是治疗SSc的潜在靶点之一。IL- 31是IL- 6族细胞因子,有研究发现SSc患者血清IL- 31水平与皮肤和肺纤维化的严重程度以及血清IL- 4、IL- 6和IL- 13水平呈正相关,这表明IL- 31与SSc中的纤维化和Th2免疫反应有关,因此IL- 31也可能是SSc的潜在治疗靶点。
1.2 系统性硬化症与Th17细胞
Th17细胞主要分泌IL- 17族细胞因子,IL- 17A 是其标志性细胞因子,RORγt是其特异性的转录因子。有研究发现SSc患者和SSc小鼠模型的外周血Th17细胞数量及血清中IL- 17水平显著增加,同时SSc患者T细胞与自体皮肤成纤维细胞共培养物中IL- 17A水平增加,表明Th17细胞和IL- 17在SSc发病过程中发挥一定的作用。IL- 17是公认的促炎因子,Th17细胞和IL- 17通过诱导细胞因子(如IL- 6、IL- 8)、趋化因子(如CCL2)、基质金属蛋白酶的产生和基质细胞粘附分子的表达来参与和放大炎症反应。但最新研究显示IL- 17A在系统性硬化症患者T细胞与自体皮肤成纤维细胞共培养物中可能发挥抗纤维化和促凋亡作用。IL- 17A一方面具有明显的促炎活性,另一方面可能具有抗纤维化的能力,在SSc发展过程中的作用是复杂的,所以中和IL- 17对治疗SSc是否有益仍无定论。
SSc患者外周血Th17细胞比例上升在多项研究中得到了证实,但在其中哪个亚群上升比例更为明显的报道较少,Gabsi等对50例SSc患者的血清游离CD146及CD146Th17细胞进行研究,首次提出SSc患者Th17细胞上升部分中CD146Th17细胞所占比例更高。SSc患者中血清游离CD146和IL- 17A的水平较正常对照组升高,且两者之间呈正相关,表明血清游离CD146影响IL- 17A介导的炎症和纤维化的平衡,同时SSc患者CD146Th17细胞数量增加与肺纤维化呈负相关,因此CD146Th17细胞可能是SSc适应性免疫应答的新组成部分,并可能成为潜在的治疗靶点。
1.3 系统性硬化症与Treg细胞
Treg细胞特征性表面标志物为CD25分子(IL- 2受体的α链),其他主要标志物有表面抗体CD3、CD127(IL- 7受体α链)、CD45RA及核内抗体Foxp3等。目前CD4Treg细胞多以CD4CD25、CD4CD25Foxp3、CD4CD25CD127标记。近期研究在系统性硬化症患者外周血Treg细胞变化情况上仍存在分歧(表1)。部分研究对于分歧产生的可能原因进行了阐述,认为实验结果的不同可能与疾病的分期、分型、活动情况、治疗药物的影响、Treg细胞标记方式及纳入研究的标本量有关。Krasimirova等的研究将SSc患者分别按活动情况、分型、分期进行分组,发现疾病的分期和活动情况对CD4CD25Foxp3细胞的比例没有影响,但CD4CD25细胞比例较正常对照组下降,且在弥漫性系统性硬化症(dcSSc)组下降更为明显,dcSSc患者均接受了甲泼尼龙治疗,尚不能明确引起这种差异的原因是疾病分型还是药物影响。Ugor等认为Treg细胞的比例差异可能与免疫抑制治疗无关,与Treg的不同标记方式有关,研究发现接受免疫抑制治疗的SSc患者和未接受免疫抑制治疗的患者Treg细胞比例没有显著差异,但使用不同标记方式时Treg细胞的比例在各组间出现差异,使用Foxp3、CD127联合标记CD4CD25Treg细胞时,Treg细胞比例上升,但单独使用Foxp3或CD127标记时,与对照组相比有上升趋势但无统计学意义。
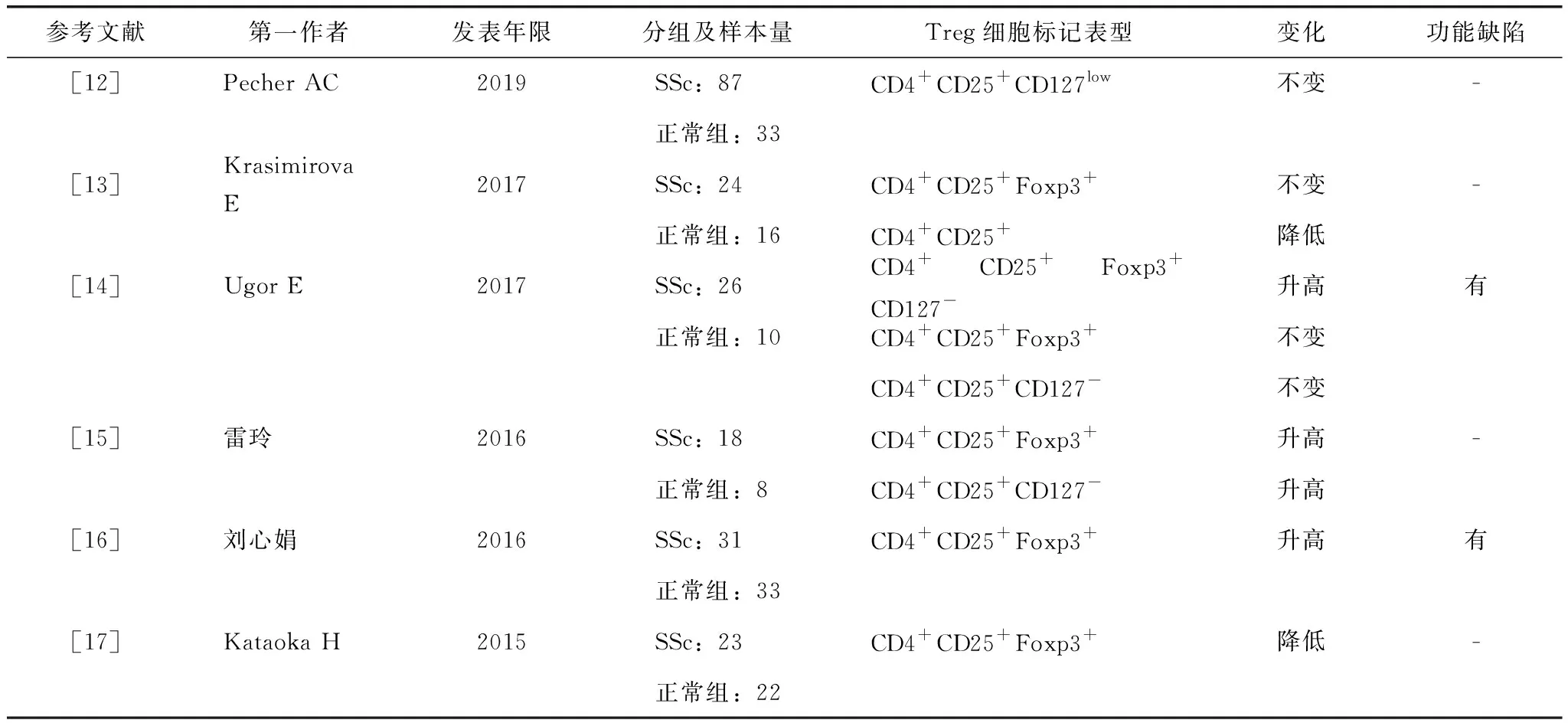
表1 SSc患者外周血Treg细胞变化
在Treg细胞增殖抑制试验中,部分研究显示SSc患者效应T细胞增殖水平高于健康对照组,即SSc患者Treg细胞对外周血效应T细胞增殖的抑制能力减弱。Treg细胞抑制功能受损可能与Treg细胞的发育关键转录因子Foxp3的低表达有关。Foxp3的转录可以受到某些细胞因子如IL- 2的正调控,同时也受到促炎细胞因子如肿瘤坏死因子(TNF)、IL- 6的负调控。通过调节这些细胞因子,可以达到调控Foxp3表达的目的,从而影响Treg细胞的功能。
1.4 系统性硬化症与Th17/Treg细胞比例失衡
Th17细胞与Treg细胞,两者表面的趋化受体基本相同,并且在许多组织中同时存在,正常情况下,两者之间存在着平衡。目前在很多自身免疫性疾病中都发现了Th17与Treg细胞比例的失衡,如在SLE、RA中Th17细胞水平升高,Treg细胞水平降低,Th17/Treg比值明显高于正常。系统性硬化症患者外周血Th17水平升高已在多项研究中得到证实,但与Treg细胞比例变化仍有争议,有报道指出SSc患者也存在外周血Th17与Treg比值的失衡。转化生长因子-β(TGF-β)可以上调胶原和细胞外基质的合成,被认为是系统性硬化症及其他纤维化疾病中纤维化过程的主要参与者。TGF-β既可以激活Th17细胞介导炎症和自身免疫反应,引起纤维化,又可以激活Treg细胞,抑制免疫反应,维持自身免疫耐受功能,正常情况下,TGF-β对这两类细胞分化的促进作用处于动态平衡状态。在IL- 2的存在下,Foxp3表达增加,同时通过激活STAT5抑制RORγt的表达,使得幼稚T细胞向Treg细胞分化;IL- 6则可以消除对RORγt转录的抑制作用,诱导幼稚T细胞中RORγt的表达,使其向Th17细胞分化。因此IL- 6、IL- 2等细胞因子的失衡可能造成患者T细胞亚群失衡。有报道称系统性硬化症患者血清IL- 6水平升高,并与肺纤维化和皮肤纤维化呈正相关,因此部分研究尝试将IL- 6受体拮抗剂用于SSc患者的治疗。
1.5 系统性硬化症与Tfh细胞
Tfh以表达特异性转录因子 Bcl6 和分泌IL- 21 为特征,能够通过表达高水平的趋化因子受体 CXCR5 作用于B 细胞。Tfh的分化和激活依赖于多种因素的作用,并受多种信号通路的调节。其中,信号转导和转录激活因子(STAT)3/janus激酶(JAK)2 信号通路在SSc中过度激活。STAT3 参与SSc患者和博来霉素诱导的小鼠模型中的皮肤纤维化以及Tfh细胞分化。有研究表明外周血Tfh细胞在SSc中失调并且有增加的趋势,尤其是在dcSSc和疾病的早期阶段。其产生高水平的IL- 21并表达可引起异常B细胞活化和分化的共刺激信号,从而导致免疫功能异常。尽管有研究表明Tfh细胞与SSc的发病机制有关,但Tfh细胞与SSc中其他相关细胞亚群及细胞因子之间的相互作用仍未明确。研究Tfh细胞异常增加与自身反应性 B 细胞扩增、成纤维细胞活化和促纤维化介质产生之间的联系可以更好地了解SSc的发病机制。
1.6 系统性硬化症与Th9细胞
Yanaba等首次报道了SSc患者血清IL- 9水平升高,提出Th9和IL- 9可能与SSc的发病机制有关。Guggino等的最新研究报道了在局限性系统性硬化症(lcSSc)和dcSSc患者的受累皮肤中IL- 9、IL- 9R及促进Th9分化的因子如IL- 4、TGF-β和胸腺基质淋巴细胞生成素(TSLP)的高表达,同时SSc患者外周血Th9细胞上升,并与皮肤纤维化程度正相关,在肾脏受累的SSc患者的肾活检中也检测到IL- 9的过度表达。这些发现表明,Th9细胞和IL- 9与SSc的发病有关。但IL- 9 和 Th9 参与SSc炎症和纤维化的过程仍不清楚,可能与肥大细胞-ILC2-Th9 通路的激活有关,但仍需要进一步研究来阐明。
1.7 系统性硬化症与Th22细胞
Th22细胞(CD4IL- 22IL- 17IFNIL- 4T细胞)是以分泌IL- 22为特征的Th细胞的新子集。与Th1细胞相比,Th22在SSc患者的组织中过度表达,并与疾病活动性相关,因此推测IL- 22具有直接的促纤维化作用。此外,Truchetet等发现Th22细胞升高与SSc相关间质性肺病之间成正相关。Brembilla等也报道了IL- 22T细胞在SSc表皮中表达升高,并且IL- 22 促进成纤维细胞对TNF 的反应,并通过促进TNF诱导角质形成细胞活化从而促进成纤维细胞形成。因此,Th22与IL- 22在SSc组织纤维化的病理生理中起着重要作用,可能成为SSc治疗的靶点。
2 系统性硬化症与CD8+T细胞
2.1 系统性硬化症与CD8+CD28-T细胞
有研究发现早期活动性dcSSc患者的病变皮肤中可分离出CD8T 细胞,并表达极高水平的IL- 13和IFN-γ。最近的一些研究进一步发现产生 IL- 13的CD8T细胞在体外表现出强烈的细胞毒活性,在SSc患者真皮成纤维细胞中诱导促纤维化表型,且与晚期SSc患者相比,早期dcSSc患者的皮肤病变中CD8T细胞占比更高。也有相关动物实验表明活化的CD8T细胞可以分泌 IL- 13,促进博莱霉素诱导的肺纤维化。
Fox等对一组早期的活动性dcSSc患者外周血CD8T细胞进行分析,发现CD8T细胞百分比降低,这组患者均没有显著的器官受累,也均未接受过DMARDs或生物制剂治疗,并且使用糖皮质激素的比例极低。但SSc患者的外周血和皮肤中的CD8CD28T细胞的百分比均增加,与年龄无关。通常CD8T细胞会随着年龄的增长或慢性炎症的影响而丧失CD28表达,CD8CD28T细胞是抗原特异性、单克隆扩增、终末分化的衰老T细胞。研究还发现SSc患者外周血 CD8CD28T细胞与皮肤mRSS评分正相关,与疾病持续时间之间没有显著关联,且较CD8CD28T细胞相比CD8CD28T细胞亚群产生更多IL- 13。此外,SSc患者的CD8CD28T细胞在真皮中显著积累。表明CD8T细胞中CD8CD28T细胞亚群更可能参与SSc的发病。
2.2 系统性硬化症与CD8+Treg细胞
根据Treg细胞的不同表面标记进行亚组分型,Treg细胞分为CD4及CD8两大类,在SSc方面CD4Treg细胞研究较多,但近年也有CD8Treg细胞(CD8CD28CD127CD39T)的相关报道,CD8Treg细胞与CD4Treg细胞一样能够抑制过度的免疫反应并维持人体免疫稳态。在抑制试验中,SSc患者体内CD8Treg细胞抑制活性降低,可能与CD8Treg细胞的成熟过程受阻有关,同时与健康对照组相比,SSc患者CD8Treg细胞中CD39表达降低、CD127表达增加,这些改变与CD8Treg细胞的功能缺陷有一定相关性。总之,SSc患者外周血CD8Treg细胞抑制功能受损可能参与SSc的发病,CD39、CD127表达水平的改变可能是SSc患者外周血CD8Treg细胞抑制功能受损的原因之一。
综上所述,T细胞与系统性硬化症的发病关系密切,研究系统性硬化症与T细胞的关系是为了研究出更加高效、毒副作用小的治疗药物。随着对系统性硬化症的发病机制的研究,越来越多的靶向药物将从实验走向临床,用于治疗系统性硬化症的临床药物将有更大选择空间,如多项研究表明外周血Th17/Treg平衡与系统性硬化症发病相关,且外周血异常升高的IL- 6参与Th17/Treg平衡,2010年Yoshihito Shima等开始将托珠单抗(重组人IL- 6受体单克隆抗体)用于SSc患者的治疗,2020年Dinesh Khanna等完成了托珠单抗治疗系统性硬化症的III期临床试验,发现托珠单抗有助于SSc患者减少DMARDs用量,且在延缓肺间质纤维化进展方面有效。本文提到的潜在治疗靶点有IL- 17、IL- 2、IL- 13、CD146Th17细胞、Th9细胞、Th22细胞等,为后续新兴药物的研发提供了思路。
