松材线虫VAP家族成员结构分析
2022-10-08潘佳亮王巧申李长强李理栎姚洪锡
潘佳亮, 王巧申, 李长强, 李理栎, 姚洪锡, 阎 合
(1.国家林业和草原局生物灾害防控中心/林业有害生物监测预警国家林业和草原局重点实验室,辽宁 沈阳 110034;2.东北林业大学林学院,黑龙江 哈尔滨 150040;3.荣成市国有成山林场,山东 荣成 264300)
松材线虫病(pine wilt disease, PWD)是由病原松材线虫(Bursaphelenchusxylophilus)引起的重大森林病害[1-3].该病害自1982年首次在我国南京市中山陵风景区发现以来,迅速传播蔓延,目前已扩散至我国19个省(自治区、直辖市)731个县级行政区,侵染111.46万hm2松林,仅2020年就造成近2 000万株松树死亡,造成的经济损失数以亿计[4-5].目前,防治松材线虫病的方法主要包括严格实行检疫、清理病死树、化学药剂毒杀媒介昆虫松墨天牛(Monochamusalternatus)和病原松材线虫、培育抗病树种等[2].但有关松材线虫的致病机制尚不明确.
类毒液过敏原蛋白(venom allergen-like protein, VAP)是一类在动物和植物线虫体内广泛存在的分泌蛋白家族.研究表明,植物寄生线虫食道腺细胞分泌物在线虫侵染寄主植物组织早期起到了十分重要的作用,编码此类分泌蛋白的基因被认为是线虫的致病基因[6-7].VAP基因参与线虫与寄主植物的互作过程,目前学者们已完成了大豆包囊线虫(Heteroderaglycines)[8]、马铃薯腐烂茎线虫(Ditylenchusdestructor)[9-10]、南方根结线虫(Meloidogyneincognita)[11-12]、花生荚线虫(D.africanus)[13]、松材线虫[14-15]等植物寄生线虫体内部分相关基因的鉴定.Kang et al[16]研究发现,松材线虫分泌的VAP基因与其迁移行为显著相关,这表明VAP基因可能参与调控松材线虫在寄主松树内的早期寄生行为. Wilbers et al[17]研究发现,动物和植物寄生线虫和自由生活线虫VAP基因无明显区别,且均具有约15 ku富含半胱氨酸的CAP(代谢产物活化蛋白,catabolite activator protein)结构域,可能是VAP的稳定分子支架.冯宇倩等[18]对4个Bx-VAPs功能和结构进行初步分析,发现Bx-VAPs均具有SCP(精子包被蛋白,sperm-coating protein)结构域,属于SCP/TAPS蛋白(精子包被蛋白的Tpx-1/Ag-5/Pr-1/Sc-7, sperm-coating protein/Tpx-1/antigen-5/pathogenesis related-1/Sc-7).
本研究基于隐杆线虫属线虫VAP基因的相关报道,筛选鉴定出了14个松材线虫VAP家族成员(Bx-VAPs)蛋白同源序列,并对其生物信息学特性进行分析预测,旨在为进一步研究松材线虫其余基因的功能和VAP在松材线虫寄生过程中的作用提供理论依据.
1 材料与方法
1.1 Bx-VAPs基因筛选鉴定及理化特性测定
在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中下载了隐杆线虫属线虫(Caenorhabditisbriggsae、C.elegans、C.remanei)的全部VAP基因,以隐杆线虫属VAP家族氨基酸序列作为检索对象,通过Wormbase数据库(https://wormbase.org)[19]与松材线虫的基因组数据[20]进行BLAST比对,筛选出松材线虫VAP同源序列.
利用ProtParam工具(https://web.expasy.org/protparam/)[21]对Bx-VAPs的氨基酸数、相对分子质量、理论等电点、脂肪指数、分子结构式、原子总数、不稳定系数等理化性质进行分析,然后通过CDD工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)[22]对Bx-VAPs 保守结构域进行预测.应用Mega 7软件中的邻位连接(neighbor-joining, NJ)法构建Bx-VAPs的系统发育进化树,然后再使用bootstrap法验证树的可靠性并给出一棵自展一致树(bootstrap consensus tree),自展重复抽样检验达1 000次[23].
1.2 蛋白质序列基序分析
Bx-VAPs蛋白基序可以先通过MEME工具(https://meme-suite.org/meme/)[24]进行分析预测,再通过Pfam数据库(http://pfam.xfam.org/)[25]和InterPro数据库(http://www.ebi.ac.uk/interpro/)[26]进行注释.
1.3 疏水性和跨膜螺旋区域分析
应用ProtScale工具(https://web.expasy.org/protscale/)[27]预测Bx-VAPs疏水性;应用TMHMM (http://www.cbs.dtu.dk/services/TMHMM)和PSORTb(http://www.psort.org/psortb/)对Bx-VAPs跨膜螺旋区进行分析[28];通过Protter网站(http://wlab.ethz.ch/protter/start/)预测Bx-VAPs的拓扑异构模型[29].
1.4 磷酸化位点分析
应用NetPhos 3.1 Serve(http://www.cbs.dtu.dk/services/NetPhos/)[30]对Bx-VAPs的丝氨酸、苏氨酸、酪氨酸的磷酸化位点数量进行分析.
1.5 二级结构预测及三级结构建模
应用SOPMA工具(https://npsaprabi.ibcp.fr/cgi-bin/secpred_sopma.pl)[31]预测Bx-VAPs的二级结构;通过SWISS-MODEL(https://swissmodel.expasy.org/)[32]对Bx-VAPs三级结构进行建模.
2 结果与分析
2.1 Bx-VAPs基因的鉴定及理化性质
基于Wormbase数据库比对筛选的结果见表1,在松材线虫全基因组中找到与其他线虫VAP同源的基因共14个,将其依次命名为BXY-VAP1~BXY-VAP14.
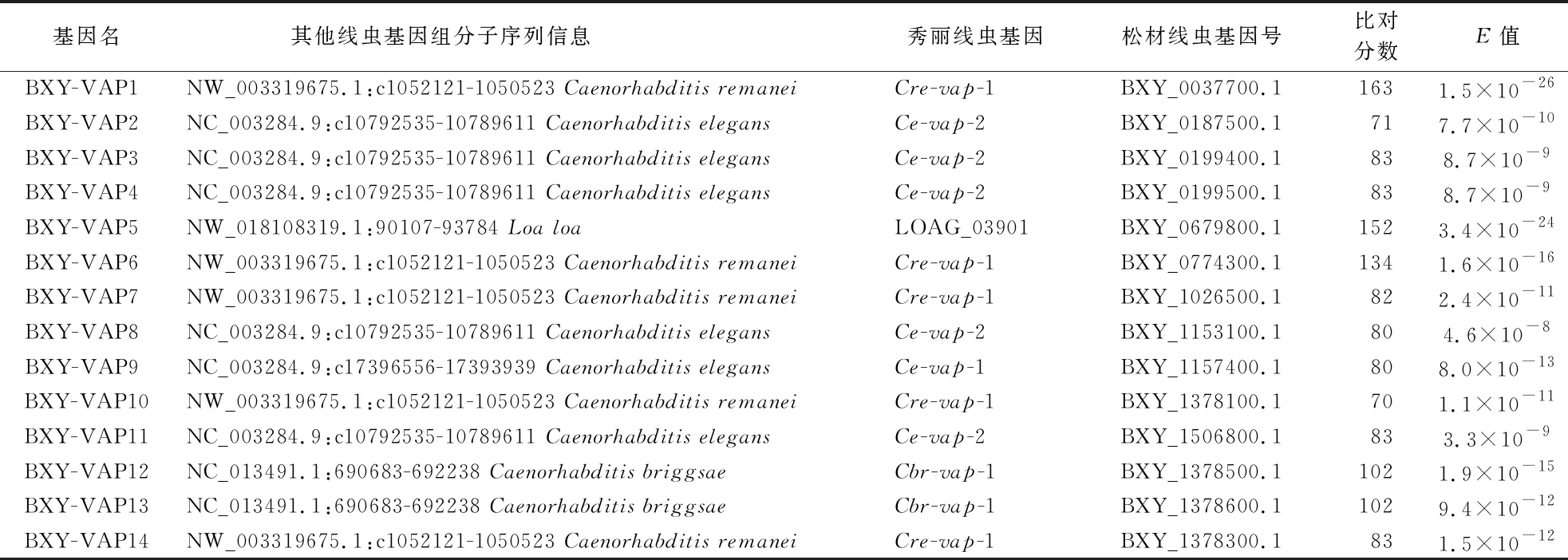
表1 Bx-VAPs与其他线虫VAP对照表
由表2可见,不同Bx-VAPs氨基酸数量差异显著,区间为175~295个,平均氨基酸数量为221.79个.Bx-VAPs相对分子质量为19 449.19~30 731.72,平均为24 493.77.这14个基因的蛋白质理论等电点为4.29~9.40,脂肪系数为56.07~82.40,表明Bx-VAPs的热稳定性存在显著差异.蛋白质亲水系数均为负值,分布在-0.682~-0.070之间,说明14个Bx-VAPs基因均为疏水蛋白.这14个蛋白质均由C、H、N、O和S 5种原子组成,原子总数分布在2 693~4 216个之间.蛋白不稳定系数为19.62~54.71,其中11种Bx-VAPs的不稳定系数均小于40,表明蛋白质结构稳定,而BXY-VAP3、BXY-VAP8和BXY-VAP9的结构稳定性差.
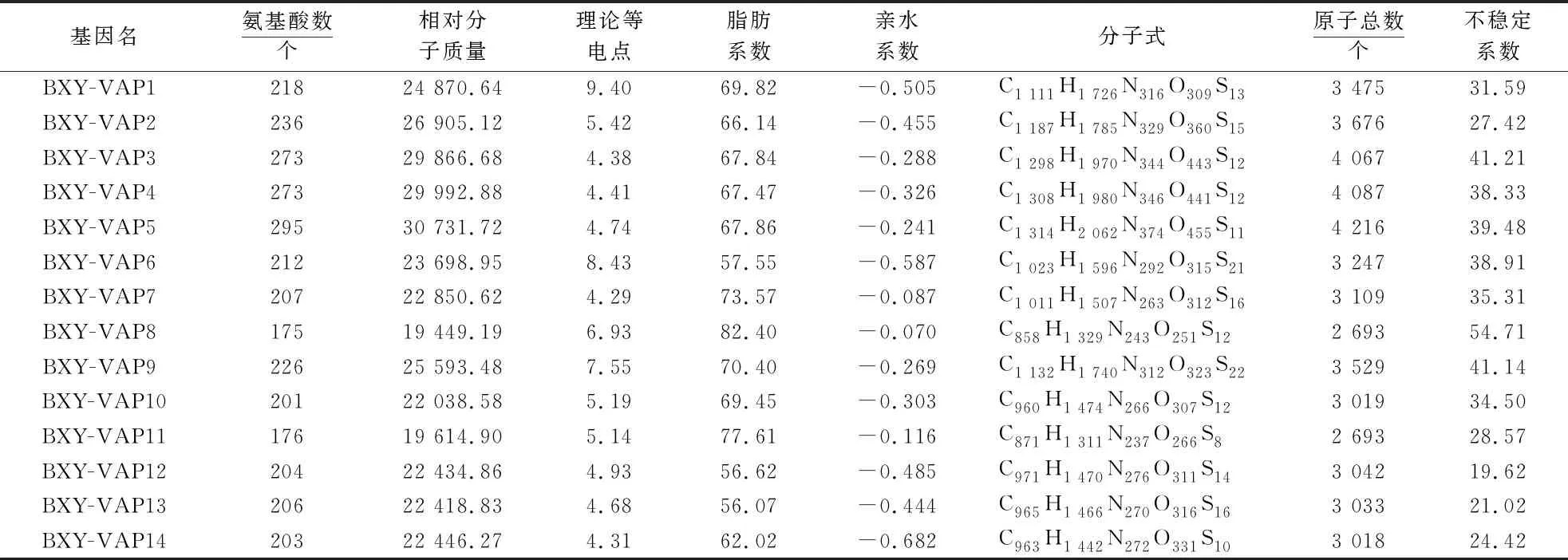
表2 Bx-VAPs理化性质
2.2 系统发育进化树及蛋白质基序
由图1可见,松材线虫VAP1、VAP2、VAP3、VAP13聚为一支,VAP10、VAP11和眼线虫(Loaloa)VAP聚为一支,VAP6、VAP7、VAP8、VAP14聚为一支,VAP4和VAP9聚为一支,VAP5和VAP12聚为一支,同一支上的蛋白可能表现相似的功能.
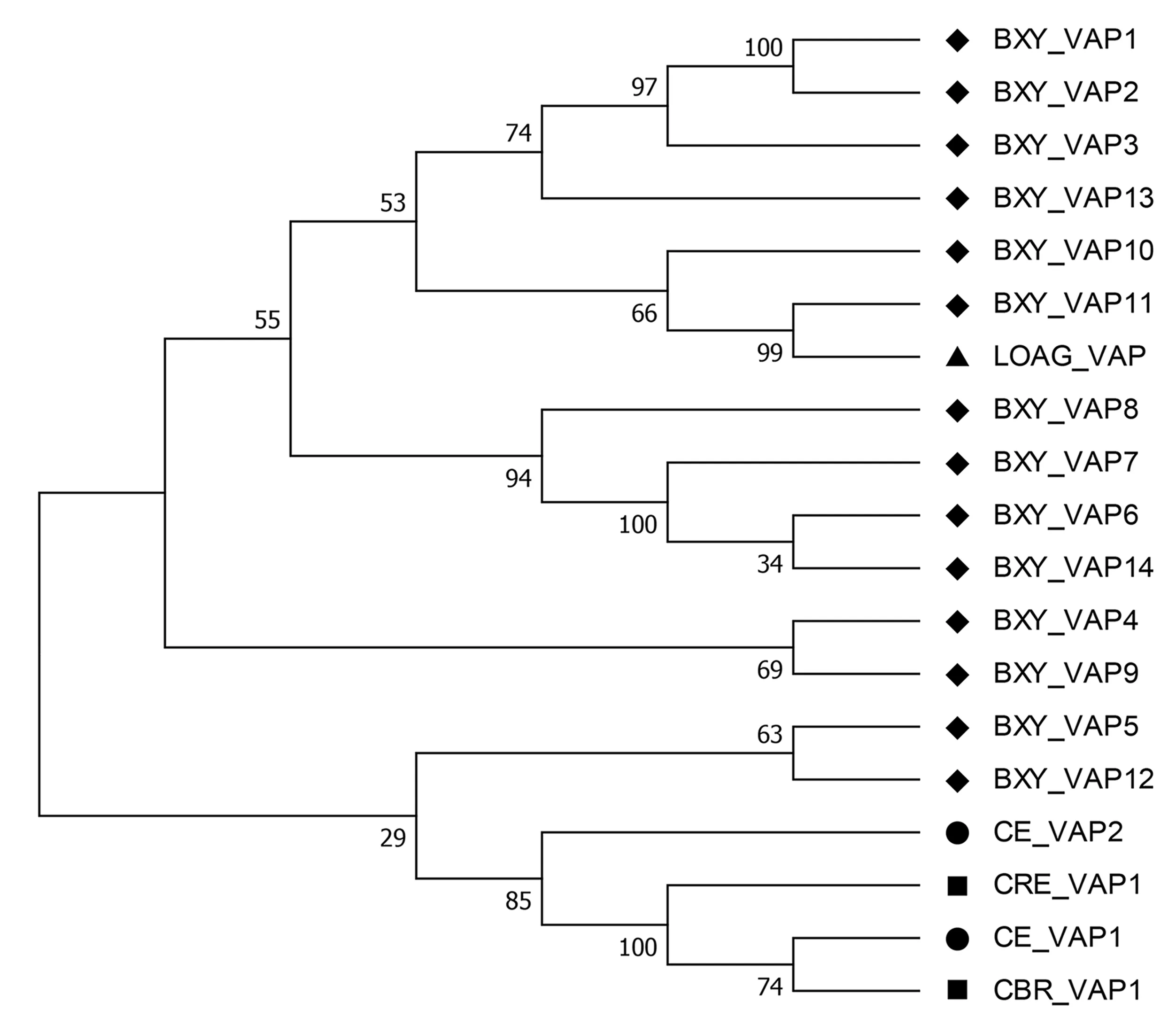
BXY、LOAG、CE、CRE、CBR分别表示松材线虫(Bursaphelenchus xylophilus)、眼线虫(Loa loa)、秀丽线虫(Caenorhabditis elegans)、C.remanei、C.briggsae.
14个Bx-VAPs基因家族都含有保守基序2和基序4,表明这两个基序在松材线虫VAP家族中保守;进化关系相近的Bx-VAPs含有相同或相似的蛋白质基序,如基序6和基序7都仅存在于BXY-VAP6、BXY-VAP7、BXY-VAP14中(图2).对获得的10个保守的蛋白质基序在Pfam和InterPro上进行注释,发现所有序列均为CAP家族成员,基序1和基序2为CAP结构域,其他基序未获得注释结果.
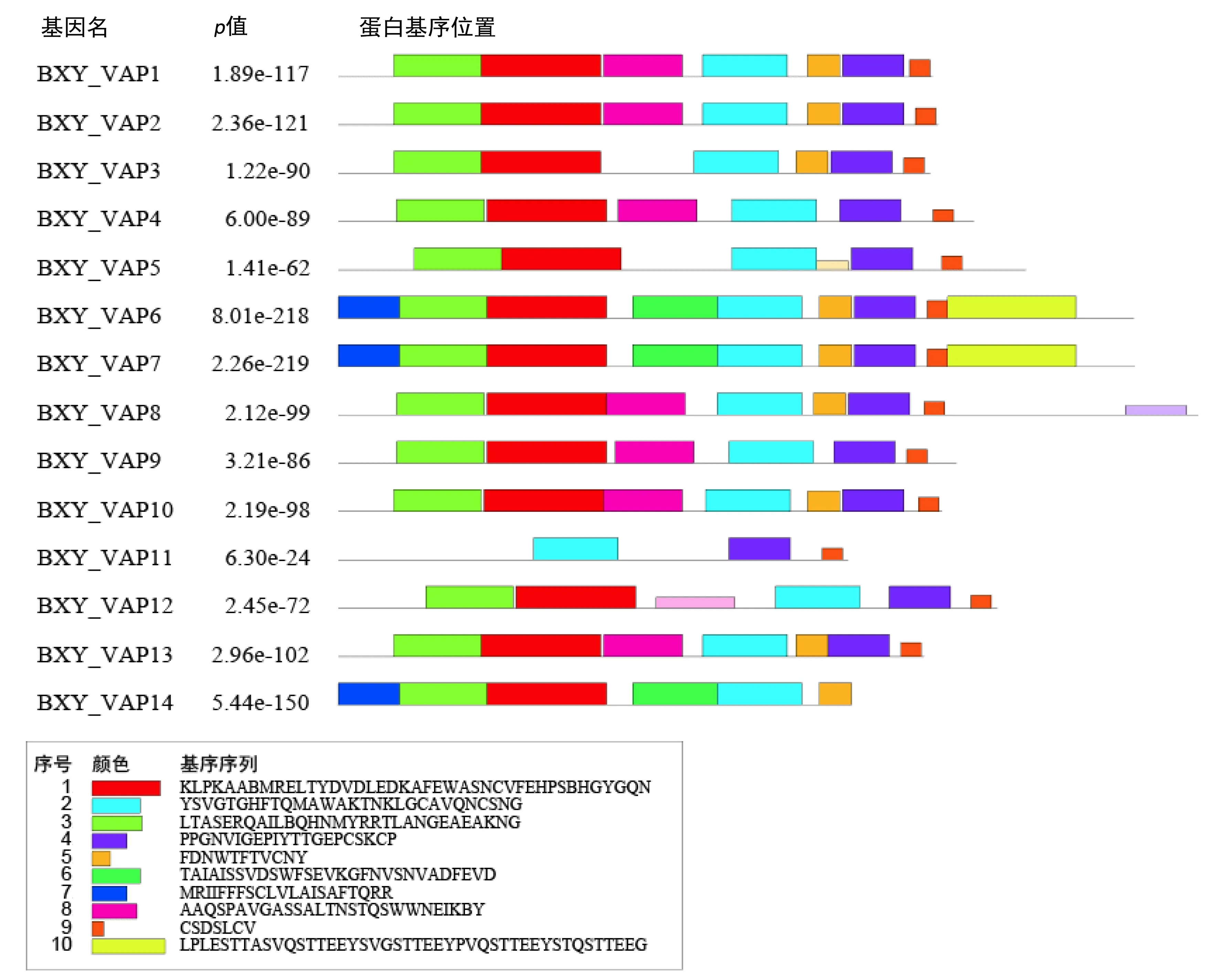
图2 Bx-VAPs的蛋白质基序示意图
2.3 蛋白质疏水性及跨膜螺旋区分析
Bx-VAPs包含多个亲水性和疏水性区域,其聚集现象并不显著.以BXY-VAP2为例,其第 194位精氨酸(R)的疏水性分值低(-2.867),表明其具有很高的亲水性;但第8位亮氨酸(L)的疏水性分值较高(1.733),表明具有疏水性(表3).进一步通过TMHMM对蛋白质序列分析发现,该家族成员除VAP5和VAP11外,均属于胞外蛋白,且不存在跨膜运输结构.
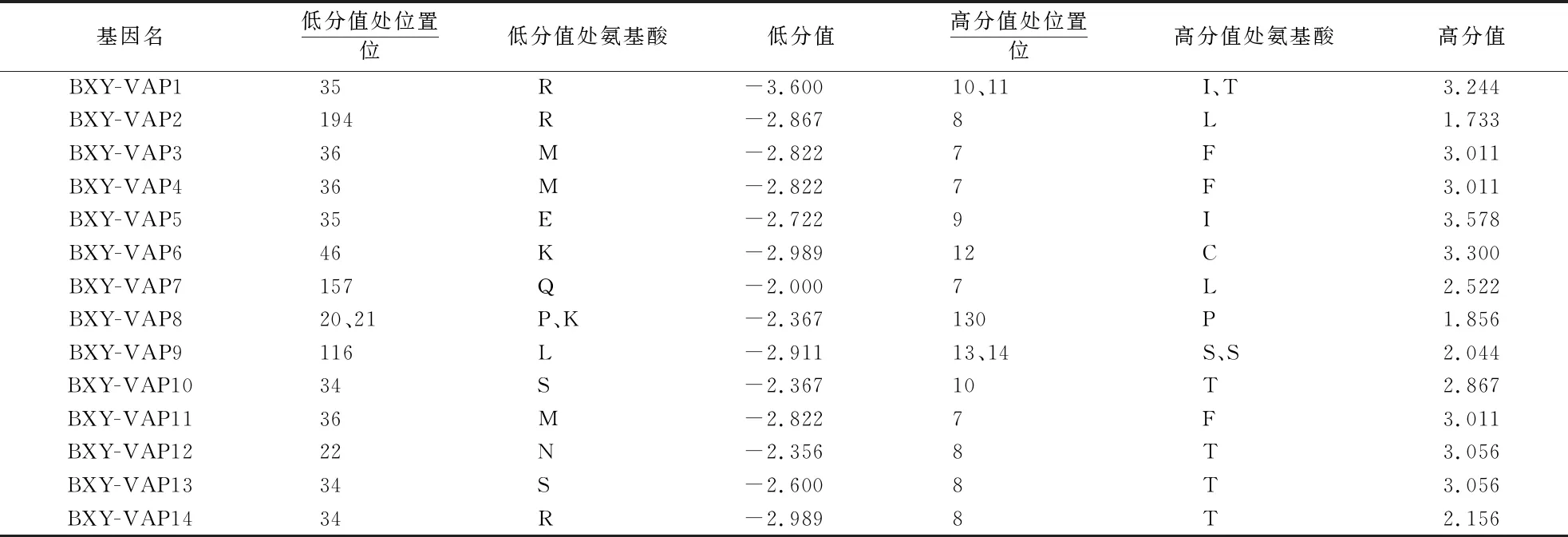
表3 Bx-VAPs疏水性分析1)
2.4 拓扑异构模型预测
由表4可见,14个Bx-VAPs的氨基酸数量相近,分布在175~295个之间,蛋白质结构上含有0~5个N-糖基化位点,苏氨酸(T)、丝氨酸(S)数量差异较大,酪氨酸(Y)数量接近.其中,BXY-VAP2具有5个N-糖基化位点,BXY-VAP3、BXY-VAP4、BXY-VAP11、BXY-VAP13、BXY-VAP14均具有3个N-糖基化位点(图3).研究证明,N-糖基化位点对蛋白质的折叠和运输起重要作用[33],从侧面说明Bx-VAPs具有分泌蛋白的特性.此外,BXY-VAP5和BXY-VAP11没有信号肽,因此,除这两个蛋白以外均为分泌蛋白.
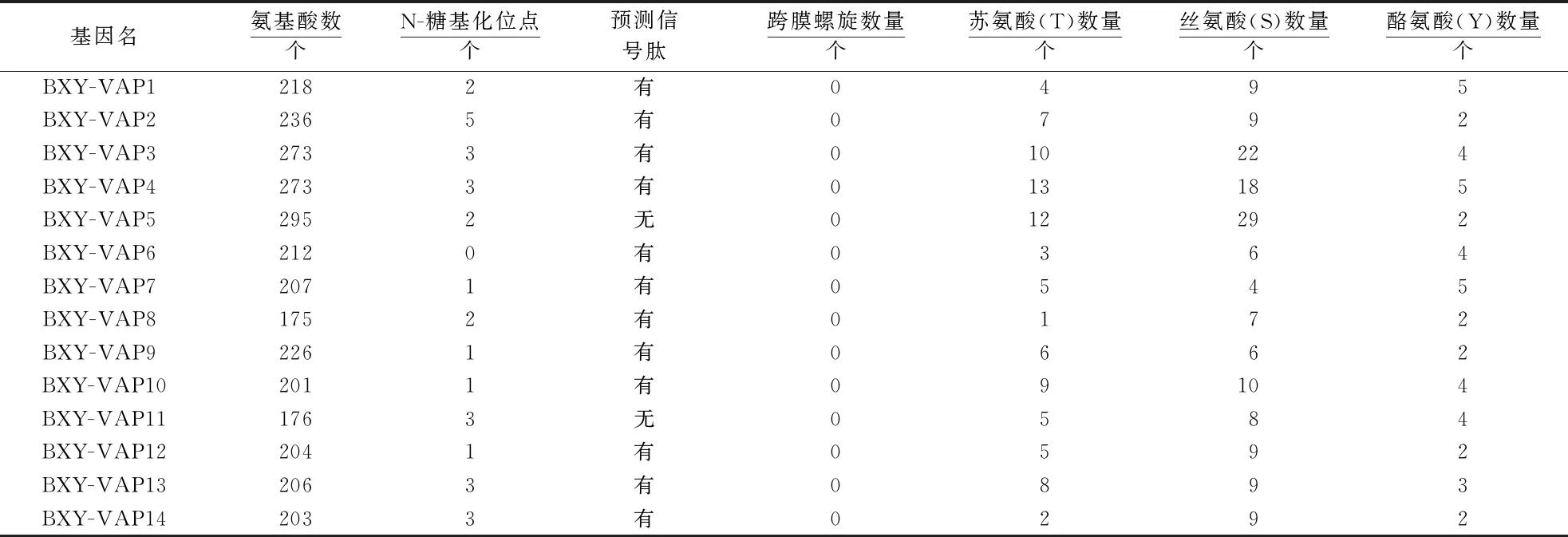
表4 Bx-VAPs拓扑结构分析
2.5 二级结构分析及三级结构建模
通过对Bx-VAPs二级结构进行分析(表5)发现,14个Bx-VAPs蛋白质的组成结构不同,其中,无规则卷曲(32.95%~56.57%)、α-螺旋(16.57%~47.73%)和β-折叠(10.84%~21.71%)3种结构的占比较高,β-转角(1.47%~11.83%)结构的占比较低.因而推测Bx-VAPs二级结构中无规则卷曲、α-螺旋和β-折叠起决定作用.三级结构建模结果(图4)表明,松材线虫VAP1、VAP3、VAP4、VAP6、VAP7、VAP12和VAP14结构相似,而VAP2、VAP5、VAP8、VAP10和VAP13结构相似.结合蛋白拓朴结构分析发现,除VAP5和VAP11外,其他Bx-VAPs三级结构均有明显的胞外蛋白形态特征.
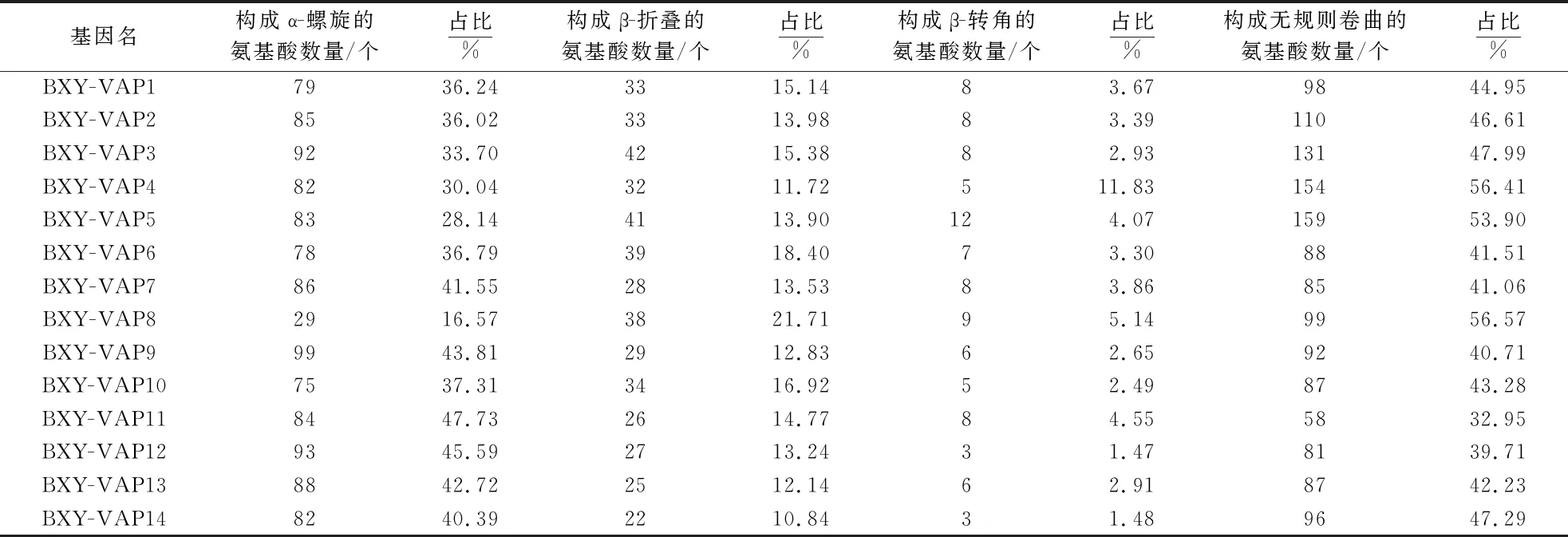
表5 Bx-VAPs中构成蛋白质二级结构的氨基酸数量分析
3 讨论
VAP作为一种高度保守的线虫分泌物,可以抑制受伤的寄主植物组织激活自身防御系统,从而调节寄主植物因寄生线虫危害而产生的免疫应答[34].研究表明,在寄生线虫各寄生阶段VAP基因表达均发生特异性上调[35-38].本研究利用生物信息学方法预测了松材线虫VAP家族成员结构,可为进一步从分子生物学水平上揭示松材线虫的致病机制奠定基础.
线虫在寄生过程中VAP在结构上相对保守,植物和动物寄生线虫VAP基因序列无显著差异[17].因此,可以利用已知线虫的VAP基因定位其他线虫的VAP基因,进而对其功能进行验证.本研究基于隐杆线虫属线虫的基因共鉴定到14个松材线虫VAP家族基因,尽管不同Bx-VAPs氨基酸组成数量、相对分子质量存在很大的差异,但在进化上相对保守,与其他线虫[17]相似.
线虫VAP家族被归类为SCP/TAPS蛋白,其核心是一个结构保守的约15 ku富含半胱氨酸的CAP结构域,具有类似α-β-α的三明治结构,其保守、稳定的结构特性有利于不同种类线虫对寄主免疫应答的调节[8,39-41].本研究中,α-螺旋和β-折叠是松材线虫VAP家族成员的重要组成部分,且所有蛋白均含有CAP结构域,具有明显的胞外蛋白形态特征,该结构可能是松材线虫调节寄主免疫应答的重要功能位点.
线虫侵入动物和植物后,会在宿主组织中迁移、繁殖,并以宿主细胞为食,对宿主造成严重损害[42-43].在此过程中,线虫会通过调节宿主的免疫应答过程而限制宿主对其造成的伤害,创造适合自身生存的环境[42,44-45],VAP在其中发挥着重要的作用.然而,目前针对松材线虫VAP家族的研究较少.未来应该从松材线虫和寄主植物两个方面加强对VAP家族的研究,为明确松材线虫入侵机制和开展植物抗性育种工作奠定基础.
