基于扩散峰度成像直方图构建低级别胶质瘤预后的列线图模型
2022-10-08施蒙马跃虎任军王同兴殷信道彭明洋
施蒙,马跃虎,任军,王同兴,殷信道,彭明洋*
作者单位:1.南京市中西医结合医院医学影像科,南京 210000;2.南京医科大学附属南京医院(南京市第一医院)医学影像科,南京 210006
脑胶质瘤仍然是最常见的原发性脑肿瘤[1]。根据WHO 2016 年分类可将其分为高级别胶质瘤(WHOⅢ~Ⅳ级)和低级别胶质瘤(WHO Ⅰ~Ⅱ级)[2]。低级别胶质瘤(low-grade gliomas, LGG)虽然只占20%且生长缓慢,但具有转化为高级别胶质瘤的风险[3-4]。即便采取最佳的治疗措施,患者仍然存在较高的复发及致死致残率。扩散峰度成像(diffusion kurtosis imaging, DKI)是描述组织内水分子扩散非高斯分布的扩散成像新技术,能更好地反映组织的微观结构复杂性[5]。基于像素分布的直方图分析可提供更多反映肿瘤异质性的定量参数,能更全面地评估肿瘤的生物学特征[6]。以往的研究显示发病年龄、肿瘤发生位置、病理组织学类型、脑血流量、治疗方法及DKI参数等与胶质瘤患者的生存预后相关[7-10]。但目前为止,尚无系统的评价体系综合纳入这些因素。列线图模型可通过联合多指标诊断或预测某一临床事件的发生,已广泛应用于肿瘤患者的生存期预测中[11-12]。本研究旨在基于DKI直方图影像组学特征构建预测LGG患者生存率的列线图,建立一个相对准确直观的评价模型来预测LGG患者的总生存率。
1 资料与方法
1.1 研究对象
本研究经过南京医科大学伦理委员会批准(批准文号:2018-448),免除受试者知情同意。回顾性分析2018 年1 月至2020 年6 月在南京市第一医院神经外科就诊的LGG 患者病例资料。纳入标准:(1)所有患者均为初发首治;(2)术前均行头颅DKI 检查;(3)生存资料及病理生理资料完整(如年龄、性别、WHO 分级、病理类型、脑叶位置、肿瘤部位、术后是否放疗等);(4)术前未接受化疗或放疗。排除标准:(1)接受过皮质类固醇或抗生素治疗或曾接受过脑部手术的患者;(2)DKI 图像因运动伪影太重无法评估;(3)30 d内死亡的患者。根据头颅MRI、PET/CT、病理评估预后,分为复发和未复发,并每半年通过电话随访患者生存情况。随访时间为2年。
1.2 MRI扫描参数
所有患者在治疗前行MRI扫描,采用西门子医疗系统的3.0 T MR 扫描(Magnetom Verio, Siemens Medical Solutions,Erlangen, Germany),扫描序列包括T1WI、T2WI、液体衰减反转恢复序列(fluid attenuated inversion recovery, FLAIR)、扩散加权成像(diffusion-weighted imaging, DWI)、DKI和T1 增强扫描。DKI 扫描参数如下:TR 3000 ms;TE 109 ms;矩 阵128×128;FOV 256 mm×256 mm;FA 90°;层数15;层厚4 mm;b 值0、500、1000、1500、2000和2500 s/mm2,方向30。
1.3 图像处理及VOI勾画
使用FMRIB扩散工具包(版本v6.0, Oxford, UK,http://fsl.fmrib.ox.ac.uk/fsl/fslwiki/FSL)对 图像进行头部运动和涡流畸变校正,应用DKE软件(版本DKE 2.6,http://www.nitrc.org/projects/dke)对DKI图像进行刚体配准和空间平滑(高斯平滑),以获得参数图各向异性分数(fractional anisotropy, FA)、平均扩散率(mean diffusivity, MD)、平均峰度(mean kurtosis, MK)、峰度各向异性分数(kurtosis fractional anisotropy, KFA)和平均峰度张量(mean kurtosis tensor, MKT)。使用ITK-SNAP软件(版本3.4.0, http://www.itksnap.org)在DKI 图像上逐层勾画获取整个肿瘤实质区作为感兴趣容积(volume of interest,VOI)进行直方图分析(图1)。勾画过程中以横断位T1WI增强图像作为参考,避免包含较大的囊变、坏死、出血及血管所在的区域。最后获得各个参数图的直方图参数,包括:平均值、最小值、最大值、方差、第20百分位数(20th)、第50 百分位数(50th)、第75 百分位数(75th)、偏度和峰度,共获得45 个DKI 特征。所有VOI勾画均由1名具有5年中枢影像诊断经验的高年资主治医师在未告知临床资料的前提下进行勾画,并由另外1 名具有10 年中枢影像诊断经验的副主任医师校对。意见不统一时经协商达成一致。


图1 右侧额叶星形细胞瘤Ⅱ级T1 增强及扩散峰度成像(DKI)图感兴趣区勾画示例,1A~1F分别为T1增强、各向异性分数(FA)、平均扩散率(MD)、平均峰度(MK)、峰度各向异性分数(KFA)和平均峰度张量(MKT)图。Fig. 1 An example of volume of interest delineation on T1 enhancement and diffusion kurtosis imaging (DKI) images in right frontal astrocytoma (grade Ⅱ),1A-1F: T1 enhancement, fractional anisotropy (FA), mean diffusivity (MD),mean kurtosis (MK), kurtosis fractional anisotropy (KFA) and mean kurtosis tensor(MKT),respectively.
1.4 特征选择及DKI评分
采用最低绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)筛选预测预后的最佳影像特征,并根据最佳影像特征的系数加权线性组合计算出DKI评分。
1.5 统计学分析
所有数据均采用R 3.5.1 统计软件进行处理。符合正态分布的计量资料以均数±标准差表示,并应用独立t检验分析,不符合正态分布的计量资料以中位数(四分位数)表示,并应用Mann-WhitneyU检验分析,计数资料采用例数(百分比)表示,并采用χ2检验分析。使用Kappa分析评估观察者间DKI感兴趣区勾画的一致性。使用R 软件行Kaplan-Meier 法绘制生存曲线,Log-rank比较组间差异。单因素Cox回归分析分析相关独立的危险因素,进而纳入多变量Cox回归分析,最后产生独立的风险因素。基于上述预后因素构建LGG 列线图,采用1000 次重采样的方法用于构建列线图和校准曲线以减少过度拟合偏差,使用一致性指数(C-index)评估观察值的和预测值之间的区别,利用C-index 比较列线图与WHO 分级的预后效能。采用决策曲线分析(decision curve analysis, DCA)评价模型获益情况,通过计算不同阈值概率下的净效益,以确定本预测模型的临床效益用途。应用受试者工作特征(receiver operating characteristic,ROC)曲线评估模型的预测效能。临床变量模型和列线图模型的效能比较采用Delong 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 LGG患者临床数据及人口学特征
共95例LGG患者纳入研究,其中5例曾接受过脑部手术,2 例DKI 图像伪影较大,最终共88 例纳入分析。其中男51 例,女37 例,年龄(54.15±12.83)岁,23 例患者复发,65 例患者术后未复发。少突星形细胞瘤8 例,少突胶质细胞瘤37 例,星形细胞瘤43 例。年龄、WHO分级、病理类型、肿瘤部位、是否放化疗在生存组和死亡组间差异具有统计学意义(P<0.05)(表1)。图2为低级别胶质瘤复发与未复发的影像示例。
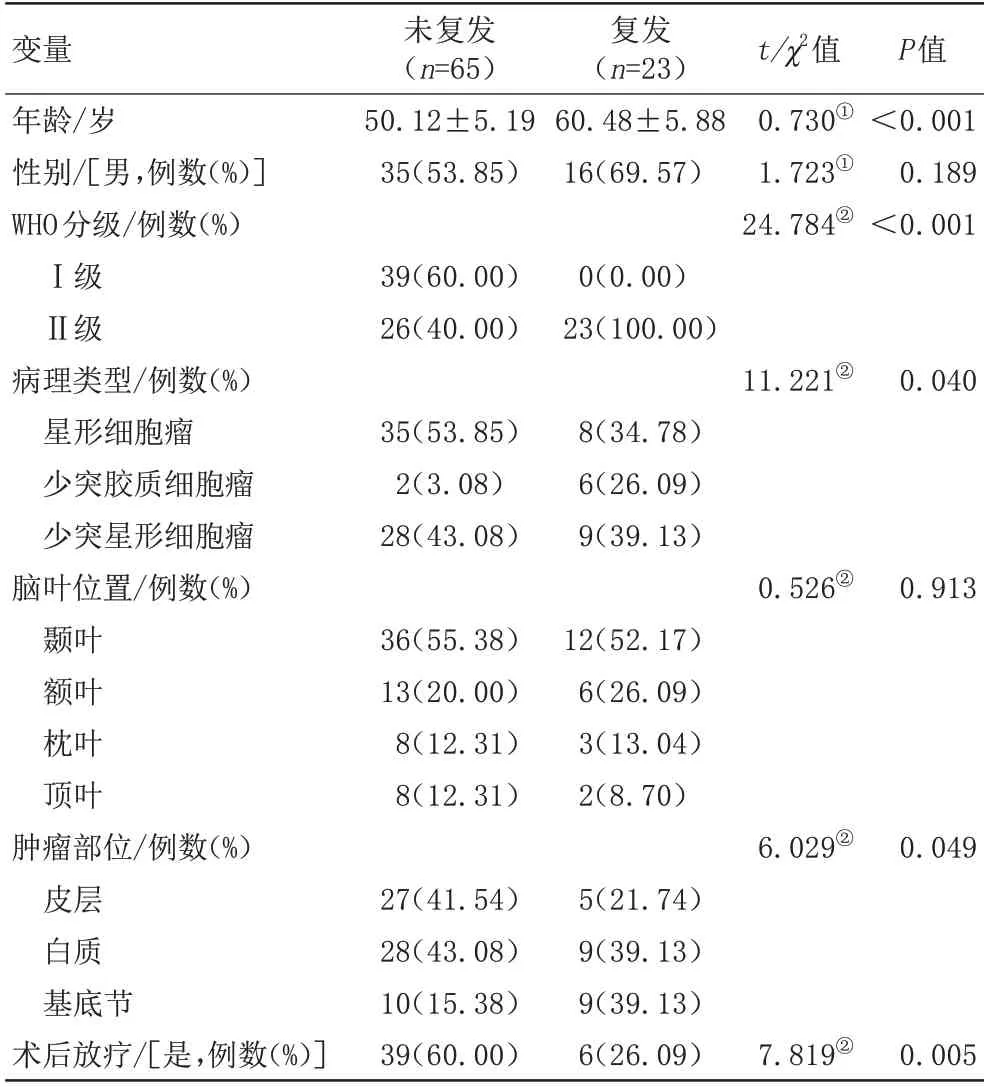
表1 低级别胶质瘤基线资料和组织病理学分布Tab.1 The clinical data and distribution of histopathological in low-grade glioma


图2 典型低级别胶质瘤未复发与复发影像示例。2A~2E:右侧额叶星形细胞瘤(WHO Ⅰ级),术后2年随访MRI(2E)未见明显复发征象。2F~2J:右侧枕叶星形细胞瘤(WHO Ⅱ级),术后1年随访MRI(2J)可见复发征象。Fig. 2 Typical example of low-grade gliomas with no recurrence and recurrence. 2A-2E: Right frontal lobe astrocytoma (WHO grade Ⅰ). No obvious recurrence signs were found on MRI (1E) after 2 years of follow-up.2F-2J: Right occipital astrocytoma (WHO grade Ⅱ). MRI (2J) showed signs of recurrence one year after operation.
2.2 DKI特征筛选及评分
DKI感兴趣区勾画在2位医师间具有很高的一致性(Kappa值:0.92)。经LASSO降维后共筛选出9个与预后最相关的特征,分别为MD 方差、MD 峰度、FA 最小值、FA 方差、FA 偏度、KFA 25th、KFA 偏度、MK 偏度、MKT 25th。LASSO系数分布图见图3。DKI评分公式为:
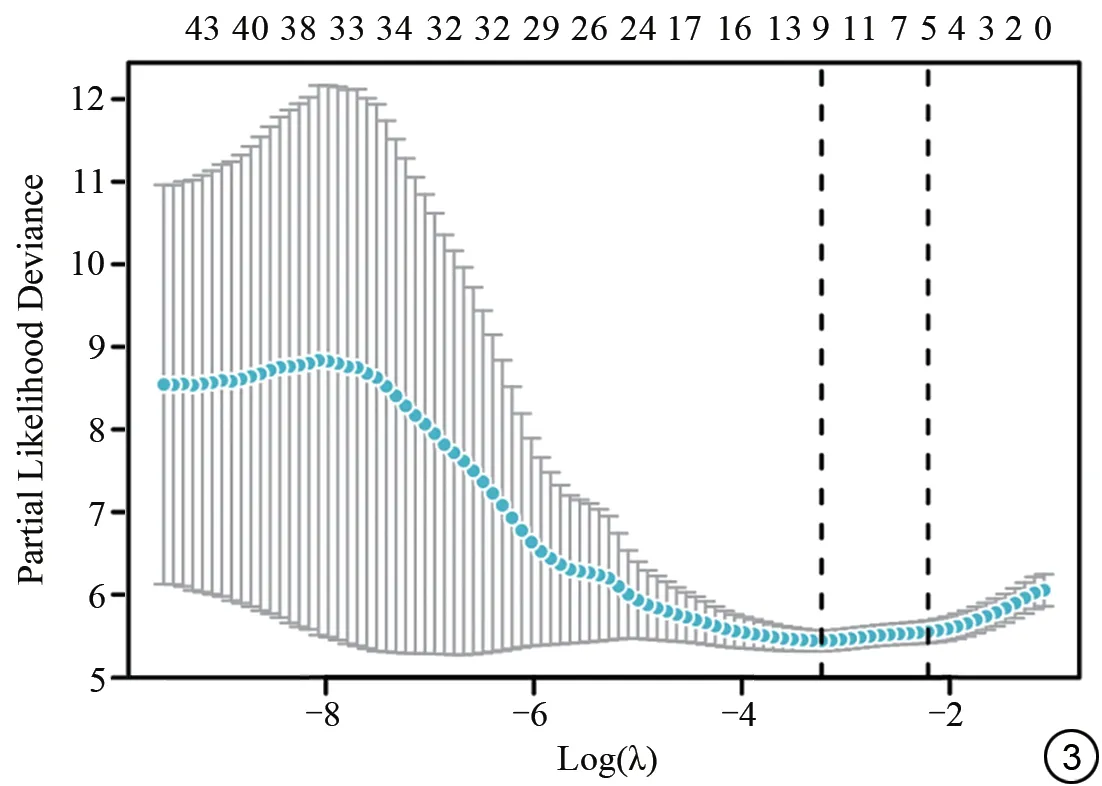
图3 低级别胶质瘤扩散峰度成像(DKI)直方图特征LASSO系数分布。Fig. 3 The distribution of LASSO coefficients of diffusion kurtosis imaging(DKI)histogram radiomics in low-grade glioma.
分数=(2.16×MD方差)+(-0.09×MD峰度)+
(-10.24×FA最小值)+(10.27×FA方差)+
(-1.22×FA偏度)+(-7.27×KFA 25th)+(0.26×
KFA偏度)+(-0.30×MK偏度)+(3.72×MKT 25th)。 (1)
2.3 Cox回归分析各因素与LGG患者预后关系
单因素Cox回归分析发现年龄、WHO分级、病理类型、脑叶位置、肿瘤部位、术后放疗与否、DKI 评分是影响LGG 患者预后的关键因素。进一步多因素Cox回归分析发现年龄、WHO 分级、脑叶位置、肿瘤部位、术后放疗与否、DKI 评分仍然是影响LGG 患者预后的关键因素(表2)。基于以上关键的独立危险因素,本研究构建了基于DKI 评分预测LGG 患者生存率的列线图(图4)。采用Bootstrap法对列线图进行内部验证,抽样次数B=1000,验证结果显示一致性指数为0.838(95%CI:0.816~0.860),具有良好的预测价值。基于以上变量和DKI 评分建立列线图模型预测LGG 预后的曲线下面积为0.953,明显大于基于临床变量的模型的0.745(Z=-3.42,P=0.005)(图5A)。DCA 显示临床变量模型的一致性指数为0.667(95%CI:0.614~0.719),列线图模型的一致性指数为0.858(95%CI:0.833~0.882),表明列线图模型的净收益优于临床变量模型(图5B)。校准曲线提示在观察值与预测值之间有良好的一致性(图5C)。

表2 低级别胶质瘤患者复发与未复发的Cox回归模型单因素和多因素分析Tab.2 Univariate and multivariate analysis of Cox regression model in low-grade glioma patients between no recurrence and recurrence

图4 低级别胶质瘤患者五年生存率预后预测的列线图。DKI:扩散峰度成像。 图5 低级别胶质瘤预后模型效能评估结果。5A:临床变量模型和列线图模型预测低级别胶质瘤预后的受试者工作特征曲线;5B:临床变量模型和列线图模型的决策曲线图;5C:低级别胶质瘤患者列线图模型五年生存率校准曲线。Fig. 4 Prognosis prediction nomogram of 5-year survival rate in low-grade glioma patients. DKI: diffusion kurtosis imaging. Fig. 5 The evaluation results of low-grade glioma prognosis model. 5A: The receiver operating characteristic curve of clinical variable model and nomogram model for predicting the prognosis of low-grade gliomas; 5B: Decision curve analysis of clinical variable model and nomogram model; 5C: Calibration curve of 5-year survival rate of nomogram model in low-grade glioma patients.
3 讨论
本研究基于88 例低级别胶质瘤的DKI 直方图的影像特征分析,构建预后评估模型。Cox 回归分析结果显示年龄、WHO 分级、脑叶位置、肿瘤部位、术后放疗与否、DKI 评分是LGG 预后的关键危险因素。基于以上危险因素构建列线图模型,其预测效能明显优于临床变量模型,并具有较好的临床效益。基于DKI直方图的列线图模型可直观全面地预测LGG 患者预后,为临床个性化评估患者生存预后提供有力工具。
3.1 低级别胶质瘤预后评估的国内外现状
胶质瘤病理分级存在差异时,其治疗方案的选择及预后也会不同[13-14]。LGG 胶质瘤的治疗主要以手术切除为主,辅以放射治疗或化学治疗[15]。准确评估LGG患者的生存率对神经外科医生选择合适的治疗方案及后续治疗、随访均具有重要意义[3,16]。本研究基于Cox回归分析发现的年龄、WHO分级、病理类型、脑叶位置、肿瘤部位、术后放疗与否、DKI 评分等关键因素构建了LGG 患者的个体生存列线图,通过临床参数和DKI评分预测患者生存率,并具有较高的准确率。
以往已有较多研究显示年龄、组织学类型、肿瘤分级等与LGG 预后相关[17-20]。本研究经Cox 回归分析发现的年龄、WHO 分级、病理类型、脑叶位置、肿瘤部位等是LGG预后的关键因素,这与以往的研究结果一致。Alattar 等[21]研究发现对于年龄<50 岁的非额叶肿瘤患者,尽管IDH 突变率相当,但手术后患者的生存率仍存在差异,额叶LGG 患者的预后较好。此外,本研究显示接受放疗的患者通常预后较好。目前LGG患者放疗的选择仍存在争议。林明健等[9]研究显示虽然放疗在Cox多因素中未见明显差异,但列线图中发现接受术后放疗的患者预后更好。李文菲等[22]结果与本研究相同,显示经过Cox 多因素后放疗仍然是LGG 患者预后的关键因素,且在列线图中,对于接受放疗的患者其评分越低,五年生存率越高。此外,李文菲等[22]研究显示多参数MRI 评分(常规MRI、扩散张量成像、动态磁敏感对比增强)可有效地预测LGG 患者预后,MRI 评分低危组与高危组的生存曲线存在明显差异。然而,该MRI 评分需多序列扫描,并非所有患者都可扫描所有序列。
3.2 DKI 直方图参数特征预测低级别胶质瘤预后的价值
本研究基于DKI直方图参数进行特征筛选,获得DKI 评分,用于LGG 患者预后评估,结果显示DKI 评分是LGG 患者预后的关键因素,基于临床变量和DKI 评分的列线图预测五年生存率具有较高的准确性。DKI 是DTI 的扩展,通过量化扩散诱导信号衰减的高斯扩散行为的偏离度,可以提供组织特征的更精确的信息,并可从DKI中得到FA、MD、MK、KFA和MKT等参数[23-25]。直方图分析可更全面地估计肿瘤的生物学特征[26]。以往已有较多研究显示DKI 直方图分析可较为准确地预测胶质瘤级别[27-30]。然而,目前尚无DKI直方图分析与临床变量相结合预测LGG患者的生存率,这也是本研究的创新点之一。该列线图对LGG患者预后预测的AUC达0.95,明显优于临床变量预后预测效能(0.76)。且优于李文菲等[22]多参数MRI 评分列线图的0.8。本研究中基于DKI直方图参数特征和临床变量的单因素、多因素分析及开发的列线图模型的净收益优于临床变量模型。校准曲线提示在观察值与预测值之间有良好的一致性。由此可见,该列线图模型可为患者提供简单、直观的预后判断,为临床医生对LGG 患者的生存率把握提供有利的工具,使患者得到最大获益。
3.3 局限性分析
本研究仍然存在一定的局限性:首先,本研究样本的病理类型较为单一;其次,其他影响因素如IDH基因突变、治疗方案等未纳入分析;最后,本研究为单中心研究,未来需进一步应用多中心数据进行验证。
综上所述,年龄、WHO 分级、病理类型、脑叶位置、肿瘤部位、术后放疗与否、DKI评分等是影响LGG预后的独立危险因素。基于临床变量及DKI 直方图参数的列线图模型可更为准确、直观地预测低级别胶质瘤的总生存率,为临床提供个性化治疗。
作者利益冲突声明:所有作者均声明不存在利益冲突。
