酰胺质子转移加权成像与体素内不相干运动成像评估肺腺癌病理分级及其与SUVmax 的相关性
2022-10-08冯鹏洋孟楠方婷董柏杨阳袁健闵魏巍王梅云吴亚平
冯鹏洋,孟楠,方婷,董柏,杨阳,袁健闵,魏巍,王梅云,*,吴亚平
作者单位:1.河南大学人民医院(河南省人民医院)医学影像科,郑州 450003;2.郑州大学人民医院医学影像科,郑州 450003;3.河南省人民医院骨科,郑州 450003;4.北京联影智能影像技术研究院,北京 100094;5.上海联影医疗科技股份有限公司,上海 201815;6.河南省人民医院医学影像科,郑州 450003
肺癌是目前全球患病率和病死率最高的恶性肿瘤[1],其中,肺腺癌已成为全世界最常见的组织学癌症类型[2]。病理分级作为评估肺腺癌恶性程度的一个独立的指标,其影响治疗方式及判断患者预后[3]。肿瘤分化程度越低,表明增长速度快,易发生转移,预后不佳,因此能够尽早预测肺腺癌的病理分级是亟待解决的问题。活检目前是评估病理分级的主要手段,不仅会对身体造成医源性损伤,而且临床操作者的操作经验、取样位置、大小均会对病理分析造成误差。体素内不相干运动成像(intravoxel incoherent motion, IVIM)包括双指数模型和拉伸指数模型[4],前者主要反映水分子的扩散和灌注信息[5],后者主要反映组织的异质性[6]。酰胺质子转移加权成像(amide proton transfer weighted imaging, APTWI)[7-8]可用于定量评估组织中多肽及游离蛋白质水平。正电子发射型电子计算机断层扫描(positron emission tomography,PET)[9]能够反映组织的代谢情况。已有研究表明,APTWI与IVIM可用于评估肺部良、恶性[10],表观扩散系数(apparent diffusion coefficient, ADC)可用于肺腺癌分化程度的评估[11],同时,最大标准化摄取值(maximum standard uptake value, SUVmax)在不同病理分级中存在差异[12],但是APTWI与IVIM在病理分级中的对比研究鲜有报道。本研究旨在应用PET/MR[13],探讨APTWI、IVIM及SUVmax在诊断肺腺癌病理分级中的价值,以期为肺腺癌的诊断和治疗提供更多的帮助。
1 材料与方法
1.1 研究对象
本研究经河南省人民医院伦理委员会批准(批准文号:2020116),全体受试者均签署了知情同意书。前瞻性收集2020 年11 月至2021 年10 月经河南省人民医院影像检查怀疑为肺部肿瘤的患者,共95例患者进行胸部PET/MR检查。纳入标准如下:(1)PET/MR 检查无禁忌证(起搏器、金属支架、幽闭恐惧症等);(2)PET/MR 扫描后1 周内获得明确病理结果;(3)均为肺腺癌患者,病理分级明确。排除标准如下:(1)经手术或穿刺病理证实为鳞癌、小细胞肺癌、大细胞肺癌或非肺癌患者;(2)结节最大直径小于1 cm 的患者;(3)图像受伪影影响显示不佳的患者;最终共66 例患者被纳入,其中男34 例,女32 例,年龄34~79(61.5±10.36)岁。术后病理结果显示高分化17 例,中分化22 例,低分化27 例。由于低分化腺癌较中高分化腺癌更容易发生肿瘤坏死及淋巴结转移,预后不佳,因此本研究将高分化与中分化肺腺癌患者纳入中高分化组,将低分化肺腺癌患者纳入低分化组(表1)。

表1 肺腺癌患者基本信息Tab.1 Basic information of patients with lung adenocarcinoma
1.2 检查方法
采用12 通道相控阵体线圈的3.0 T PET/MR 扫描仪(uPMR790,上海联影医疗科技股份有限公司,上海,中国)进行扫描。患者检查前需禁食6 h以上,晨起空腹血糖<6.5 mmol/L。扫描前再次确认患者未携带金属物品,按标准剂量0.11 mCi/kg 静脉注射PET 示踪剂18F-FDG。胸部PET/MR 是在注射后静息60 min 左右进行,要求患者仰卧位。扫描范围为上界至中颈部,下界至上腹部(膈下2 cm),以完整覆盖全肺为标准,使用呼吸导航以监测呼吸。PET 扫描采用1 个床位,采集时间为27 min,采用有序子集最大期望值迭代法重建图像(迭代次数:2,子集:20,体素大小:2.6 mm×2.6 mm×2.0 mm)。在PET 扫描的同时,获得二维轴位T1WI、T2WI、IVIM 及APTWI 序列图像。T1WI扫描序列参数:2D-快速自旋回波(fast spin echo, FSE),TR 3.54 ms,TE 1.51 ms,层厚2 mm,FOV 400 mm×300 mm,矩阵304×100,层数35,NEX 1,扫描时间14 s;T2WI 扫描序列参数:2D-FSE,TR 3315 ms,TE 90.2 ms,层厚5 mm,FOV 380 mm×300 mm,矩阵320×70,层数42,NEX 2,扫描时间2.26 min;IVIM扫描序列参数:平面回波成像(echo planar imaging,EPI),TR 3315 ms,TE 90.2 ms,层厚5 mm,FOV 400 mm×300 mm,矩阵128×100,层数10,b=0、25、50、100、150、200、400、600、800、1000 s/mm2,NEX 1、1、2、2、4、4、6、6、8 和10,扫描时间3.38 min;APTWI 扫描序列参数:2D-FSE,TR 4500 ms,TE 54.72 ms;层 厚5 mm,FOV 400 mm×300mm,矩阵128×100,层数1,NEX 1,扫描时间3.15 min,ETL 39,B1 1.3 μT 和2.5 μT,高斯脉冲,收集WASSAR图像用于S0图的校正。
1.3 图像处理及分析
将所采集到的PET 和IVIM 图像导入联影工作站(UWS-MR:R005),利用高级软件包进行处理。所有的APTWI 图像传入个人计算机,使用非对称磁化转移率(magnetization transfer ratio asymmetry, MTRasym)测量软件进行分析。将IVIM各参数的伪彩图与扩散加权成像(diffusion weighted imaging, DWI)图像相融合,以轴位T1WI 和T2WI 图像为参考,对IVIM 各参数的伪彩图及MTRasym 伪彩图上具有肿瘤实性部分的所有层面沿肿瘤边缘内侧手动绘制感兴趣区(region of interest, ROI),从而获得扩散系数(D)、假扩散系数(D*)、灌注分数(f)、扩散分布指数(distributed diffusion coefficient, DDC)、扩散异质性指数(α)及非对称磁化转移率[MTRasym(3.5 ppm)]值。绘制ROI 时,注意避开明显出血、坏死、钙化及囊变等区域并取三次测量值的平均值作为结果。工作站的后处理软件自动提取PET 的肿瘤感兴趣体积(volume of interest, VOI),从而计算出肿瘤的SUVmax 值。以上均由两位放射科医师(分别为5 年和12 年胸部影像学诊断经验的主治医师和副主任医师)在未知组织病理学结果的情况下,独立绘制ROI及测量定量参数值。
1.4 统计学分析
采用SPSS23.0 以及Medcalc15.0 软件对数据统计学分析。组内相关系数(intraclass correlation coefficient, ICC)用于评价两名放射科医师间测量结果的一致性。采用Shapiro-Wilk 检验各参数值是否服从正态分布。采用Mann-WhitneyU检验比较中高分化、低分化组间各参数的差异。采用Pearson 相关分析探讨各参数与SUVmax 间的相关性。受试者工作特征(receiver operating characteristic, ROC)曲线被用来评估诊断效能。Delong检验用于分析每个参数下的ROC 曲线下面积(area under the curve, AUC)是否存在显著差异。P<0.05为差异具有统计学意义。
2 结果
2.1 一致性分析
两位医师所测MTRasym(3.5 ppm)、D、D*、f、DDC、α 值均具有较高的一致性,ICC 分别为0.932、0.872、0.767、0.819、0.842、0.791。取二者的平均值作为最终结果纳入本研究。
2.2 参数对比
APTWI、IVIM 和18F-FDG PET 各参数伪彩图见图1。低分化组的MTRasym(3.5 ppm)、f 值显著高于中高分化组,而 D、DDC 值显著低于中高分化组(P均<0.05)。低分化与中高分化组间D*、α 值的差异无统计学意义(表2)。
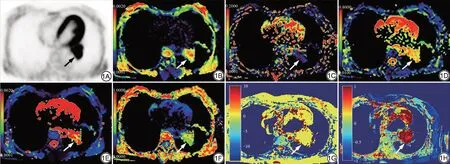

图1 患者女,52 岁,左肺下叶中分化腺癌(箭)。1A:PET 轴位图像, SUVmax=3.84;1B:D 伪彩图,D=1.21×10-3 mm2/s;1C:D*伪彩图,D*=23.98×10×10-3 mm2/s;1D:f 伪彩图,f=23.00%;1E:DDC 伪彩图,DDC=0.621×10-3 mm2/s;1F:α 伪彩图,α=1.672;1G:B0 伪彩图;1H:MTRasym 伪彩图,MTRasym(3.5 ppm)=1.45%;1I:病理图片(HE×100)。PET:正电子发射型电子计算机断层扫描;SUVmax:最大标准化摄取值;D:扩散系数;D*:假扩散系数;f:灌注分数;DDC:扩散分布指数;α:扩散异质性指数;MTRasym(3.5 ppm):非对称磁化转移率。Fig. 1 Male, 52 years, with moderately differentiated adenocarcinoma of the left lower lobe (arrows). 1A is PET axial image;1B is D pseudo-colored maps,D=1.21×10-3 mm2/s;1C is D*pseudo-colored maps,D*=23.98×10×10-3 mm2/s;1D is f pseudo-colored maps, f=23.00%; 1E is DDC pseudo-colored maps, DDC=0.621×10-3 mm2/s; 1F is α pseudo-colored maps,α=1.672;1G is the B0 pseudo-colored maps;1H is the MTRasym pseudo-colored maps, MTRasym (3.5 ppm) =1.45%; 1I is pathological images (HE ×100). PET: positron emission tomography; SUVmax: maximum standard uptake value; D:diffusion coefficient;D*:false diffusion coefficient;f:perfusion fraction;DDC:distributed diffusion coefficient;α:diffusion heterogeneity index.
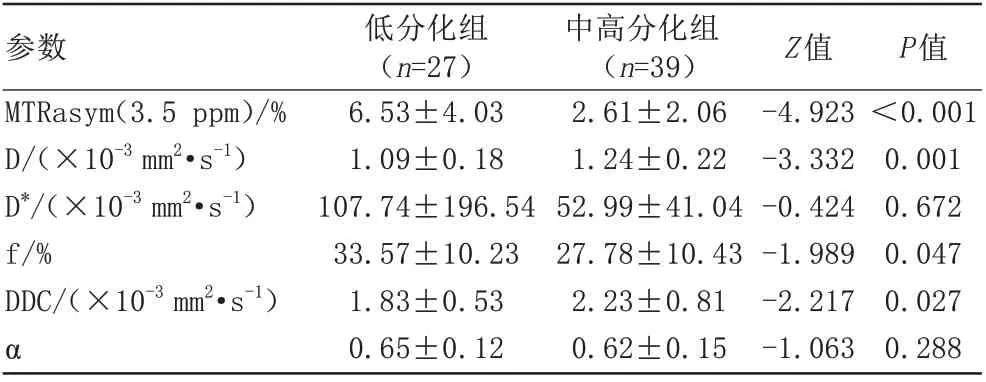
表2 肺腺癌低分化组与中高分化组间各参数值的比较Tab.2 Comparison of parameters between poorly differentiated group and moderately/well differentiated group of lung adenocarcinoma
2.3 诊断效能评估
不同参数鉴别肺腺癌低分化和中高分化的诊断效 能 如 下:AUC [MTRasym(3.5 ppm)]>AUC(D)>AUC(DDC)>AUC(f)>AUC(α)>AUC(D*)(AUC=0.858、0.743、0.661、0.645、0.577、0.531)。MTRasym(3.5 ppm)的诊断效能显著高于除D 值以外的其他参数(P均<0.05),同时,MTRasym(3.5 ppm)具有最佳的特异度(92.59%)。
不同方法及其组合鉴别肺腺癌低分化和中高分化的诊断效能如下:AUC(APTWI+IVIM)>AUC(IVIM)>AUC(APTWI)(AUC=0.973、0.903、0.858)。APTWI联合IVIM的诊断效能显著高于单独成像方法(P均<0.05),而IVIM与APTWI的AUC的差异无统计学意义(图2~3,表3)。

表3 不同参数单独或联合鉴别诊断低分化组与中高分化组的效能分析Tab.3 Efficacy analysis of different parameters alone or combined in differential diagnosis of poorly differentiated group and moderately/well differentiated group
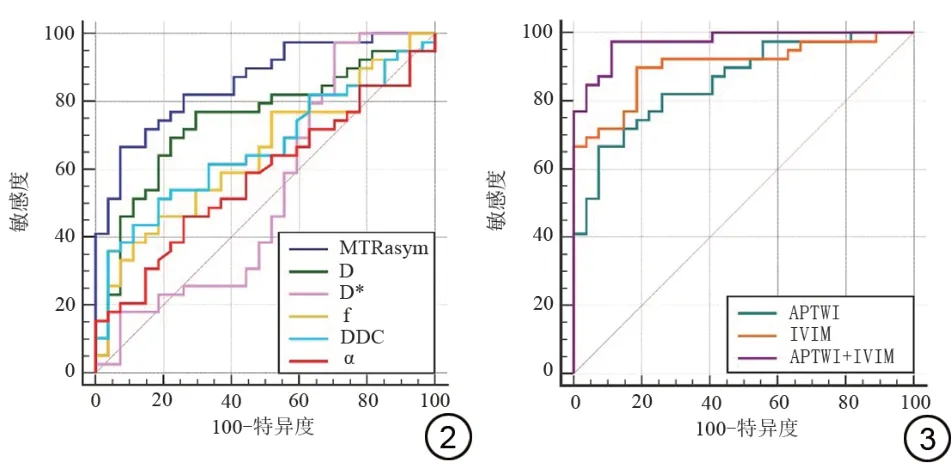
图2 各参数诊断肺腺癌病理分级的受试者工作特征(ROC)曲线。图3 不同方法及联合诊断肺腺癌病理分级的ROC曲线。MTRasym:非对称磁化转移率;D:扩散系数;D*:假扩散系数;f:灌注分数;DDC:扩散分布指数;α:扩散异质性指数;APTWI:酰胺质子转移加权成像;IVIM:体素内不相干运动成像。Fig. 2 Graph shows receiver operating characteristic (ROC) curves of different parameters for discriminating pathological grade of lung adenocarcinoma. Fig. 3 Graph shows ROC curves of different methods and combined methods for discriminating pathological grade of lung adenocarcinoma. MTRasym: maximum standard uptake value; D: diffusion coefficient; D*: false diffusion coefficient; f: perfusion fraction; DDC:distributed diffusion coefficient; α: diffusion heterogeneity index; APTWI:amide proton transfer weighted imaging;IVIM:intravoxel incoherent motion.
2.4 相关性分析
MTRasym(3.5 ppm)与SUVmax 值呈弱正相关(r=0.396,P=0.001)。D、DDC 值分别与SUVmax 值呈弱负相关(r=-0.359,-0.249,P=0.003,0.044)。D*、α 值与SUVmax无相关性(P>0.05)(图4)。
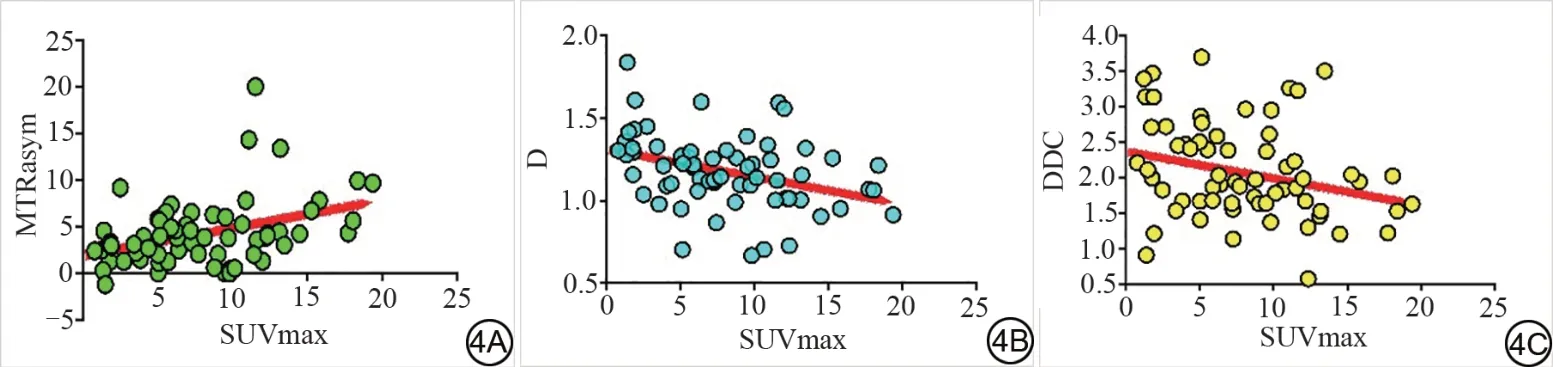
图4 不同参数与最大标准化摄取值(SUVmax)相关性分析。4A:SUVmax与非对称磁化转移率(MTRasym)值间的相关性;4B:SUVmax与扩散系数(D)值间的相关性;4C:SUVmax与扩散分布指数(DDC)值间的相关性。Fig. 4 Correlation analysis between different parameters and maximum standard uptake value(SUVmax).4A:Correlation between SUVmax and magnetization transfer ratio asymmetry (MTRasym) values; 4B: Correlation between SUVmax and D values; 4C: Correlation between SUVmax and distributed diffusion coefficient(DDC)values.
3 讨论
IVIM相较于单指数模型DWI可以更真实地反映水分子的微观运动,APTWI 作为近年来新型的分子影像学技术,能够通过检测游离蛋白和多肽的含量来反映病灶的特征。本研究不仅使用新技术对肺腺癌的病理分级进行鉴别,同时还将两种技术的对比和联合应用进行探讨,这将为肺腺癌患者的临床诊断和预后评估提供新的见解。
3.1 IVIM在肺腺癌病理分级中的研究价值
D、DDC 值是IVIM 用于反映水分子的运动扩散情况的参数[14-15],前者主要代表了纯水分子的扩散,而后者主要反映体素内ADC 值的连续分布情况。本研究中低分化组的D、DDC值均显著低于中高分化组,这与前人的研究相类似[6],进一步表明D、DDC 值可以用于不同分化程度肺腺癌的鉴别。解释其原因,D、DDC值均受肿瘤细胞密度的影响,低分化的肺腺癌细胞侵袭性强,肿瘤细胞排列密集,造成水分子扩散受限,因此低分化组的D、DDC 值更小。D*与f 值均是反映微循环灌注情况的两个重要指标,理论上,低分化组的肺腺癌恶性程度更高,血供更丰富,肿瘤灌注水平更高,D*与f 值会增高。然而D*与f 值的可靠性一直存在争议,魏毅等[16]在肝癌的病理分级研究中,认为f 与D*值均无意义。Ma 等[17]在胰腺导管腺癌病理分级中发现中高分化的f 值显著高于低分化,D*值差异无统计学意义。本研究显示,低分化组的f值显著高于中高分化组,D*值差异无统计学意义,表明f 值可以用来反映肿瘤组织的血流灌注特性。造成上述差异的可能原因:(1)低分化肿瘤微循环丰富,但丰富的毛细血管血流易受压减速,两者比例不同会使灌注参数产生差异;(2)D*对信噪比变化非常敏感,从而限制了拟合效果[18]。α 值反映水分子扩散的不均质性,与病变成分的复杂程度相关。本研究发现α值不能区分肺腺癌病理分级,这可能与勾画ROI时将囊变及坏死区域排除[19],影响了肿瘤的异质性有关,同时,本试验病例数有限,组间样本量不均衡也对结果产生一定影响。
3.2 APTWI在肺腺癌病理分级中的研究价值
MTRasym(3.5 ppm)值是APTWI 用于反映肿瘤组织内游离蛋白和肽类含量的参数[20-21]。Su 等[22]及Meng 等[23]分别探索了MTRasym(3.5 ppm)值在鉴别不同分级胶质瘤和子宫内膜癌中的价值,其结果均显示由于低分化肿瘤往往拥有更大的细胞密度,更多的组织坏死,因此其内部合成蛋白质及多肽的量明显增加[24],MTRasym(3.5 ppm)值往往增大。在本研究中,低分化组的MTRasym(3.5 ppm)值显著高于中高分化组[25],这与上述研究结果相一致,表明MTRasym(3.5 ppm)值可以有效鉴别不同病理分级的肺腺癌。
3.3 各参数及不同技术联合的诊断效能分析
本研究结果显示,MTRasym(3.5 ppm)在诊断病理分级的AUC 最高,并显著高于除D 值外的其他参数,表明相对于IVIM,APTWI 对鉴别肺腺癌病理分级更有明显的优势。解释可能的原因,组织微观结构的复杂性会导致水分子并不符合高斯分布,IVIM 虽然能将扩散与灌注相分离,但仅能部分反映真实水分子的运动状态,同时IVIM 的灌注参数受信噪比变化、b 值的选择的影响较大[18,26]。然而APTWI 却不受上述因素的影响,并且可以更准确地从分子角度提供肿瘤微环境不同方面的信息。APTWI 在肺部的应用极少,Fang 等[10]研究发现,APTWI 技术可用在肺癌良、恶性及鳞、腺癌的鉴别诊断中,并且APTWI的诊断效能较D、f、D*值更加出色,与本研究结果类似。目前,多技术联合应用已成为热点[27],我们将APTWI 联合IVIM 进行AUC 分析,发现鉴别肺腺癌病理分级的诊断效能得到了显著提高,说明这种联合可以更全面反映肿瘤细胞的代谢及生理信息,将为临床诊断提供更可靠的参考价值。
3.4 SUVmax与各参数值的相关性分析
SUVmax是反映肿瘤葡萄糖代谢程度最常用的半定量指标[9,28]。本研究中,SUVmax 值与MTRasym(3.5 ppm)值呈弱正相关,与D、DDC 值呈弱负相关,表明肿瘤的代谢活性与细胞微环境存在相关性。分析其原因,较高的SUVmax 值反映了肿瘤细胞的增殖能力较强[12],活跃增殖的肿瘤细胞导致细胞密度增大,细胞间隙减小,水分子扩散受限,同时此过程会合成更多的游离蛋白质及多肽[29],故MTRasym(3.5 ppm)值增高且D 值、DDC 值降低。α 值越低,表明微观结构异质性越大,肿瘤恶性程度更高,SUVmax 值越大,但研究并未发现两者之间存在显著相关性,认为这可能与SUVmax仅代表肿瘤单一维度的生物学特征[30],α 值的变异度较高[31],勾画的ROI 存在误差及样本量有限等因素均有关。此外,SUVmax与f值没有显著相关性可能是因为f值受干扰因素过多,随着肿瘤恶性程度增高,相伴而来的充血、水肿等良性反应也会增多[32],因此f值具有更大可变性。
3.5 局限性
这项研究存在一些局限性:首先,本实验样本量较小,未能把中分化与高分化分开进行差异对比,因此尚需大样本研究来进一步验证实验结果;第二,肿瘤直径小于1 cm以及受呼吸运动伪影而造成图像显示不清的患者被排除在外;第三,勾画ROI时将坏死、囊变区域排除在外在一定程度上影响了α值的准确性。
综上所述,APTWI和IVIM均可用于肺腺癌病理分级的无创评估,与IVIM 参数相比,APTWI 参数的诊断效能更高,部分参数与SUVmax 存在一定的相关性。此外,这两种方法的联合可显著提高鉴别肺腺癌病理分级的诊断效能,这将为临床诊断提供更多可参考的信息。
作者利益冲突声明:全体作者均声明无利益冲突。
