美洲型猪繁殖与呼吸综合征病毒荧光定量PCR检测方法的建立
2022-10-06李倩文孙广禄余子豪王晓洁余旭平
查 帆,李倩文,孙广禄,余子豪,王晓洁,余旭平
(浙江大学动物科学学院,浙江 杭州 310058)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS 病毒(PRRSV)引起的猪传染病。世界动物卫生组织(OIE)将其列为法定报告动物疫病,也是我国重点防范的动物疫病。根据基因组和抗原性差异,PRRSV 分为欧洲型(I 型)和美洲型(II 型),两者基因组同源性仅55%~70%[1-3]。在我国的流行株主要为美洲型,且美洲株毒力强、传播速度快、死亡率高,因此需要建立快速检测美洲型PRRSV 的检测方法。
现有报道的PRRSV 荧光定量PCR 检测方法通常只设计一对引物进行优化,而PRRSV 易变异[4],尽管选取保守区设计引物,但该区域基因序列仍存在变异的可能性,为此本研究团队前期针对美洲型PRRSV ORF6 筛选了3 对扩增效果较优引物,本研究建立了基于3 对引物的SYBR Green I 荧光定量PCR 方法,以期通过增加引物覆盖面,提高检测结果的可靠性和准确性。
1 材料与方法
1.1 主要实验材料美洲型PRRSV CH-1R 株cDNA、大肠杆菌JM109 菌株、猪圆环病毒2 型(PCV2)和伪狂犬病毒(PRV)DNA、猪瘟病毒(CSFV)和欧洲型PRRSV 弱毒株cDNA 均由本实验室保存;DL1000 DNA Marker、dNTP、PremixTaq、pMD18-T 载 体 均购自宝生物工程(大连)有限公司;T4 DNA 连接酶、限制性内切酶均购自New England Biolabs 公司;质粒DNA 提取试剂盒、体液病毒DNA/RNA 共提取试剂盒均购自爱思进生物公司;RNA 反转录酶、SYBR qPCR Master Mix 酶购自南京诺唯赞生物有限公司;6 份临床组织样品来自浙江省不同猪场,已经过第三方预检,分别判定1 号、2 号为HP-PRRSV 感染,3、4、5 号为NADC30-like PRRSV 感染,6 号为经典型PRRSV 感染,样品保存于-80 ℃备用。
1.2 引物设计及合成根据GenBank 中60 株美洲型PRRSV(经典型、高致病性、NADC30-like 等)的3'端序列,选择其保守区域设计8 对引物,前期通过常规PCR 筛选出的扩增效果相对最好的3 对引物(扩增区域均对应于ORF6),引物信息见表1。引物由南京金斯瑞生物科技有限公司合成。

表1 引物信息Table 1 Primer information
1.3 重组质粒标准品的构建以PRRSV CH-1R 株的cDNA 作为模板,利用表1 中3 对引物分别进行常规PCR 扩增相应目的片段。PCR 产物回收纯化后连接至pMD18-T 载体,构建重组质粒,经鉴定正确后分别命名为pMD-C1、pMD-C2 和pMD-C3。质粒由华大基因公司测序确认序列正确性,测定相应质粒浓度后,稀释到同一标准浓度作为母液,并计算质粒标准品的拷贝数,-20 ℃保存备用。
1.4 荧光定量PCR 反应条件的优化以1.3 构建的重组质粒标准品为模板,采用1.2 中的引物,利用方阵法进行荧光定量PCR 反应条件优化。采用20 μL反应体系,其中2×SYBR qPCR Master Mix 10 μL、模板2 μL、上下游引物(10 μmol/L)各0.05 μL、0.1 μL、0.2 μL、0.4 μL、0.6 μL、0.8 μL、1.0 μL、1.2 μL,加ddH2O 至20 μL。反应条件为:95 ℃3 min;95 ℃10 s、退火温度设置65 ℃~69 ℃30 s,72 ℃40 s,40个循环。进一步采用方阵法对引物浓度和退火温度进行优化,确定该荧光定量PCR 的最佳反应条件。
1.5 荧光定量PCR 标准曲线的建立分别以10 倍倍比稀释(1.228×108拷贝/μL~1.228×101拷贝/μL)的重组质粒标准品为模板,利用1.2 中的引物和1.4 优化后的反应条件进行荧光定量PCR 扩增,获得相应模板量的Ct 值,通过CFX Manager 软件绘制Ct 值与质粒标准品拷贝数间对应关系的标准曲线。
1.6 荧光定量PCR 的特异性试验分别以PCV2、PRV 的基因组DNA,CSFV 及欧洲型PRRSV 弱毒株的cDNA 和美洲型PRRSV 的重组质粒pMD-C1、pMDC2、pMD-C3作为模板,利用优化后的荧光定量PCR反应条件进行扩增,同时设置阴性对照,评估该方法的特异性。
1.7 荧光定量PCR 的敏感性试验分别以10 倍倍比稀释(1.228×108拷贝/μL~1.228×100拷贝/μL)的重组质粒标准品为模板,用1.2 中的引物和1.4 优化后的条件进行荧光定量PCR 扩增,评估该荧光定量PCR方法的敏感性。同时以上述引物进行常规PCR 扩增,并参照GB/T 35912-2018 PRRSV 荧光定量RTPCR 国标检测方法对上述重组质粒标准品进行测定[5],比较不同方法的检测敏感性。
1.8 荧光定量PCR 重复性试验分别以10 倍倍比稀释(1.228×107拷贝/μL~1.228×104拷贝/μL)的重组质粒标准品为模板,利用1.2 中的引物和1.4 优化后的反应条件进行扩增。组内重复性试验:每个稀释度设3 个重复,重复检测3 次,计算平均值、标准差和变异系数。组间重复性试验:上述重组质粒标准品连续检测3 次,每次间隔1 d,每个稀释度设3 个重复,计算平均值、标准差和变异系数,以评估该方法的重复性。
1.9 临床样品的检测将经过第三方预检的6 份猪临床组织样品研磨后离心取上清,利用DNA/RNA 共提取试剂盒提取核酸,反转录为cDNA 后作为模板,利用本研究建立的荧光定量方法检测,同时利用常规PCR 方法和国标荧光定量PCR 方法检测。对于检测Ct 值偏差较大的预检样品,应用上下游引物扩增并由GenScript 公司测序,对测序结果进行比对,特别关注引物位点的突变情况。
2 结 果
2.1 重组质粒标准品的构建与鉴定结果以PRRSV CH-1R 株的cDNA 为模板,利用1.2 中的3 对引物经PCR 扩增出相应大小的片段(图1),1~3 号引物扩增片段大小分别为441 bp、558 bp、467 bp,结果均与预期一致。将扩增产物克隆至pMD18-T 载体,并经测序鉴定,测序结果与预期相符,结果表明分别正确构建并获得重组质粒标准品pMD-C1、pMD-C2 和pMD-C3,并计算拷贝数均为1.228×108拷贝/μL。
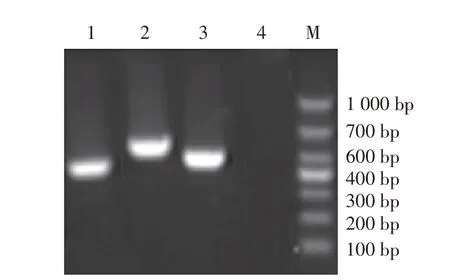
图1 重组质粒标准品的PCR鉴定结果Fig.1 PCR identification results of recombinant plasmids
2.2 荧光定量PCR 反应条件的优化结果通过对SYBR Green I 荧光定量PCR 反应条件的优化,确定1 号和2 号引物20 μL 反应体系为:2×SYBR qPCR Master Mix 酶10 μL,10 μmol/L 上、下 游 引 物 各0.2 μL,模板2 μL,加ddH2O 至20 μL。3 号引物20 μL 反 应 体 系 为:2×SYBR qPCR Master Mix 酶10 μL,10 μmol/L 上、下游引物各0.4 μL,模板2 μL,加ddH2O 至20 μL。反 应 程 序 均 为:95 ℃3 min;95 ℃10 s、68 ℃30 s、72 ℃40 s,40 个循环。
2.3 荧光定量PCR 标准曲线的建立分别以10 倍倍比稀释(1.228×108拷贝/μL~1.228×101拷贝/μL)的重组质粒标准品pMD-C1、pMD-C2、pMD-C3 为模板,利用2.2 优化后的反应条件进行SYBR Green I 荧光定量PCR 扩增,以模板拷贝数的对数为X 轴,Ct值为Y 轴绘制标准曲线。结果显示,基于1 号引物绘制的标准曲线的回归方程为y=-3.480x+43.815,相关系数(R2)为0.992;基于2号引物绘制的标准曲线的回归方程为y=-3.721x+42.012,相关系数(R2)为0.999;基于3 号引物绘制的标准曲线回归方程为y=-3.599x+41.919,相关系数(R2)为0.999(图2)。表明荧光定量Ct值与重组质粒标准品浓度之间存在良好的线性关系。
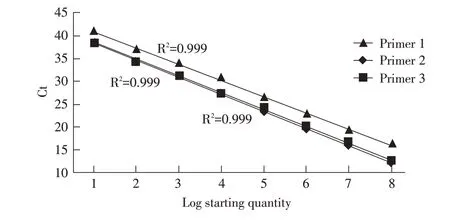
图2 荧光定量PCR 方法的标准曲线Fig.2 Standard curves of the real-time PCR
2.4 荧光定量PCR 特异性试验结果以PCV2、PRV的基因组DNA,CSFV、欧洲型PRRSV 弱毒株cDNA和美洲型PRRSV 重组质粒标准品pMD-C1、pMDC2、pMD-C3 为模板,采用建立的SYBR Green I 荧光定量PCR 方法进行扩增。结果显示仅美洲型PRRSV质粒标准品出现特异性扩增,其他病毒及阴性对照均为阴性(图3),表明建立的方法特异性较强。

图3 荧光定量PCR方法的特异性试验结果Fig.3 Specificity test of the real-time PCR assay
2.5 荧光定量PCR 敏感性试验结果分别以10 倍倍比稀释(1.228×108拷贝/μL~1.228×100拷贝/μL)的重组质粒标准品pMD-C1、pMD-C2、pMD-C3 为模板,分别采用建立的SYBR Green I 荧光定量PCR 方法、国标荧光定量PCR 方法和常规PCR 方法扩增,荧光定量PCR 结果显示,3 对引物的检测下限均为1.228×101拷贝/μL(图4A);与国标荧光定量PCR 方法检测结果的敏感性相同(图4B);常规PCR 结果显示,1 号引物的检测下限为1.228×103拷贝/μL;2 号、3 号引物的检测下限为1.228×104拷贝/μL(图4C)。表明本研究建立的方法敏感性较高,与国标方法相当,但比常规PCR 方法高100 倍和1 000 倍。经多次重复试验,发现基于这3 对引物的荧光定量PCR 方法在检测1.228×100拷贝/μL 质粒模板及阴性(纯水)时,在40 个循环内未检测到扩增荧光信号(无Ct 值,即Ct值大于40.0),因此本研究将40 个循环内是否出现Ct值作为阴阳性的判定标准。

图4 荧光定量PCR方法的敏感性试验结果Fig.4 The results of sensitivity analysis
2.6 荧光定量PCR 重复性试验结果分别以10 倍倍比稀释后(1.228×107拷贝/μL~1.228×104拷贝/μL)的重组质粒标准品pMD-C1、pMD-C2、pMD-C3 为模板,利用优化后的条件进行组内与组间重复性试验。结果显示,3 对引物的组内与组间重复性试验的变异系数均小于2%(表2),表明建立的方法重复性较好。
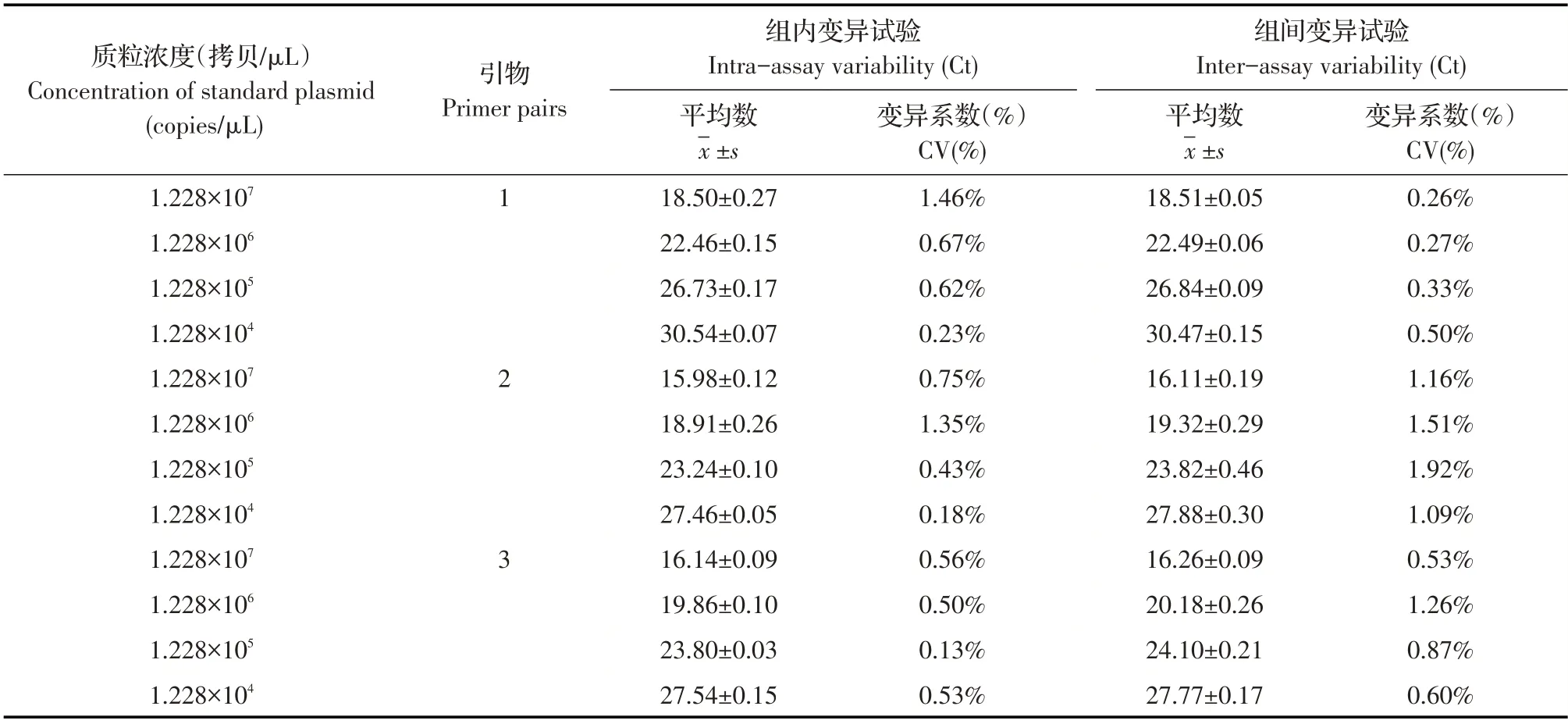
表2 荧光定量PCR方法的重复性试验结果Table 2 The repeatability test of the real-time PCR
2.7 临床样品的检测结果利用建立的SYBR Green I荧光定量PCR方法和常规PCR方法分别对经过第三方预检的6 份猪临床样品进行检测,结果显示,荧光定量PCR 方法的阳性检出率均为100%(6/6)。常规PCR 方法检测的阳性率分别为50%(3/6)、50%(3/6)、83.3%(5/6),进一步表明本研究建立的SYBR Green I荧光定量PCR 检测方法比常规PCR 方法敏感性更高。国标荧光定量PCR 方法的阳性检出率为100%(6/6),从检出率角度看,本实验建立的荧光定量PCR方法与国标方法相当。检测结果显示,同一样品经不同引物扩增的Ct 值有差异:可能经典株的突变率相对较低,3对引物扩增6号样品的Ct 值基本相当;而1号、2号引物扩增3、4、5 号样品(NADC30-like 样品)均出现了Ct 值偏高的现象(检测3 号样品1 号引物偏高,4 号样品2 号引物偏高,5 号样品1 号、2 号引物均偏高);对于HP-PRRSV 样品,3 对引物检测2 号样品的Ct 值基本相当,2 号引物检测1 号样品出现Ct 值偏高的现象。利用国标荧光定量PCR方法对样品的平行检测结果显示,其对5 号样品检测也出现了Ct 值偏高的现象,相对地不如本实验基于3号引物的方法(表3)。对ORF6测序结果显示,1、3、4、5号预检样品的ORF6基因序列在对应引物位置出现了碱基突变,同一样品经不同引物扩增的Ct值出现明显偏差是引物结合位点有一定突变的结果。
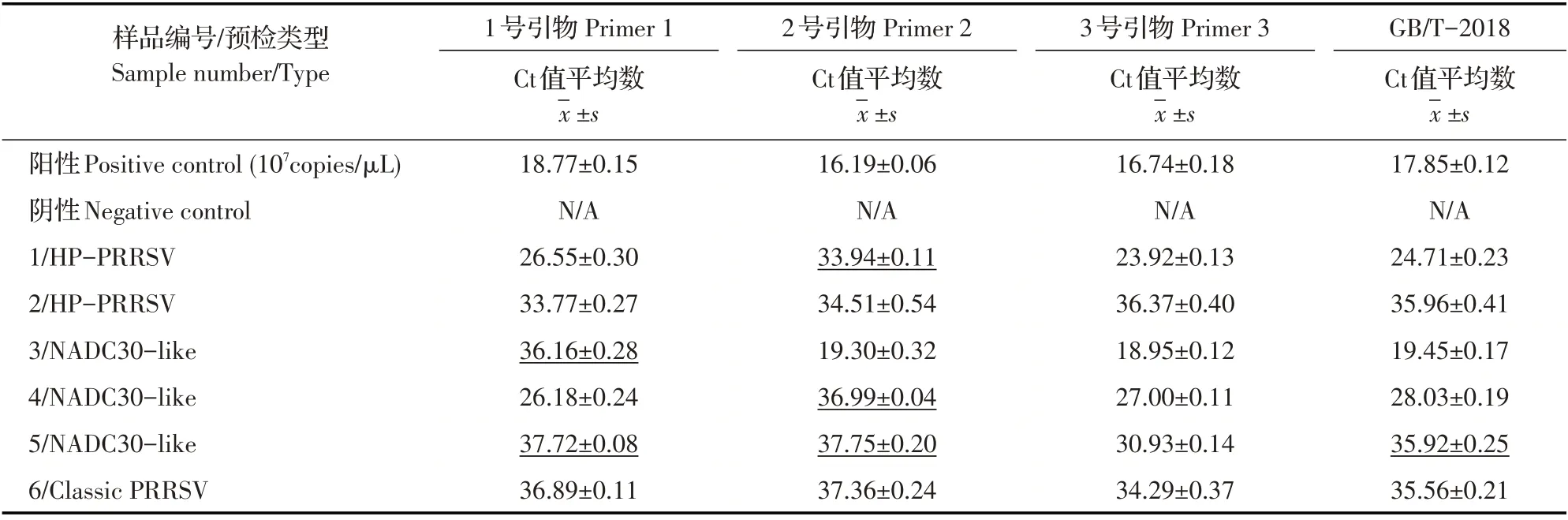
表3 荧光定量PCR检测预检样品的结果Table 3 Detection of pre-tested field samples by real-time PCR
3 讨 论
PRRSV 易发生突变与重组,加之猪场广泛使用包括经典和高致病性PRRSV 的多种疫苗,因此PRRS的防控异常复杂[6-8]。PRRS 的防控需要可靠的检测方法,荧光定量PCR 直接检测病毒核酸,具有快速、敏感性高、可定量等优点。其中SYBR Green I 方法,相比较于TaqMan 探针法,仅设计2 条上下游引物,省略中间杂交探针的设计与合成,相对简单且价格便宜。
SYBR Green I 法荧光定量PCR 检测的是总核酸量,因此保证扩增产物的特异性唯一性尤为重要,本研究前期实验针对GenBank 中不同基因亚型的60 株美洲型PRRSV 3'端序列保守区设计8 对引物,以PRRSV CH-1R 株、JXA1-R 株cDNA 为模板,经常规PCR 筛选特异扩增单一条带(甚至无引物二聚体)效果较好的3 对引物,在此基础上,摸索条件,建立了3 对引物的荧光定量PCR 方法。实验结果显示,建立的3 条标准曲线线性关系良好,检测下限达101拷贝/μL,与国标方法相当,较常规PCR(103拷贝/μL与104拷贝/μL)敏感性提高100 倍以上,变异系数小于2%,重复性和特异性均较好。本研究建立的荧光定量PCR 方法的敏感性是王小武等依据PRRSV N 基因建立的通用检测经典株和高致病性病毒株荧光定量RT-PCR 方法(102拷贝/μL)的10 倍[9];与侯月娥、伍建敏等[10]利用TaqMan 探针及杨峰、周宏超等[11]利用EvaGreen 染料建立的PRRSV 荧光定量PCR 方法(101拷贝/μL)的敏感性相当。
利用建立的荧光定量PCR 方法初步检测了经过第三方预检的6 份样品,结果显示,尽管3 对引物均能100%检出,但也发现同一样品不同引物检测的Ct值出现明显偏差,如1 号引物检测3 号样品(36.16)和5 号样品(37.72)Ct 值偏高;2 号引物检测1 号样品(33.94)、4 号样品(36.99)和5 号样品(37.75)Ct 值偏高。经测序确认,对应样品PRRSV ORF6 基因的引物位置序列出现碱基突变。6 个样品的检测结果显示,3 号引物相对较好,但如果检测的样品数量较多,则不能保证因突变的随机性,也有导致3 号引物扩增样品后出现Ct 值偏高的可能性。同样,国标方法的检测结果显示,国标方法总体上优于1 号、2号引物的荧光定量PCR 方法,但略逊于3 号引物的方法,特别是检测5 号样品时,也出现了引物结合力下降问题,其Ct 值偏高为35.92,而3 号引物检测5 号样品时Ct 值为30.93(对应1 号引物和2 号引物扩增的Ct 值也偏高,分别为37.72 和37.75)。
本研究建立3 对引物荧光定量PCR 方法的初衷是尽量减少因某一对引物的结合位点突变而可能导致漏检、定量不准的问题。相对于仅使用1 对引物,3 对引物增加了引物序列的覆盖面,降低了漏检错检的可能性。采用3 对引物检测某一样品(在排除实验室污染的前提下)时,若出现了某1 对引物的检测结果为阳性,该样品即判定为阳性样品。实际检测时,可用3 对引物(甚至更多对,包括国标引物)预检,选取效果最好(Ct 值最小且稳定)的引物对这一批次样品进一步检测和定量。鉴于PRRSV 易变异的特点,本研究建立的3 对引物的荧光定量PCR 方法,为PRRS 的防控与检测提供了思路和技术支持。
