Bacillus circulans来源β-半乳糖苷酶在Bacillus subtilis中的表达、性质及发酵优化
2022-10-04许俊勇毕然夏伟陈晟
许俊勇,毕然,夏伟*,陈晟*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)3(江南大学,教育部食品安全国际合作联合实验室,江苏 无锡,214122)
随着社会的进步,人们的生活水平越来越高,人们越发注重身体保健,社会上要求发展功能性食品的呼声越来越强烈[1]。低聚半乳糖(galactooligosaccharide,GOS)便是功能性食品中一种具有天然属性的功能性低聚糖[2]。GOS通常情况下是以D-葡萄糖为还原端残基,再连接2~8个半乳糖的寡糖,某些情况下它的还原端也可为半乳糖[3]。GOS在高温以及低pH下的高稳定性让它具有在食品工业中应用的价值[4],并且为了模拟母乳中的人乳寡糖(human milk oligosaccharides,HMOs)的作用,GOS是目前商业婴儿奶粉中首选的益生元添加剂[5]。
由于GOS具有优秀的理化性质和生理性能,国内外有较多学者对GOS展开研究。目前制备GOS方法主要有:从自然界中提取、天然高聚糖的水解、化学合成法、酶法合成等[6-7]。现有商业化GOS主要是利用β-半乳糖苷酶催化转糖基反应进行酶法制备,FRENZEL等[8]对几种不同来源的商品化β-半乳糖苷酶制备GOS进行了比较,发现来自环状芽孢杆菌的商品酶转化率最高,在40%的底物浓度下转化率可达41%。为了提高转化率,很多学者对现有的酶进行改造,WU等[9]对Sulfolobussolfataricus来源的β-半乳糖苷酶进行改造后,转化率可达61.7%。但是目前β-半乳糖苷酶多在大肠杆菌(Escherichiacoli)中表达,同时商品化酶转化率低等原因限制了该酶在食品工业中的应用。
由于枯草芽孢杆菌(Bacillussubtilis)与其他的微生物相比具有优秀的蛋白质分泌能力[10],可以在十分廉价的培养基上生长,并且在工业发酵过程中有着很好的稳定性[11],已被广泛应用于与食品加工相关蛋白的重组表达[12]。对目前常用的发酵宿主E.coli来说,B.subtilis是非致病的[12],同时它还具有十分明确的遗传背景,完善的基因操作工具,这些都使它作为食品代谢工程宿主具有相当强的吸引力[13]。
本研究首次将来自环状芽孢杆菌(Bacilluscirculans)的β-半乳糖苷酶基因β-Gal-Ⅱ[14]在B.subtilis中进行了异源表达,对重组β-半乳糖苷酶进行了酶学性质表征,同时对其制备GOS的能力进行了研究。鉴于该酶具有优秀的GOS制备能力,为了提高该酶的表达水平以降低工业化生产的成本,对重组菌的摇瓶发酵条件进行了优化,并按照优化后的条件成功进行了3-L罐的放大培养及发酵。
1 材料与方法
1.1 实验材料
1.1.1 质粒与菌株
E.coliJM109为本实验室保藏,B.subtilisWS9为本实验室构建及保藏,载体pHY300PLK为本实验室构建及保藏[15]。pHY300PLK是一种穿梭质粒,其上有两个复制原点,可以在E.coli和B.subtilis两种菌体内进行克隆,在E.coli体内表现为氨苄抗性,在B.subtilis体内表现为四环素抗性,同时它在B.subtilis中是一种组成型表达载体。
1.1.2 培养基及培养条件
1.1.2.1 培养基
LB液体培养基(g/L): NaCl 10,酵母粉 5,蛋白胨 10。
LB固体培养基:含有20 g/L琼脂粉的LB液体培养基。
TB液体培养基(g/L):甘油 5,蛋白胨12 ,酵母粉24 , KH2PO42.31 , K2HPO412.54 。
摇瓶优化后的培养基(g/L):甘油5,玉米浆干粉7.5, 安琪酵母粉7.5, KH2PO42.31, K2HPO412.54。
3-L罐发酵基础培养基(g/L): 安琪酵母粉7.5, 玉米浆干粉7.5, 葡萄糖5,MgSO4·7H2O 1, (NH4)2-H-citrate 1,(NH4)2SO42.68, Na2SO32, NaH2PO4·H2O 4, K2HPO414.6,微量元素溶液3 mL。
3-L罐发酵补料培养基(g/L): 安琪酵母粉50, 玉米浆干粉50, 葡萄糖300,微量元素溶液40 mL。
微量元素溶液(g/L): MnSO4·H2O 0.1, CoCl2·6H2O 0.18, CuSO4·5H2O 0.16, ZnSO4·7H2O 0.18,CaCl20.5, FeCl38.35, Na2-EDTA 10.05。以上培养基均在120 ℃灭菌20 min。
1.1.2.2 培养条件
摇瓶种子液培养:从保存在-80 ℃冰箱中的甘油管中,取20 μL接种到10 mL的LB中在37 ℃,200 r/min下培养8~10 h即为摇瓶种子液。
摇瓶发酵培养:将培养好的摇瓶种子液按照5%的接种量转接到优化后的发酵培养基中,在37 ℃,200 r/min的空气摇床中培养2 h后将温度降至 33 ℃ 继续培养24 h。
3-L罐种子液培养:从保存在-80 ℃的冰箱中的甘油管中,取100 μL接种到50 mL的LB中在37 ℃,200 r/min下培养8~10 h即为摇瓶种子液。
3-L罐发酵培养:取培养好的3-L罐种子液100 mL转接到含有900 mL基础培养基的3-L罐中,设置温度33、37 ℃,pH 7.0,通气量保持在1.5 L/min,维持溶氧为30%,转速与溶氧偶联。
1.1.3 主要试剂
质粒小提试剂盒(DP103)以及普通琼脂糖凝胶DNA回收试剂盒(DP209),天根生物科技有限公司;SDS-PAGE试剂盒,碧云天生物技术有限公司;琼脂糖、溶菌酶、氨苄青霉素,上海生工生物工程股份有限公司;DNA和蛋白Marker,东盛生物;其他试剂,上海国药集团有限公司,试剂级别均是分析纯,安琪酵母粉、玉米浆干粉为工业级。液相检测标准品乳糖、异乳糖、半乳二糖,Megazyme公司;半乳糖、葡萄糖,Glycarbo公司。
1.1.4 仪器与设备
PCR仪、Mini Protein 3蛋白胶电泳仪、GelDoc-it凝胶成像仪,美国Bio-Rad公司;3-L全自动发酵罐、小型台式离心机,德国Eppendorf公司;恒温培养箱及摇床,上海知楚仪器有限公司;722型可见光分光光度计,上海市棱光仪器厂;DYY-6C型核酸胶电泳仪,北京六一电泳仪器厂。
1.2 实验方法
1.2.1 重组质粒的构建
根据B.subtilis密码子偏好性,对B.circulans来源的β-半乳糖苷酶β-Gal-Ⅱ (NCBI登录号:QJU69416.1)的编码基因进行密码子优化后,由无锡天霖生物有限公司合成并连接至pET-24a(+)载体,之后通过一步克隆连接的方式进行载体更换。以AATAAGGAGTGTCAAGAATGCGTCGTATTAACTTTAACGATAACTGG为上游引物F,以TTTTTATTACCAAGCTTTCAGTGATGGTGATGGTGGTGC为下游引物R对目的基因进行PCR扩增(下划线部分为载体同源臂部分),以AAGCTTGGTAATAAAAAAACACCTCC为上游引物F′,以TCTTGACACTCCTTATTTGATTTTTTG为下游引物R′对载体进行PCR扩增,对扩增条带进行琼脂糖凝胶电泳并胶回收,利用一步克隆连接酶进行连接。
将连接后的产物转化E.coliJM109感受态细胞并涂布于带有氨苄抗生素(100 mg/L)的LB平板,在37 ℃培养箱中培养12 h左右挑取转化子进行菌落PCR,酶切验证并送测序。
1.2.2 重组β-半乳糖苷酶β-Gal-Ⅱ的表达
将验证正确的重组质粒pHY300PLK-β-Gal-Ⅱ电转入B.subtilisWS9感受态细胞并涂布于含有四环素抗生素(30 mg/L)的LB平板,37 ℃培养箱中培养10~12 h 后挑取3~5个转化子进行质粒提取并酶切验证,将验证成功后的转化子进行摇瓶发酵24 h后测定发酵上清液及破壁上清液的酶活,同时进行SDS-PAGE分析。
1.2.3oNPG水解酶活力测定
取一定稀释倍数的酶液100 μL,加入1.8 mL的pH为5.0的磷酸氢二钾-磷酸二氢钠缓冲液(50 mmol/L,下同)中,并于50 ℃水浴锅中保温5 min后加入100 μL的底物邻硝基苯-β-D吡喃半乳糖苷(2-nitrophenyl beta-D-galactopyranoside,oNPG)(20 mmol/L),准确反应10 min后加入1 mL的Na2CO3(1 mol/L)终止反应并显色,在420 nm处测定溶液吸光值,在上述实验条件下,β-半乳糖苷酶每分钟催化oNPG分解产生1 μmoloNP所需的酶量定义为1个活力单位。
1.2.4 最适pH、温度及pH、温度稳定性
为检测重组β-半乳糖苷酶的最适pH及温度,首先在50 ℃下检测不同pH(3.0~9.0)的酶活力,以最高酶活力为100%,计算各pH下的相对活力。在寻找到最适pH后,在该pH下检测不同温度(30~70 ℃)的酶活力,同样以最高酶活力为100%,计算各温度下的相对活力。
为检测重组β-半乳糖苷酶的pH及温度稳定性,将酶液置于一定pH梯度(3.0~7.0)的缓冲液中并在4 ℃下静置,每隔一段时间取样测量其残余酶活力,以初始酶活力为100%,计算各取样时间下的相对活力。为测量其温度稳定性,将酶液置于一定温度梯度(40~60 ℃)的水浴锅中,每隔一段时间取样测量其残余酶活力,以初始酶活力为100%,计算各取样时间下的相对活力。
1.2.5 摇瓶发酵优化
为满足工业化生产应用,对重组菌株WS9-β-Gal-Ⅱ摇瓶发酵进行发酵优化,首先选取11种氮源替代TB中的蛋白胨及酵母粉,进行氮源种类优化,分别为:酵母浸膏、鱼粉蛋白胨、牛肉蛋白胨、棉籽粉、牛肉浸膏、玉米浆干粉、大豆蛋白胨、猪骨蛋白胨、牛肉粉、安琪酵母粉、豆粕粉;优化后选取较好的4种氮源进行氮源浓度优化;再根据优化结果选取2种氮源进行复合氮源的浓度及配比优化,最终确定重组β-半乳糖苷酶的摇瓶发酵最佳复合氮源及其配比,每种优化结果均以酶活力测定及SDS-PAGE分析来确定。
1.2.6 3-L罐放大培养及优化
3-L罐的初始装液量为900 mL,基础培养基及初始参数设置见1.1.2.2培养条件。接种量为100 mL种子液,待溶氧反弹后开始补料,之后每隔4 h取1次样,测定菌体的OD600值及酶活力。同时在3-L罐上进行发酵温度的优化,除设置33、37 ℃两个发酵温度外,其余所有参数均一致。
1.2.7 制备GOS的研究
以pH 5.0的磷酸缓冲液溶解乳糖制成质量浓度为400 g/L的底物,取10 mL底物于50 mL离心管中并置于水浴摇床(设置参数:50 ℃、150 r/min)中温育10 min,加入酶液至终体系中酶活力为 5 U/mL,反应8 h左右。酶转化产物通过沸水浴10 min后12 000 r/min离心2 min去除蛋白,取上清液稀释20倍后通过HPLC检测并计算转化率。
1.2.8 低聚半乳糖含量的检测
二糖的检测:Agilent 1200 HPLC色谱仪,Agilent自动进样器,色谱柱Thermo Aps-2 HYPERSIL (4.6 mm×250 mm),示差检测器Agilent 2410;流动相为80%(体积分数)乙腈/水溶液,流速和柱温分别设置为0.8 mL/min和35 ℃。
低聚半乳糖中的三糖、四糖、五糖以及乳糖和单糖的检测:Agilent 1200 HPLC色谱仪,Agilent自动进样器,色谱柱Hi-Plex Ca(300 mm×7.7 mm),示差检测器Agilent 2410;流动相为纯水,流速和柱温分别为0.5 mL/min和80 ℃。
GOS产率的计算如公式(1)所示[16]:

(1)
式中:低聚半乳糖为异乳糖、半乳二糖、低聚半乳糖三糖、低聚半乳糖四糖等更高聚合度的寡糖。
2 结果与分析
2.1 重组菌株WS9-β-Gal-Ⅱ的表达
将构建好的重组载体pHY300PLK-β-Gal-Ⅱ转入到B.subtilisWS9中,获得重组菌株WS9-β-Gal-Ⅱ。经摇瓶发酵24 h后,测得重组菌的OD600值为7.72,取648 μL的菌体进行离心并用1 mL磷酸缓冲液进行复溶后破壁,离心获得破壁上清液及破壁沉淀。将重组菌的发酵上清液、破壁上清液、破壁沉淀进行SDS-PAGE分析后发现,在发酵上清液、破壁上清液的91.5 kDa(β-Gal-Ⅱ的理论蛋白分子质量)处均有明显的蛋白条带(图1),表明β-半乳糖苷酶在B.subtilisWS9中可以正常表达,且在无信号肽的情况下可以分泌至胞外,这可能是通过BENDTSEN等[17]的研究中提到的B.subtilis中存在的一种非典型分泌途径进行分泌的。测得发酵上清液和破壁上清液的酶活力分别为1.98、1.65 U/mL。
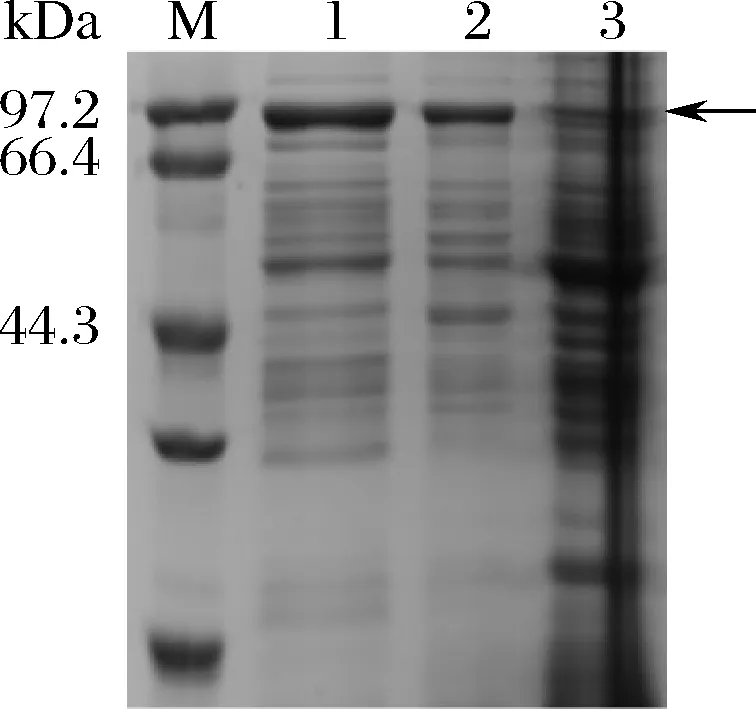
M-蛋白质Marker;1-发酵上清液;2-破壁上清液;3-破壁沉淀
2.2 重组β-半乳糖苷酶β-Gal-Ⅱ酶学性质
在不同pH、温度下测定重组β-半乳糖苷酶β-Gal-Ⅱ 粗酶液的酶活力以获得其最适pH、温度及pH、温度稳定性,结果如图2所示。重组β-半乳糖苷酶的最适pH为5.0,当pH低于5.0时酶活力急剧下降,在pH 5.0~9.0酶活力变化较小。重组β-半乳糖苷酶的酶活力随温度的升高呈现出先上升后下降的趋势,在60℃达到酶活力最高点,当温度上升到70 ℃时,酶活力几乎完全丧失,可能是由于高温破坏了蛋白结构导致其失活。当pH在5.0~7.0,该酶具有很好的pH稳定性,放置24 h后的酶活力依旧可以保持在95%以上,而在pH 3.0和pH 4.0的条件下,该酶很快失活,3 h 降至初始酶活力的30%和50%左右。该酶在 40 ℃ 下具有很好的热稳定性,放置24 h后依旧能保持95%以上的活性,在50 ℃下,3 h左右酶活力降至初始酶活力的53.4%,而在60 ℃下,30 min几乎丧失所有酶活力(图2中未体现),仅剩初始酶活力的2.35%。

a-pH对重组β-Gal-Ⅱ酶活力的影响;b-温度对重组β-Gal-Ⅱ酶活力的影响;c-重组β-Gal-Ⅱ的pH稳定性;d-重组β-Gal-Ⅱ的热稳定性
2.3 重组β-半乳糖苷酶制备GOS
不同来源的β-半乳糖苷酶制备GOS的能力往往有着较大的差异,何乃莹等[18]对一些不同来源的β-半乳糖苷酶制备GOS的条件及转化率进行了整理,多数野生型酶及突变体的转化率低于50%,转化率低一直是亟待解决的问题。我们对该重组β-半乳糖苷酶进行了GOS制备的研究,在底物乳糖质量浓度为40 g/L的条件下,研究了不同温度对该酶制备GOS的影响,结果如图3所示,在50 ℃下反应8 h转化率最高可达60.32%,随着温度的升高可以更早的达到转化率的最大值,但高于50 ℃后最高转化率略有降低,可能是由于高温使得酶有一部分失活从而导致转化率偏低。

a-氨基柱(黑色):1-葡萄糖;2-转移二糖;3-乳糖;4-异乳糖;钙柱(红色):1-四糖;2-三糖;3-二糖;4-葡萄糖;5-半乳糖;b-不同温度下的β-半乳糖苷酶总转化率随时间的变化
2.4 重组菌株WS9-β-Gal-Ⅱ摇瓶发酵优化
该重组β-半乳糖苷酶的最高转化率可达60%左右,高于很多商品酶,且反应时间较短仅需要8 h左右即可达到转化率的最高点,具有很好的工业化应用前景。但目前的该酶催化制备GOS加酶量为5 U/mL,而TB摇瓶发酵酶活力仅为4.55 U/mL,且该培养基成本过高,所以为了提高重组菌株WS9-β-Gal-Ⅱ的表达水平,以进一步降低工业化应用的用酶成本,需要对发酵培养基进行优化以提高表达水平。
本研究主要针对发酵培养基的氮源种类、浓度及复合氮源浓度及配比进行优化,寻找最佳发酵氮源。鉴于摇瓶发酵具有周期短,便于操作等优点,首先在摇瓶中选用了11中不同的氮源替换TB中的酵母粉及蛋白胨,在相同条件下培养24 h后通过检测发酵上清液、破壁上清液的酶活力以及SDS-PAGE分析不同氮源对产酶的影响,结果如图4-a、图4-d、图4-g所示。鱼粉蛋白胨、牛肉浸膏、玉米浆干粉、安琪酵母粉是较好的4种氮源,故选取这4种氮源继续进行氮源浓度的优化。在氮源总质量浓度为20、28、36、40 g/L的梯度下进行,结果如图4-b、图4-e、图4-h所示。由于玉米浆干粉高浓度时在培养基中不能完全溶解,存在大量沉淀,对OD600值的检测具有较大的影响,故玉米浆干粉单独做氮源未检测破壁上清液的酶活力。结果显示,牛肉浸膏、安琪酵母粉、玉米浆干粉质量浓度分别为28、20、28 g/L时有利于β-半乳糖苷酶的表达,但由于牛肉浸膏价格昂贵,考虑工业化生产的成本问题,后续继续选择安琪酵母粉和玉米浆干粉进行复合氮源的浓度及配比优化,结果如图4-c、图4-f、图4-i所示。在尝试了不同浓度的配比之后发现,当安琪酵母粉和玉米浆干粉均为7.5 g/L时,最有利于β-半乳糖苷酶的表达,此时的摇瓶总酶活力最高,可达6.82 U/mL,是TB发酵的1.5倍,单一氮源发酵的2~2.5倍。
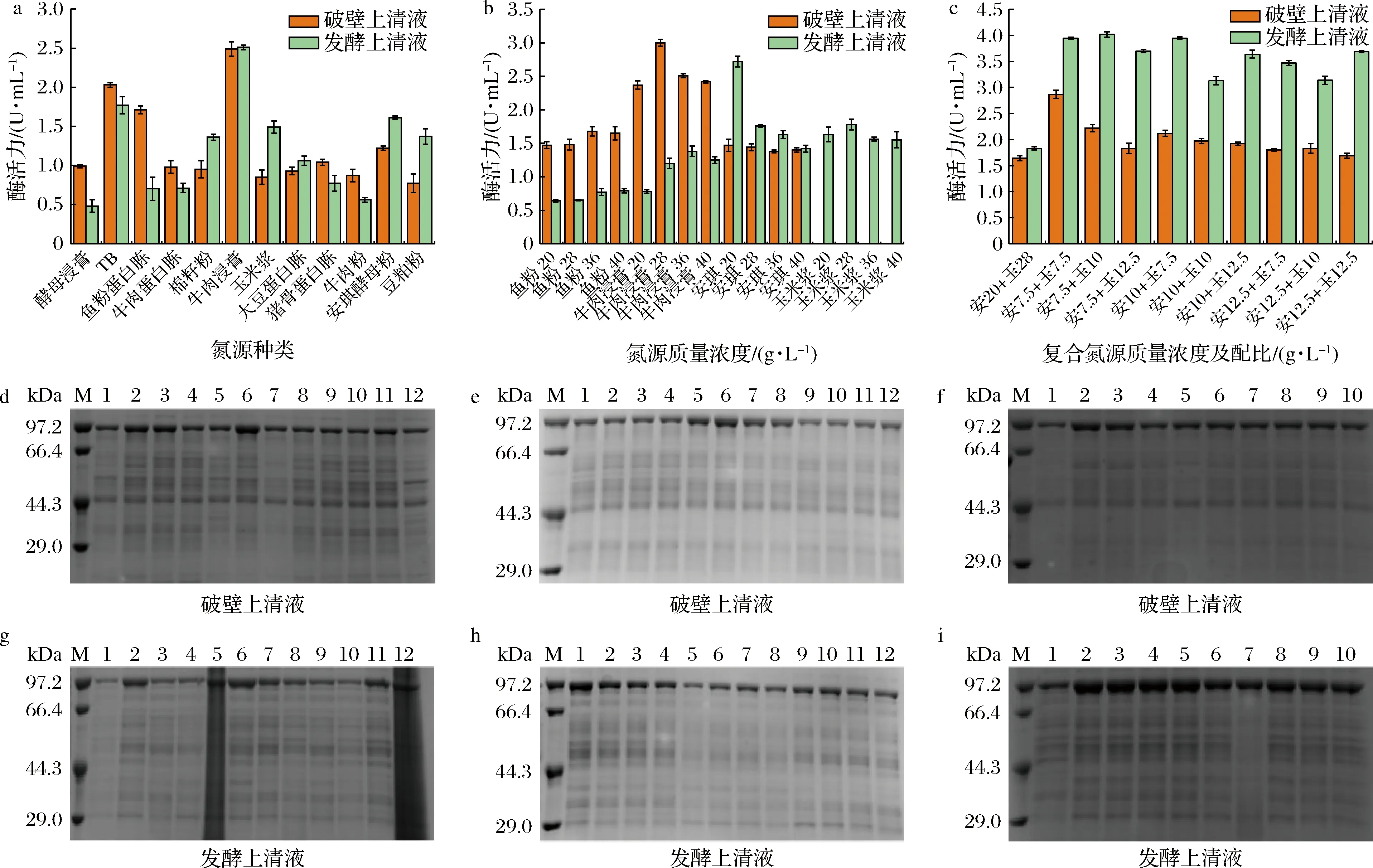
M-蛋白质Marker;a、d、g-TB及11种氮源的摇瓶发酵结果(泳道1~12与a图中横坐标一一对应);b、e、h-4种氮源不同浓度的摇瓶发酵结果(e中的1~4、5~8、9~12分别对应鱼粉蛋白胨、牛肉浸膏、安琪酵母粉质量浓度为20、28、36、40 g/L,h中的1~4、5~8、9~12分别对应牛肉浸膏、安琪酵母粉、玉米浆干粉质量浓度为20、28、36、40 g/L);c、f、i-复合氮源浓度及配比的摇瓶发酵结果(泳道1~12与c图中横坐标一一对应)
2.5 重组菌株WS9-β-Gal-Ⅱ的3-L发酵
刘动斌等[19]曾将SulfolobussolfataricusP2来源的β-半乳糖苷酶在B.subtilisWS9中异源表达并进行了3-L罐的高密度发酵,最终酶活力可达76.5 U/mL,但酶的使用成本依旧过高。本研究在摇瓶水平对重组菌株WS9-β-Gal-Ⅱ的发酵培养基氮源进行了优化,成功将酶活力提高到了TB培养基的1.5倍,具有工业化应用的潜力,故进行3-L罐的放大培养。由于微生物发酵需要在一定的温度下进行,过高过低均不利于微生物的生长及酶的表达,鉴于前人的经验,选择在3-L罐上采用33、37 ℃两种温度进行发酵,菌体的OD600值和酶活力随时间的变化如图5所示。由图5-a可知,在这两种发酵温度下,菌体的OD600值变化基本一致,在发酵84 h左右均达到最高值,且均在120左右。但由图5-b可知,37 ℃发酵下的最高酶活力远远高于33 ℃下发酵的酶活力,并且SDS-PAGE分析结果也显示37℃发酵下的目的蛋白条带要粗于33 ℃发酵下的目的蛋白条带(图5-c~图5-f)。在37 ℃发酵下的最高酶活力可达138.29 U/mL(目的蛋白含量达8.87 mg/mL),是摇瓶发酵酶活力(6.82 U/mL)的20.3倍,成功实现了从摇瓶到3-L的放大培养,具有很好的工业化应用前景。

1~14-发酵26、30、34、40、44、52、56、60、63、68、72、76、80、84 h样品a-3-L罐33、37 ℃发酵菌体OD600值随时间变化曲线;b-3-L罐33、37 ℃发酵总酶活力随时间变化曲线;c-37 ℃发酵上清液;d-33 ℃发酵上清液;e-37 ℃破壁上清液;f-33 ℃破壁上清液
3 结论
本研究成功将B.circulans来源的β-半乳糖苷酶β-Gal-Ⅱ在B.SubtilisWS9中进行了异源表达,其最适pH及温度分别为5.0和60 ℃,该酶在pH 5.0~7.0 具有很好的pH稳定性,在40 ℃下具有很好的热稳定性,50 ℃下3 h左右降至初始酶活力的53.4%,60 ℃下30 min 该酶就几乎完全丧失活性。在以40 g/L 乳糖为底物进行GOS制备时,50 ℃下的转化率略高于40 ℃和60 ℃,反应8 h的GOS得率可达60.32%。由于其具有优秀的GOS制备能力,所以为了提高重组菌株WS9-β-Gal-Ⅱ的表达水平从而降低工业化生产的成本,首先在摇瓶进行了培养基氮源种类、浓度以及复合氮源的浓度及配比优化,最终在氮源为安琪酵母粉7.5 g/L+玉米浆干粉7.5 g/L时摇瓶表达水平最高,酶活力达6.82 U/mL,是TB培养基发酵的1.5倍,是单一氮源发酵的2~2.5倍。根据优化后的培养基进行了3-L罐的放大培养,并同时进行了33、37 ℃的发酵温度优化,发现在这两种发酵温度下的菌体的生长浓度并无差别,但37 ℃发酵下的表达量远远高于33 ℃,最高酶活力可达138.29 U/mL,是摇瓶发酵的20.3倍,成功实现了从摇瓶到3-L的放大培养,为GOS的规模化制备提供了酶制剂发酵的技术基础。
