两种生态型香根草对镉的耐受和积累特性比较
2022-10-01董名扬冯晓晖
董名扬,孙 瑶,冯晓晖,汪 毅,胡 斌,周 强,2*
(1 吉首大学植物资源保护与利用湖南省高校重点实验室,湖南吉首 416000;2 锰锌矿业重金属污染综合防治技术湖南省工程实验室,湖南吉首 416000)
随着人类生产活动和社会发展,大量的重金属被排放到环境中,导致土壤污染严重。镉是对人体毒性最大的重金属之一,其在《全国土壤污染调查公报》的重金属污染元素中排名最高[1],中国约有7%的土壤存在不同程度的镉污染。在《中国耕地地球化学报告》中,中国耕地重金属超标位点占比为8.2%,其中多数为镉、镍等有毒元素复合污染[2]。土壤中的镉被作物吸收并积累在体内,会影响植物的光合作用、新陈代谢、生长发育等过程,并降低其产量和品质。作物体内的镉还能通过食物链等途径进入人体,影响人类健康[3]。因此,土壤镉污染治理刻不容缓。植物修复在治理镉等重金属污染领域有着广阔的前景,与传统的物理和化学修复技术相比,其具有处理费用低、对环境干扰小、不会产生二次污染等优势[4]。比较不同生态型植物对重金属的积累特点,可以筛选修复效果更佳的种质资源和揭示其积累机制,这是目前研究的热点之一。有研究表明不同生态型东南景天(SedumalfrediiHance)[5]、天竺葵(PelargoniumhortorumBailey)[6]和多花黑麦(LoliummultiflorumLam.)[7]对镉的耐受和积累存在明显的差异,为其应用于镉污染治理提供了充分的科学依据。
香根草[Chrysopogonzizanioides(L.) Roberty]为禾本科多年生草本植物,具有根系发达、生物量大、适应性广和抗逆性强等特点,对多种重金属均有一定的富集作用,具有用于植物修复的潜力[8]。香根草作为世界知名的水土保持植物,已选育推广了数十种生态型。周强等[9]研究发现不同生态型香根草的光合特性存在明显差异,Monto等4种生态型香根草的光合日变化呈双峰曲线,而Veriveria nermorlis等2种生态型香根草的光合日变化呈单峰曲线。但不同生态型香根草对镉的耐受能力和积累特性是否存在差异及其耐受镉胁迫的机制都尚不明确。因此,本研究比较了Monto和Veriveria nermorlis两种生态型香根草的镉耐受和积累特征,旨在为香根草应用于镉污染土壤的植物修复提供更加坚实的理论依据。
1 材料和方法
1.1 实验材料
试验在湖南省吉首市进行,Monto(MT)和Veriveria nermorlis(VN)两种生态型香根草引种自中国科学院华南植物园,并长年种植在吉首大学的试验苗圃中。在试验准备阶段,将分蘖繁殖得到的香根草幼苗单株培养,挑选长势健壮的香根草(苗龄5个月)置于1/2 Hoagland营养液中培养,待其恢复生长后进行镉胁迫处理。
1.2 试验设计
将香根草植株固定于塑料盆中,以1/2 Hoagland营养液作为培养液,设置3种浓度的硝酸镉溶液作为轻度(200 μmol·L-1)、中度(800 μmol·L-1)、重度(2 000 μmol·L-1)镉胁迫处理,以1/2 Hoagland营养液作为对照(无镉添加),并将pH调节至5.8。香根草于植物培养箱中培育7 d,每日更换处理溶液。培养期间昼夜温度分别为(28±2)℃和(22±2)℃;白昼16 h·d-1;光照强度为1 000 μmol·m-2·s-1。每处理设置3次重复。培养结束取样进行叶片叶绿素荧光参数和叶绿素含量测量后,植株用20 mmol·L-1EDTA-2Na浸泡根部20 min,再用去离子水反复冲洗,擦干表面水分后,分叶片和根系取样。一部分新鲜样品用于测定亚细胞组分镉含量和不同化学形态镉含量,另一部样品105 ℃杀青30 min后,70~80 ℃烘干至恒重用于镉含量的测定。
1.3 测定指标及方法
1.3.1 叶片叶绿素荧光参数香根草植株暗适应30 min后,采用PAM-2500(Walz,德国)进行叶片叶绿素荧光参数测量。其初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)数值从仪器直接读取,PSⅡ潜在活性(Fv/Fo)按照公式(Fm-Fo)/Fo计算[10]。
1.3.2 叶片叶绿素含量使用SPAD-502便携式叶绿素仪(Konica Minolta Sensing,日本)测量香根草叶片的相对叶绿素含量(SPAD值)。
1.3.3 叶片和根部镉含量称取0.1 g香根草叶片或根系的干燥粉末放置于消解管中,并加入HNO3和HClO4(V∶V=4∶1)混合酸液3 mL,静置6~8 h,然后用石墨消解仪消煮至溶液澄清,冷却并定容至25 mL,再经0.22 μm微孔滤膜过滤。采用石墨炉原子吸收光谱仪(AA-7050型原子吸收分光光度计)测定镉含量。据测定结果分别计算富集系数(bioconcentration factor, BF)和转移系数(translocation factor,TF)[11]。
BF=植株根或叶片中镉浓度/溶液中镉浓度
TF=叶片中镉浓度/根中镉浓度
1.3.4 叶片和根系亚细胞组分的镉含量亚细胞组分的分离采用差速离心法[12]。称取0.2 g植物新鲜样品剪碎,用预先配置好的Tris-HCl缓冲液(M∶V=1∶10,0.25 mol·L-1蔗糖、Tris-HCl 缓冲液[pH 7.5]和1 mmol·L-1二硫赤藓糖醇)研磨成匀浆,转入离心管中,1 000 g离心15 min,得到的沉淀为细胞壁组分;上清液于10 000 g离心30 min,得到的沉淀为细胞器组分;上清液为可溶性组分。所得各亚细胞组分按照1.3.3中的方法消解并测定镉含量。
1.3.5 叶片和根不同化学形态镉含量采用连续提取法[13],分别用下列提取液依次进行不同化学形态镉提取:80%乙醇→去离子水→1 mol·L-1NaCl→2%乙酸→0.6 mol·L-1HCl。称取0.2 g新鲜样品,加入20 mL 80%乙醇提取液研磨、匀浆,并转入离心管中,25 ℃恒温振荡22 h 后,于5 000 g离心10 min,倒出上清液;向沉淀加入20 mL 80%乙醇提取液于25 ℃恒温继续振荡2 h,再于5 000 g 下离心10 min,倒出上清液。合并2 次上清液,蒸发至近干(2~3 mL),用于后续消解处理。离心得到的沉淀用下一种提取液进行提取,重复以上震荡、离心提取过程。最后,经0.6 mol·L-1HCl 提取后得到的沉淀直接消解,即为残渣态。提取得到的样品按照1.3.3中的方法消解并测定镉含量。
1.4 数据分析
文中所列数据为3次重复的平均值,数据表示为平均值±标准误。采用 SPSS 20.0软件进行数据统计和方差分析,并用Duncan法进行多重比较(α=0.05),Excel 2019制作图表。
2 结果与分析
2.1 镉胁迫对两种生态型香根草叶片生长状况、叶绿素荧光参数和SPAD值的影响
图1显示,800 μmol·L-1镉处理时,VN型香根草最外侧叶片开始变黄,而MT型香根草的叶片无明显受害症状;2 000 μmol·L-1时,VN型香根草的叶片全部变黄、枯萎,而MT型香根草仅外侧的叶片开始枯黄,中间的叶片仍为绿色,受害较轻。
同时,通过比较镉胁迫下两种生态型香根草叶片叶绿素荧光参数和SPAD值的变化(表1)发现,与对照(CK)相比,两种生态型香根草叶片的叶绿素荧光参数Fo、Fm、Fv/Fm、Fv/Fo值以及相对叶绿素含量(SPAD值)均随着镉胁迫浓度的增加呈降低趋势。其中,MT型香根草的Fo降幅始终未达到显著水平,其Fm、Fv/Fm、Fv/Fo也均仅在2 000 μmol·L-1镉处理下才比对照显著降低,其SPAD值在各处理间均存在显著性差异。VN型香根草的Fm在200 μmol·L-1镉处理下就已经比对照显著降低,Fv/Fm和Fv/Fo则在800 μmol·L-1镉胁迫处理下就显著降低,而其Fo降幅仅在2 000 μmol·L-1镉处理下才达到显著水平,其SPAD值在各处理间也均存在显著性差异。在相同镉胁迫浓度下,叶片各参数值基本表现为MT型高于VN型;在对照条件下,各参数在两者之间均差异不显著;在200 μmol·L-1镉处理下,仅Fm在两者间有显著差异;在800 μmol·L-1镉处理下,Fm、Fv/Fm和Fv/Fo均在两者间差异显著;在2 000 μmol·L-1镉处理条件下,各参数在生态型间均有显著性差异,此时MT型叶片Fo、Fm、Fv/Fm、Fv/Fo及SPAD值分别比相应对照显著降低14.94%、31.15%、8.18%、25.63%和45.38%,VN型则分别显著降低49.14%、79.04%、46.15%、77.79%和58.93%。可见,在镉胁迫条件下,MT型香根草叶片生长状况更好,叶片的荧光参数和叶绿素相对含量下降幅度小而缓慢,耐镉性更强。
2.2 镉胁迫对两种生态型香根草叶片和根中镉积累量的影响
表2显示,两种生态型香根草根部和叶片镉积累量随着镉处理浓度的升高而显著增加,但MT型的镉积累量大多显著低于相同浓度处理的VN型。其中,在200~2 000 μmol·L-1镉处理下,两种生态型香根草叶和根中的镉含量分别为1.52~36.31 mg·kg-1和64.47~354.09 mg·kg-1,分别比对照增加了2.49~33.99倍和42.98~236.06倍,即根中镉含量及其增幅远高于叶片;除200 μmol·L-1处理组根中镉含量以外,VN型叶片和根中的镉含量均显著高于MT型。同时,随着镉胁迫浓度的增加,两种类型香根草叶片的镉富集系数(BF)均呈先降低后升高的变化趋势,而根中镉的BF值则表现出逐渐显著下降的趋势,且在各浓度处理间多存在显著差异。此外,两种类型香根草镉转移系数(TF)呈先降低后增加的趋势,且在2 000 μmol·L-1处理时大幅度增加,各处理浓度间多存在显著性差异。就两种生态型香根草而言,MT型香根草的镉富集系数和转移系数在大多数情况下要小于VN型。
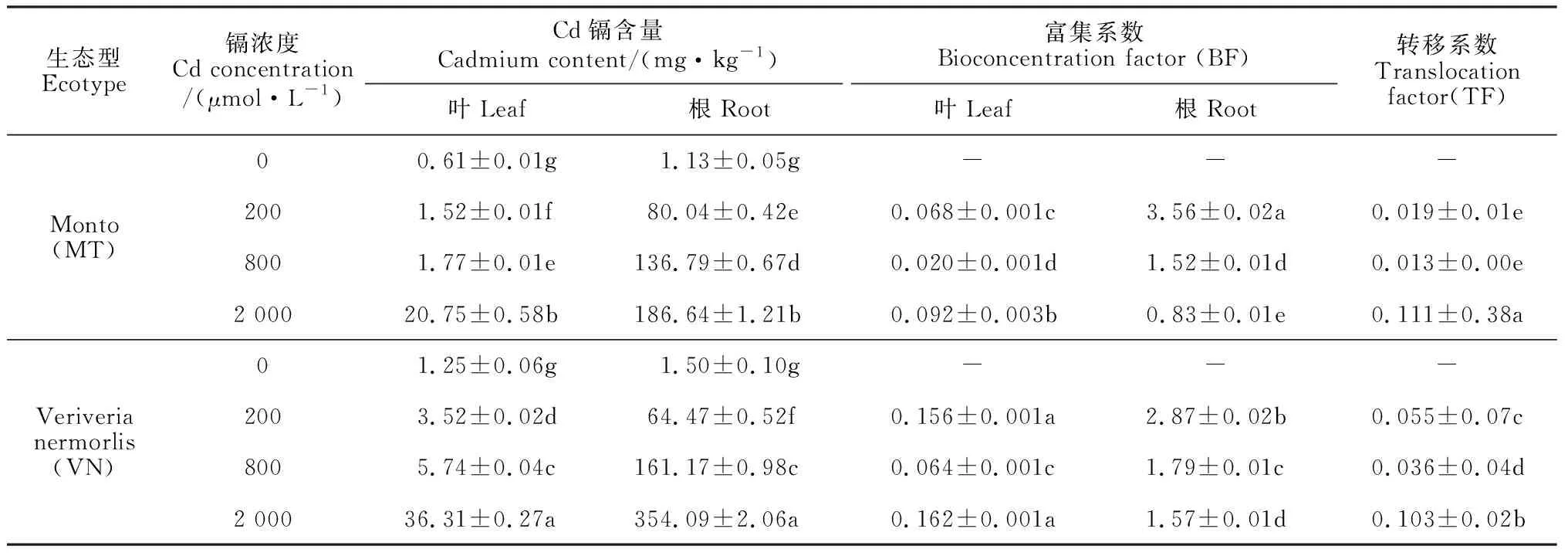
表2 不同浓度镉胁迫下两种生态型香根草叶片和根部镉积累量、富集系数和转移系数的变化
2.3 两种生态型香根草叶片和根中镉的亚细胞分布特征
由表3可知,在200和800 μmol·L-1镉胁迫下,两种生态型香根草叶片细胞壁组分、可溶组分和细胞器组分中的镉含量变化不显著; 在 2 000 μmol·L-1镉胁迫下,VN型叶片中3种组分的镉含量和MT型叶片中细胞壁组分的镉含量才显著增加;VN型叶片中可溶组分和细胞器组分中的镉含量显著高于相应的MT型。同时,在200~2 000 μmol·L-1镉胁迫处理下,VN型叶片中细胞壁组分的镉占比由18.87%增加到75.93%,可溶组分的镉占比由78.48%下降到23.84%;而MT型叶片中2种组分的镉占比在200~800 μmol·L-1镉处理下基本稳定,分别小于40%和小于60%,仅在2 000 μmol·L-1镉处理时,其细胞壁组分的镉占比大幅增加到94.62%,而可溶组分的镉占比下降到5.26%(图 2,A)。
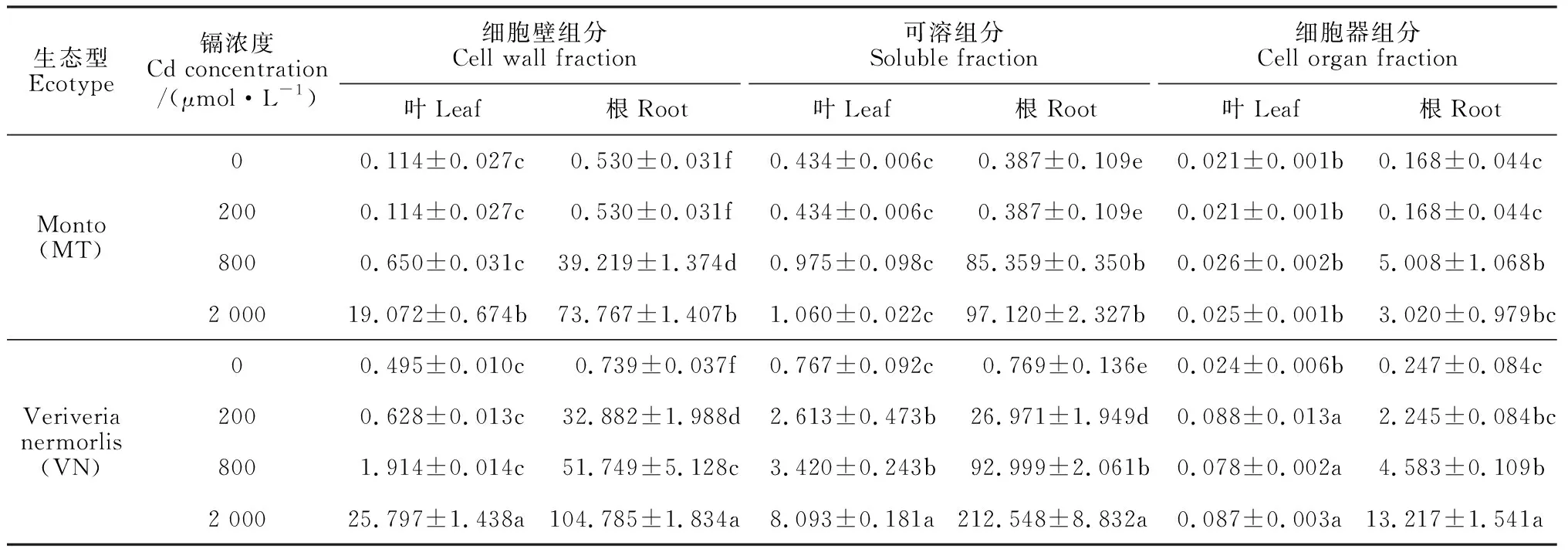
表3 不同镉浓度胁迫下两种生态型香根草叶片和根中镉的亚细胞分布
在200~2 000 μmol·L-1镉处理下,两种生态型香根草根中的细胞壁组分和可溶组分的镉含量均显著增加(表 3);但MT型根中细胞壁组分的镉占比由27.31%逐步增加至42.42%;可溶组分的镉占比则由70.53%逐步下降至55.85%;但VN型的表现则相反,细胞壁组分的镉占比由52.95%下降到31.70%,可溶组分的镉占比由43.43%增加至64.30%(图 2,B)。同时,两种生态型香根草根中细胞器组分的镉含量大多变化不显著(表 3)。总体而言, 除200 μmol·L-1处理的可溶组分镉含量外,VN型香根草根中细胞壁组分和可溶组分镉含量显著高于相应的MT型。
2.4 两种生态型香根草叶片和根中各化学形态镉的分布特征
由表4和图3,A 可知,在200~2 000 μmol·L-1镉胁迫下,两种生态型香根草叶片中均以氯化钠提取态镉含量最高,占比均在90%左右(仅VN型在2 000 μmol·L-1镉处理组为57.80%)。MT型的乙醇提取态、氯化钠提取态、残留态镉含量在3种浓度镉处理间无显著差异;MT型的乙酸提取态、盐酸提取态镉含量在800和2 000 μmol·L-1镉处理下保持稳定,并显著高于200 μmol·L-1镉处理组。VN型的乙醇提取态、氯化钠提取态和盐酸提取态镉含量在2 000 μmol·L-1镉处理下显著高于其他镉浓度处理组;同时,VN型的上述3种提取态和去离子水提取态镉含量也显著高于相应的MT型,尤其是其乙醇提取态、去离子水提取态镉含量分别为MT型的13.2和14.3倍。
表5和图3,B显示,在200~2 000 μmol·L-1镉处理下,两种生态型香根草根中盐酸提取态和残留态镉含量均小于0.3 mg·kg-1,占比均小于2%,它们的去离子水提取态和乙酸提取态镉含量均小于25 mg·kg-1,占比均大多小于10%(VN型的去离子水提取态800 μmol·L-1镉处理组除外);两种生态型香根草根中4种化学形态的镉含量及占比在各浓度镉处理后整体变化较小,其中的乙醇提取态和氯化钠提取态的镉含量和占比较高,并在MT型和VN型间差异显著。MT型和VN型各浓度处理根系的乙醇提取态镉占比分别为69%~77%和27.5%~37.8%,氯化钠提取态镉占比分别为12.22%~19.59%和47.78%~54.75%;MT型200和800 μmol·L-1镉处理组乙醇提取态镉含量约为相应VN型的2.4倍和3.0倍,MT型的氯化钠提取态镉含量仅为VN型的17.7%~29.7%。
3 讨 论
3.1 两种生态型香根草叶片生长状况、叶绿素荧光参数和镉积累对不同浓度镉胁迫的响应
植物体内积累过量的镉,会降低叶绿素的合成效率、破坏叶绿体的微体结构、抑制光合系统活性,进而影响植物的生长。叶绿素荧光参数能体现植物光合作用的能力,其中Fv/Fo反映PSⅡ捕获激发能的传能效率,Fv/Fm反映PSⅡ反应中心原初光能转化效率,其可以反映PSⅡ受伤害的程度,常作为植物胁迫抗性的重要评价指标[14]。BORGES等[15]研究表明镉胁迫会抑制叶绿素的合成从而降低其含量,并能通过增加热耗散、影响电子流传递等方式降低PSⅡ的活性。周蛟等[3]也发现镉胁迫导致两种龙葵的叶绿素含量和叶绿素荧光参数显著下降,但镉耐受能力更强的龙葵(SolanumnigrumL.)的Fv/Fm和Fv/Fo要显著高于少花龙葵(SolanumamericanumMill.)。本研究表明,在800 μmol·L-1镉处理下,MT型生态型香根草叶片无明显受害症状,Fo、Fm、Fv/Fm和Fv/Fo等叶绿素荧光参数基本保持稳定,而VN型香根草最外侧叶片开始变黄枯萎,以上叶绿素荧光参数也出现明显下降;同时,在2 000 μmol·L-1镉处理下,MT型的叶片生长状况、叶绿素荧光参数和叶绿素含量均显著高于VN型。这表明MT型香根草对镉的耐受能力要强于VN型。
研究表明,不同种类、生态型或基因型植物的镉耐受能力和镉积累特性存在明显差异[5]。本研究发现,MT型香根草植株根和叶中的镉含量、富集系数和转移系数均明显低于VN型,这可能是MT型生态型香根草镉耐受能力更强的主要原因。本研究中MT型和VN型香根草将大部分的镉积累在根中,向其地上部转移较少,转移系数远小于1;但其根和叶中积累的镉含量远高于镉耐受能力较强的多花黑麦草(LoliummultiflorumLamk.)[7]和一年蓬[Erigeronannuus(L.) Pers]等[16]。尤其是两种生态型香根草根部 的镉富集和镉积累能力与商陆(PhytolaccaacinosaRoxb.)、青葙(CelosiaargenteaL.)等镉超富集植物[17]相当。一般而言,植物修复重金属污染的效率取决于2个方面,即植物体对环境中重金属的吸收富集能力以及该种植物生物量的大小[18]。香根草生物量大、根中的镉积累量高且富含具有经济价值的香根油,其在镉污染修复领域具有广阔的应用前景。
3.2 两种生态型香根草叶和根中镉亚细胞分布和化学形态对不同浓度镉胁迫的响应
镉被细胞壁或液泡区室化以减弱其活性,是植物对镉毒害的应激性反应[19]。研究表明,秋茄[Kandeliacandel(L.)Druce]叶片和旱柳(SalixmatsudanaKoidz.)根和叶中细胞壁上积累的镉含量占比达到 55%~70%[20-21]。这主要是因为镉离子带正电荷,细胞壁带负电荷,所以镉 容易在细胞壁处被络合而累积[22]。也有研究表明烟草(NicotianatabacumL.)[23]、小麦(TriticumaestivumL.)[24]细胞中的镉主要分布在可溶部分。本研究的两种生态型香根草 叶片中大部分镉积累在细胞壁和细胞可溶部分;可溶性组分的镉含量占比在200和800 μmol·L-1镉处理时超过60%,此时可能更多的镉被区隔在叶片细胞的液泡中;但镉胁迫浓度增加到2 000 μmol·L-1时,可溶性组分的镉占比下降至5.26%~23.82%,此时更多的镉被阻挡在细胞壁中,未进入细胞内。随着镉胁迫浓度的增加,MT型香根草根中细胞壁组分的镉占比逐步上升,可溶组分的镉占比逐步下降,而VN型香根草根中的镉亚细胞分布的变化趋势则相反。这表明MT型香根草可将更多的镉结合到根部细胞的细胞壁中,以减轻镉的毒害作用。
镉等有毒重金属被吸收到植物体内后,以不同的化学结合形态存在于植物中。不同的提取剂可提取不同形态的重金属化合物。去离子水主要提取与水溶性物质形成的重金属化合物,如有机酸盐等;80%乙醇主要提取无机盐、氨基酸盐等可溶盐类重金属化合物;氯化钠可提取与蛋白质结合或吸着态的重金属以及果胶酸盐重金属化合物等;醋酸提取难溶于水的重金属磷酸盐;盐酸提取草酸盐等重金属化合物[25]。在本研究中,氯化钠提取态的镉在两种香根草叶片中均占绝对优势,这表明进入香根草叶片内的镉多以果胶酸盐和蛋白质结合态存在。MT型香根草根中以乙醇提取态的镉为主要部分,其占比为69%~77%,并始终高于VN型(27%~37%)。这暗示MT型香根草更多的镉可能是以无机盐、氨基酸盐等形式被区隔在根部细胞的液泡中,以减轻镉胁迫的伤害[19],这可能是MT型香根草对镉耐受能力更强的另一重要原因。
4 结 论
Monto和Veriveria nermorlis 两种生态型香根草均表现出较强的镉耐受能力和镉积累特性,且Monto的镉耐受性明显强于Veriveria nermorlis,这可能主要与其根、叶中的镉含量、镉富集系数和镉转移系数相对较低,以及叶片细胞壁组分中镉含量占比和根中乙醇提取态镉占比相对较高有关。
