sRNA STnc290对鼠伤寒沙门菌侵染细胞及致病力的影响
2022-09-30宁程程季春辉王立霞李志远孟庆玲才学鹏
宁程程,李 娜,郭 蕴,季春辉,王立霞,李志远,乔 军,孟庆玲,才学鹏
(1.石河子大学动物科技学院,新疆 石河子 832003;2. 中国兽药监察所,北京 100081)
【研究意义】鼠伤寒沙门菌(Salmonellatyphimurium,STM)是一种革兰氏阴性人兽共患病原菌,STM感染人后可引起人类肠炎和败血症[1],感染家畜后可导致家畜急性胃肠炎以及怀孕母畜流产,同时可引起家禽、犬、猫及实验动物等发生副伤寒,表现为胃肠炎或者败血症[2-3]。STM主要的感染途径是消化道,进入体内后可通过其致病岛表达多种毒力因子,在宿主胞内寄生和繁殖[4],不仅给畜牧业的发展带来了极大的经济损失,而且对人类的公共卫生带来严重的威胁。【前人研究进展】细菌小RNA(small RNA,sRNA)是一类长度在40~500 nt[5],能够通过转录后调控mRNA的非编码RNA(no-coding RNA,ncRNA)[6]。sRNAs的合成受到多种因素的调控,通常与特定的环境胁迫或应激条件的诱导有关[7]。研究发现,大多数sRNAs可通过与mRNA碱基互补配对发挥其生物学功能,参与细菌的代谢、环境应激、生物被膜形成及毒力等的调控[9]。【本研究切入点】至今,在STM中已经鉴定出280个sRNA分子,但大部分sRNA对毒力是否有调控作用尚不清楚[8]。研究发现,在STM侵染小鼠巨噬细胞的条件下,sRNASTnc290基因的表达量显著上调[10],但对STnc290的生物学功能至今尚未深入研究。因此,本研究通过分析STnc290基因的分子特征,利用λ-Red同源重组构建STnc290基因缺失株及回补株,通过细胞侵染及小鼠致病性试验检测STnc290基因对STM的影响。【拟解决的关键问题】本研究为深入揭示STnc290基因调控STM的分子机制奠定了基础。
1 材料与方法
1.1 菌株、质粒和试剂
鼠伤寒沙门菌(STM)野毒株SL1344,λ-Red同源重组相关质粒pKD46、pKD3、pCP20、pBR322及小鼠巨噬细胞RAW264.7均由本实验室保存。
pMD19-T 载体、限制性内切酶BamH I和HindIII,购自TaKaRa公司;TaqDNA 聚合酶、dNTPs、T4DNA Ligase、质粒小提试剂盒均购自南京诺唯赞生物科技股份有限公司; DNA Marker 购自北京全式金生物科技有限公司;DNA 胶回收试剂盒、细菌DNA提取试剂盒均购自天根公司。
1.2 引物设计
根据NCBI中公布的鼠伤寒沙门菌SL1344株的全基因组序列(GenBank登录号:FQ312003.1),利用DNAStar软件设计包含STnc290基因扩增引物P1/2、缺失引物P3/4、回补株构建引物P5/6、鉴定引物P7/8,P9/10为pqaA基因扩增引物,P11/12为narX基因扩增引物。上述引物由北京睿博兴生物技术有限公司合成(表1)。
1.3 sRNA STnc290基因的扩增及生物信息学分析
提取STM-SL1344菌株基因组,以P1/2为引物,通过PCR扩增STnc290基因。PCR产物胶回收产物连接pMD19-T,转化至DH5α,菌液PCR验证,筛选阳性单克隆,送至北京睿博兴生物技术有限公司测序。利用softberry软件(http://www.softberry.com/berry.phtmlΔtopic=bprom&group=programs & subgroup=gfindb)预测启动子;利用RNAstructure(http://rna.urmc.rochester.edu)对sRNASTnc290二级结构进行预测;利用TargetRNA2(http://cs.wellesley.edu/~btjaden/TargetRNA2)预测sRNASTnc290作用的潜在靶基因。
1.4 STM-STnc290基因缺失和回补株的构建及鉴定
缺失株构建参考王志林等[11]的方法,以pKD3质粒为模板,用P3/4引物扩增STnc290基因同源左右臂序列。将扩增片段胶回收,电转化至SL1344/pKD46感受态细胞中,用引物P1/2鉴定重组子并测序,重组菌命名为ΔSTnc290::cat。制备ΔSTnc290::cat感受态细胞,将pCP20质粒电转入感受态细胞中,用引物P1/2对重组子进行PCR并测序,筛选得到缺失株ΔSTnc290。以STM-SL1344基因组为模板,以P5/6为引物进行扩增,扩增产物胶回收,连接pMD19-T,测序验证。将验证正确片段与pBR322质粒,分别进行BamH I和HindIII酶切,T4连接酶过夜连接,转化入大肠杆菌DH5α中,菌液PCR验证,验证成功重组质粒电转入ΔSTnc290感受态细胞中,获得互补株ΔSTnc290/STnc290。
1.5 STnc290基因缺失对STM生长特性的影响
挑取STM-SL1344、STM-ΔSTnc290、ΔSTnc290/STnc290单菌落于1.5 mL EP管中,37 ℃ 200 r/min恒温摇床过夜。次日调整菌液OD600nm值为0.2转接至50 mL LB中,每隔2 h分别吸取200 μL菌液测定OD600nm值,连续测定16 h,重复3次,并绘制生长曲线。
1.6 STnc290基因缺失对STM黏附和侵袭细胞能力的影响
侵染细胞试验参照信素华[12]的方法,STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株分别以细菌细胞感染复数比10∶1,侵染2×105小鼠巨噬细胞RAW264.7,37 ℃恒温培养1 h后取出,PBS清洗后,每孔0.2%TritonX-100,重悬细胞细菌混合物,离心6000 r/min,5 min,弃上清,PBS重悬,倍比稀释,涂布SS板计数。侵袭试验感染细胞同上,37 ℃作用1 h后,PBS清洗,加入100 μg/mL庆大霉素的DMEM培养基,37 ℃培养1 h后,裂解细胞,PBS重悬,相同倍比稀释,涂板计数,重复3次。细菌量=平板单菌落/mL×稀释倍数;黏附率=细胞黏附细菌量/每孔加入的总细菌量×100%;侵袭率=细胞内细菌量/每孔加入的总细菌量×100%。
1.7 STnc290基因缺失对STM致病力的影响
将STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株,分别以2×102、2×103、2×104、2×105、2×106、2×107、2×108剂量,腹腔注射6周龄BALB/c小鼠,每个剂量注射6只小鼠。以PBS腹腔注射为阴性对照组,用改良寇氏法计算小鼠半数致死量(LD50),并绘制小鼠生存曲线。野毒株、缺失株、回补株分别以2×104CFU/mL亚致死剂量感染6周龄BALB/c小鼠。分别在第1、3、5、7和9日取小鼠肝脏和脾脏,在PBS中匀浆研磨,倍比稀释,涂板计数,重复3次。
1.8 STnc290基因缺失对预测靶基因表达的影响
将STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌侵染小鼠巨噬细胞RAW264.7,同黏附和侵袭试验条件相同,分别提取总RNA,以P9~P10和P11~P12为引物,利用qRT-PCR进行靶基因pqaA和narX基因转录水平检测。以16sRNA基因作为内参对照,每个样品3个重复。
1.9 数据分析
数据采用GraphPad Prism 5.0软件(USA)进行分析统计。采用方差分析对计量资料进行显著性检验。采用卡方检验对计数资料进行差异性检验。当P<0.05,差异显著;当P<0.01,差异极显著。
2 结果与分析
2.1 STM sRNA STnc290基因的分子特征分析
用引物P1/2扩增STnc290片段测序长度为398 bp,与预期大小相符(图1-B)。测序结果显示,扩增片段大小为398 bp,其中STnc290为79 bp。在STnc290基因上游存在-10box和-35box启动子核心序列,还存在σ因子rpoD16结合位点(图1-A)。STnc290基因的二级结构由3个茎环构成,符合典型的茎环结构(图1-C)。通过TargetRNA2软件预测出pqaA和narX基因2个潜在的靶基因(图1-D)。
2.2 STM-STnc290基因缺失和回补株的构建与鉴定
以P1/2引物扩增产物大小为398 bp,以P3/4缺失引物扩增左右同源臂产物大小为1159 bp(图2-泳道2、3),说明STnc290基因已被含pKD3的左右同源臂片段替换。以鉴定引物P7/8进行PCR,经琼脂糖凝胶电泳验证STnc290片段大小为484 bp(图2-泳道5);ΔSTnc290::cat片段大小为1464 bp,说明同源重组成功,成功将STnc290基因替换(图2-泳道6);ΔSTnc290片段大小为543 bp,说明已成功消除打靶片段,成功获得缺失株(图2-泳道7);ΔSTnc290/STnc290片段大小为484 bp,说明已成功获得回补株(图2-泳道8),以上片段大小均与预测产物相符,测序验证结果均正确。pBR322-STnc290双酶切鉴定,得到4363和399 bp的酶切条带,与预期结果相符(图2-泳道9),说明已成功构建回补株。
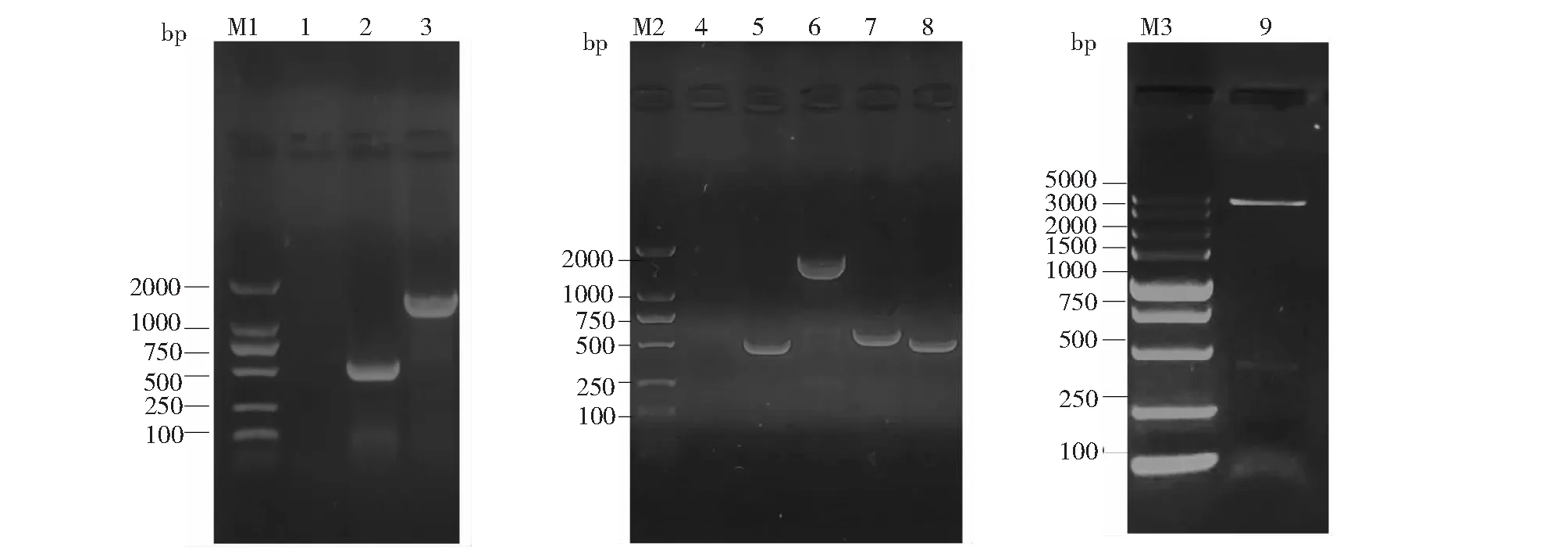
M1、M2、M3: DNA分子质量标准;1:阴性对照;2:引物P1/2扩增STnc290基因片段;3:引物P3/4扩增ΔSTnc290::cat重组株片段;4:阴性对照;5:引物P7/8扩增STnc290基因片段;6:引物P7/8扩增 ΔSTnc290::cat重组株片段;7:引物P7/8扩增ΔSTnc290缺失株片段;8:引物P7/8扩增ΔSTnc290/STnc290回补株片段;9:pBR322-STnc290双酶切验证M1, M2, M3: DNA molecular quality standard; 1: Negative control; 2: Primer P1/2 amplifies STnc290 gene fragment; 3: Primer P3/4 amplifies ΔSTnc290::cat recombinant strain; 4: Negative control; 5: Primer P7/8 amplifies the STnc290 gene fragment; 6: Primer P7/8 amplifies the ΔSTnc290::cat recombinant strain fragment; 7: Primer P7/8 amplifies the ΔSTnc290 deletion strain fragment; 8: Primer P7/8 amplifies the fragment of the ΔSTnc290 deletion strain add ΔSTnc290/STnc290 complement strain fragment; 9: pBR322-STnc290 double digestion verification图2 STnc290基因缺失和回补株的构建与鉴定Fig.2 Construction and identification of STnc290 gene deletion and complementary strains
2.3 STnc290基因缺失对STM生长特性影响
生长曲线结果显示STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290在37 ℃的对数生长期OD600nm均为0.20~0.75,各菌株的生长差异不显著(P>0.05),表明STnc290基因缺失不影响STM的生长特性(图3)。

图3 STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株37 ℃生长曲线Fig.3 Growth curves of STM-SL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains at 37 ℃
2.4 STnc290基因缺失对STM的黏附和侵袭细胞的影响
STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290的黏附率分别为59%、42.3%、51.6%,结果表明,STnc290基因缺失株黏附小鼠巨噬细胞RAW264.7的能力显著低于野毒株STM与回补株ΔSTnc290/STnc290(图4-A)。STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290的侵袭率分别为47.3%、35%、42.3%,结果表明,STnc290基因缺失株侵袭小鼠巨噬细胞RAW264.7的能力显著低于STM(图4-B)。推测sRNASTnc290基因在黏附、侵袭细胞过程中发挥了调控作用。
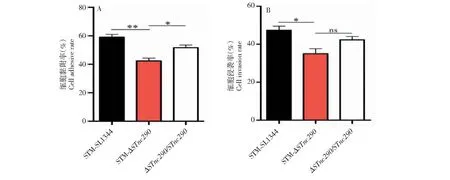
图4 STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株对小鼠巨噬细胞RAW264.7黏附率和侵袭率Fig.4 Adhesion rate and invasion rate of STM-SL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains to mouse macrophages RAW264.7
2.5 STnc290基因缺失对STM致病力的影响
STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠LD50分别是4.2×104、1.3×105、6.2×104CFU/mL(图5-A),缺失株对小鼠毒力显著低于亲本株和回补株。小鼠生存曲线显示,STnc290基因缺失株组小鼠出现死亡明显延长(图5-B)。与STM-SL1344和ΔSTnc290/STnc290相比,STM-ΔSTnc290感染小鼠肝脏和脾脏载菌量在感染第7、9天显著低于野毒株STM(图5-C,5-D)。病理组织学检测发现,STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290组与PBS组比较,感染小鼠肝脏均出现局部肝细胞坏死,出现细胞核溶解,炎性细胞侵润;脾脏红髓白髓界限不明显,间质出血,中性粒细胞浸润。与STM-SL1344和ΔSTnc290/STnc290组相比,STM-ΔSTnc290组病理变化明显减弱(图6)。表明sRNASTnc290基因对STM在宿主体内增殖具有重要的调控作用。

A:STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠LD50;B:STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠生存曲线;C:STM-SL1344与STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠肝脏载菌量;D:STM-SL1344与STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠脾脏载菌量A: STM-SL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains infected LD50 mice; B: STM-SL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains infected mice survival curve;C: STM-SL1344 and STM-ΔSTnc290 and ΔSTnc290/STnc290 strains infected with the bacterial load in the liver of mice; D: STM-SL1344 and STM-ΔSTnc290 and ΔSTnc290/STnc290 strains infected the bacterial load in the spleen of mice图5 STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠LD50、生存曲线及肝脏、脾脏载菌量Fig.5 LD50, survival curve and bacterial loading in liver and spleen bacterial load of STM-SL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains in infected mice
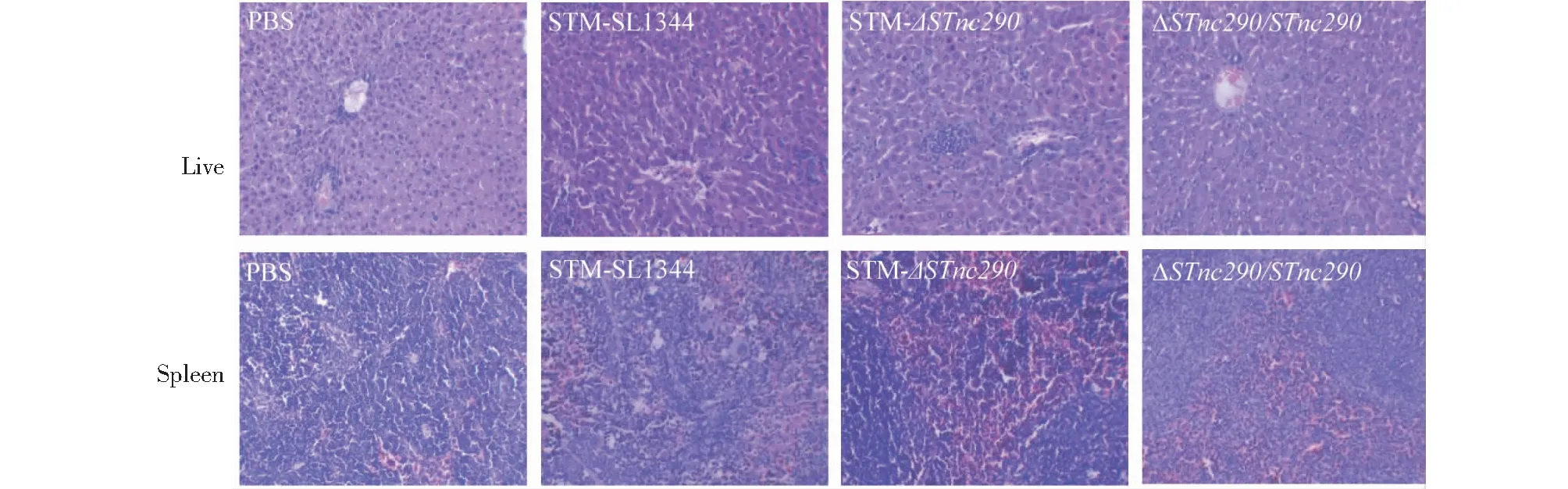
图6 STMSL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株感染小鼠肝脏和脾脏病理组织观察Fig.6 Histopothological observation of liver and spleen of STMSL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains in infected mice(liver and spleen, × 200; HE staining)
2.6 STnc290基因缺失对毒力相关基因表达的影响
预测靶基因转录水平分析结果(图7)显示,STnc290基因缺失株中pqaA和narX基因转录水平均显著降低(P<0.05),推测STnc290基因可正调控pqaA和narX基因的表达,进而调控了STM毒力。

图7 STM-SL1344、STM-ΔSTnc290和ΔSTnc290/STnc290菌株毒力相关基因转录水平Fig.7 Transcription levels of virulence-related genes in STM-SL1344, STM-ΔSTnc290 and ΔSTnc290/STnc290 strains
3 讨 论
STM作为一种重要的食源性胞内寄生菌,可利用其表达的多种毒力因子感染多种宿主,并在宿主细胞中增殖。为了应对细胞内的应激环境[13],STM可利用多种表达调控模式精准调节毒力因子的转录和翻译水平,来迅速应对各种环境应激胁迫[14]。作为转录后水平调控的重要分子,sRNA可利用其部分碱基与mRNA互补配对参与了细菌生物被膜、密度感应系统、III型分泌系统、抗生素耐受、毒力等多个生命过程的调控。目前,在STM中发现并鉴定了280个sRNA分子,然而sRNASTnc290的生物学功能至今尚未研究。
sRNA通常分为顺式和反式编码sRNA。sRNA通过部分碱基与mRNA互补配对来稳定或降解mRNA,从而促进或抑制靶基因的表达,进而发挥其调节功能[15-17]。研究发现,sRNA茎环结构暴露的碱基,能够更容易与靶基因结合[18]。分子特征分析发现,sRNASTnc290基因为反式编码的sRNA,该基因转录本二级结构含有由3个典型的茎环结构,推测STnc290基因通过茎环区域与靶基因部分碱基互补,从而对靶基因进行调控。
STM具有非常广泛的宿主适应性,可感染人和多种动物,引起人和多种动物的多种疾病[2]。在STM感染宿主细胞时,STM可利用多种毒力因子(鞭毛、脂多糖、粘附素和III型分泌系统)来实施入侵和胞内寄生等过程。现有的研究发现,STM毒力岛(已发现17个毒力岛)可编码上百种毒力因子,然而这些毒力因子的表达又受到转录、转录后、翻译、翻译后等多水平的精细调控[19]。sRNA作为STM重要的转录后调节因子,在STM毒力中发挥了重要的作用。研究发现,PinT是一种依赖PhoP的非编码sRNA,sRNAPinT能够同时激活SPI-1和SPI-2毒力基因,形成从入侵细胞到胞内增殖的转变。PinT在起始密码子附近与SPI-1效应器SopE和SopE2的mRNA碱基互补配对引起翻译抑制。同时,PinT直接抑制RNA 编码的蛋白质CRP激活SPI-2,使STM能够在胞内增殖[20]。IsrM是STM毒力岛编码的非编码小RNA,通过与mRNAHilE的核糖体位点结合,调控毒力因子的表达,对入侵上皮细胞、胞内增殖和小鼠毒力等方面发挥着重要的调控作用[21]。Shabarinath等[10]研究STM侵染小鼠巨噬细胞转录组,发现sRNASTnc290基因在感染巨噬细胞中表达量上调,然而对sRNASTnc290基因的侵染细胞及其致病性至今尚未进行研究。本研究证实,STnc290基因缺失株侵染细胞及小鼠致病性能力均显著低于野毒株STM和回补株ΔSTnc290/STnc290,并且回补株生物特性明显恢复,推测STnc290基因可能对STM毒力具有重要的影响。
目前,sRNA的研究主要通过生物信息学预测结合基因缺失株进行表型试验,验证sRNA对靶基因mRNA的调控作用[22]。通过TargetRNA2软件预测STnc290的靶基因,发现2个潜在的靶基因,预测结果显示STnc290基因能够与编码PhoP/PhoQ激活蛋白的pqaA基因上游-49~-34区域碱基互补配对,以及编码硝酸盐、亚硝酸盐传感器蛋白的narX基因上游-58~-43区域碱基互补配对,推测STnc290基因可能参与STM胞内厌氧环境下调控硝酸盐、亚硝酸盐传感器蛋白 NarX代谢分解硝酸盐、亚硝酸盐合成氮源[23-25],以及PhoP/PhoQ系统参与的巨噬细胞内增殖调控[26],因此STnc290基因的缺失降低了STM的毒力。同时,qRT-PCR检测结果显示,STnc290基因缺失株毒力相关靶基因转录水平显著降低,进一步证实了STnc290基因对STM毒力发挥了重要的调控作用。
4 结 论
本研究通过构建STnc290基因缺失株,证实STM-ΔSTnc290对巨噬细胞细的黏附、侵袭能力及小鼠致病性均低于STM-SL1344。同时,sRNASTnc290基因的潜在靶基因pqaA和narX基因在转录水平的表达量均降低,推测sRNASTnc290在毒力及侵入细胞过程中发挥了重要的作用,为进一步揭示STnc290对STM毒力调控的分子机制奠定了基础。
